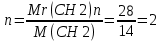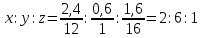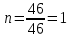ДИПЛОМ. ДИПЛОМ, Аружан. Дипломды Жмыс білім беру бадарламасы 6В01504 (5В011200) химия петропавловск, 2022
 Скачать 3.54 Mb. Скачать 3.54 Mb.
|
1.4 Есептеу химиялық есептерін шешу алгоритмдеріКез-келген тапсырма шарт пен талап сияқты компоненттерді қамтиды. Шешім міндеттері бастайды үйрену шарттары. Есептеу есептерінде әрқашан есептер деректері деп аталатын шамалардың сандық мәні көрсетіледі. Химиялық есептерде мәліметтер тек сандар ғана емес, сонымен қатар химиялық элементтердің, қосылыстардың, химиялық формулалар мен теңдеулердің атаулары болуы мүмкін. Мұндай жағдайларда, осы мәліметтер негізінде физикалық және химиялық шамалардың мәндерін анықтау керек: элементтердің тотығу күйі, зат мөлшері, молярлық масса және т. б. алдымен анықтау керек, қандай шамалармен есептеулер жүргізу керек, өлшем бірліктерін құру керек, есепте қарастырылған реакциялардың формулаларын немесе теңдеулерін жазу керек. Міндетті компонент - бұл талап. Есептеу есептерінде қажетті деп аталатын шамаларды табу қажет. Заттардың молекулалық формулаларын табудың типтік есептерінде бір қарағанда қажетті мән тек сапалық сипатта болады. Шын мәнінде, формуланы шығару үшін қатынасты анықтау үшін есептеулер жүргізу керек молекуладағы атомдар, заттың салыстырмалы молекулалық массасы және т.б. Осылайша, химиялық есеп, математикадан айырмашылығы, химиялық белгілердің, формулалар мен теңдеулердің жасырын түрде белгілі бір сандық деректерді қамтитынына байланысты өзіндік ерекшелікке ие. Мәселені шешу үшін есеп деректері мен қажетті мән арасындағы байланысты анықтау, оларға сәйкес заңдылықтарды орнату қажет. Химияны оқытудың бастапқы кезеңінде химиялық тілді (таңбалар, формулалар, теңдеулер, номенклатура, терминология), формулалар мен теңдеулерді жазу ережелерін, теориялық және фактілік материалдарды меңгеруге көмектесетін сапалы тапсырмалар мен жаттығуларды орындаған жөн. Химияны оқудың кезеңдерінде алған білімдерін тәжірибеде пайдала отырып, химиялық есептерді шығару дағдыларын меңгеру қажет. Есепті шешу үшін математиканы білу, пропорцияларды қолдану, сызықтық теңдеулер мен теңсіздіктерді қолдану қажет [9]. Есептерді шешуде алгоритмдерді қолдану логикалық ойлау қабілетін дамытады, шамалар арасындағы байланыстарды талдайды, зерттелетін нәрседе маңызды нәрсені бөліп көрсетеді, есептерді шешудің оңтайлы жолдарын табады, өз әрекеттерін ретімен «қадамдарға» бөледі. Бір типті есептерді шығару кезінде есептеулерді жылдамдату үшін компьютерлік технологияны (ең қарапайым және бағдарламаланатын микрокалькуляторлар) кеңінен қолдану қажет. Орта жалпы білім беретін және кәсіптік мектептің бағдарламасы келесі есептеудің түрлерін шешуді қарастырады: заттардың салыстырмалы молекулалық массаларын химиялық формулалар бойынша есептеу; белгілі масса немесе реакцияға түсетін немесе алынатын заттардың бірінің саны бойынша зат массасының немесе мөлшерінің химиялық теңдеулері бойынша есептеу; термохимиялық теңдеулер бойынша есептер; ерітіндідегі заттың массалық үлесі мен массасын есептеу; реакцияға түсетін немесе оның нәтижесінде алынатын заттардың бірінің белгілі мөлшері бойынша газ көлемдерін химиялық теңдеулер бойынша есептеу; химиялық теңдеулер бойынша газдардың көлемдік қатынастарын есептеу; газдардың салыстырмалы тығыздығын есептеу; химиялық теңдеулер бойынша есептеулер, егер бастапқы заттардың біреуі артық алынса; теориялық мүмкін нәтижемен салыстырғанда реакция өнімінің массалық немесе көлемдік үлесін анықтау; қоспасы бар бастапқы заттың белгілі массасы немесе көлемі бойынша реакция өнімінің массасын немесе көлемін есептеу; заттың молекулалық формуласын газ тәрізді күйде табу. Есептеу міндеттерінің барлық түрлерін шартты түрде келесідей топтастыруға болады: Химиялық формулалар бойынша есепті шешу үшін қолданылатын тапсырмалар (1,7); Химиялық теңдеулер бойынша есепті шешу үшін пайдаланылатын тапсырмалар (2,3,5,6,8,9,10); Шешімдер мәселелері (4); Химиялық формулаларды шығаруға арналған тапсырмалар (11). Есепті шығару кезінде құрылымы бойынша сызықтық алгоритмдер қолднылады. Мұнда химиядағы есепті шешудің жалпы алгоритмі берілген. 1.Химиялық есептелген тапсырмалардың мәтінің оқыңыз; 2.Жалпы қабылданған шартты белгілерді қолдана отырып, мәселенің шарты мен талабын қысқаша жазыңыз; 3.Химиялық есептің мазмұнына және оның талабына сәйкес химиялық формулаларды, реакция теңдеулерін жасаңыз; 4.Мәселені шешудің ұтымды жоспарын жасаңыз; 5.Мәселенің талаптарын орындау үшін химиялық формулалардан, реакция теңдеулерінен қандай қосымша мәліметтер алуға болатындығын қарастырыңыз; 6. Берілген тапсырмада қажетті барлық әрекеттерді берілген математикалық дәлдікпен жасаңыз; 7.Алынған жауапты жазыңыз. Химия сабақтарында есептерді қолдану әдістемесі. Сабақтың әртүрлі кезеңдеріндегі тапсырмаларды ақылмен қолдана отырып, химияны оқыту әдістерін әртараптандыруға болады: жаңа материалды оқу кезінде; сабақта оқыған материалды бекіту процесінде; сабақта және үйде өз бетінше жұмыс жасау кезінде; оқушылардың білімін ағымдағы тексеру кезінде; зерттелген тақырыпты қайталау және тексеру немесе бақылау жұмыстарын жүргізу кезінде; тақырып бойынша оқушылардың білімін жалпылау кезінде. Жаңа материалды түсіндіру кезінде тапсырмалар оқушыларды зерттелетін тақырыпқа енгізу үшін, қарастырылып отырған заңдар мен теориялық ережелерді бейнелеу үшін қолданылады немесе тапсырмаларды қолдана отырып, оқушыларды заңдардың немесе кез-келген теориялық ереженің қорытындысына әкеледі. Бұл жағдайда белгілі бір шарттарды сақтау қажет. Тапсырманың мәтіні анық, көлемі аз, барлық оқушылар үшін түсінікті болуы керек және тапсырмалар күрделі есептеулерді қажет етпеуі керек. Мәселелерді ауызша шешуді сабақтың әртүрлі кезеңдерінде қолдануға болады: оқушыларды жаңа материалды қабылдауға дайындау кезінде, оны зерттеу барысында. Ауызша тапсырмалар әсіресе сабақта білімді бекіту кезінде пайдалы. Жұмыстың сапасы тапсырмаларды қайта шешудің пайдалы екендігіне сендіреді (бастапқыда үйде де, сыныпта да). Бақылаулар көрсеткендей, көптеген оқушылар бәрін түсінікті деп айтса да, оны шешудің әдісі мен формасын бірден игермейді. Жаттығулар қайтадан өзіндік жазу шешімдер міндеттерді сендіреді оқушылардың қажеттілігіне мұқият қарай есеп айырысу және ресімдеу. Қайта шешім оларға үйде кейінгі тәуелсіз жұмысқа дайын екендіктеріне сенімділік береді. Сондықтан тәжірибелі мұғалімдер әрдайым сабақта және үйде тәуелсіз жұмыс ретінде оқушылардың сабақта оқыған оқу материалдары негізінде қарастырылған түрлердің мәселелерін шешу дағдыларын жетілдіру мақсатында бір немесе екі тапсырманы қамтиды. Оқушылардың білімін ағымдағы есепке алу кезінде жазбаша және эксперименттік мәселелерді шешудің басым сауалнамаларымен қатар қолдану оқушыларға параграфтың мазмұнын механикалық жаттап қана қоймай, оқығанын түсінуге үйретеді. Егер мұғалім білімнің ағымдағы есебін жаңа материалды зерттемес бұрын жүргізсе, онда проблемаларды шешу оқушыларды жаңа материалды түсінуге, бұрын өткенді жаңа оқу материалымен байланыстыруға (дайындауға) мүмкіндік береді. Зерттелген тақырыпты қайталағанда, тексеру немесе тексеру кезінде, білімді жалпылау немесе есепке алу кезінде оқушылардың зерттелген тақырыптың жеке бөлімдері немесе тіпті бірқатар тақырыптар арасында байланыс орнату қабілеттерін тексеру керек. Бұл жағдайда біз біріктірілген есептерді шешуге ұсына аламыз [7]. 1.5 Ақуыз молекулаларындағы пептидтік байланыстарды анықтау алгоритмі Белоктарды сапалы анықтау әдістері үш түрлі реакцияларға негізделген: а) белок молекуласының пептидтік байланыстары бойынша; б) а-амин тобында; в) аминқышқылдарының радикалдарымен. Бірінші типтегі реакциялардың мысалы - биурет реакциясы, екінші түрі - нингидрин реакциясы, ал үшінші түрі - аминқышқылдарының радикалдарына көптеген түсті реакцияларды қамтиды. Үшінші түрдегі түсті реакциялардың табиғаты бойынша ақуыздардың сапалық құрамын бағалауға болады. Мақсаты: Ақуыздарға арналған әмбебап түс реакцияларымен және белок ерітінділерінің құрамындағы жеке аминқышқылдары үшін спецификалық реакциялармен танысу. 1.Биуреттік реакциясы Реактивтер: 30%-дық натрий гидроксиді, 1%-дық мыс сульфаты, ақуыз ерітіндісі. Құрал-жабдықтар: пробиркалар, тамызғыштар. Зерттелетін материал: жұмыртқаның ақ ерітіндісі, өсімдік протеинінің ерітіндісі, 1% желатин ерітіндісі. Жұмыс барысы: 1-2 мл сұйылтылған ақуыз ерітіндісіне 30% натрий гидроксиді ерітіндісінің екі есе мөлшері қосылады, жақсылап араластырылады және 1% мыс сульфатының 2-3 тамшысын қосады. Қайтадан мұқият араластырамыз. Көк-күлгін бояу дамиды. Ақуыз мөлшері аз болған жағдайда реакция сезімталдығын сілтілік ақуыз ерітіндісіне 1 мл мыс сульфатының 1% ерітіндісін қою арқылы арттыруға болады. Екі қабаттың шекарасында тұрған кезде күлгін сақина пайда болады. Реакция биуреттік деп аталады, өйткені 150 - 160̊С температурада қызған кезде мочевинадан оңай алынатын биурет ұқсас түсті реакция береді. 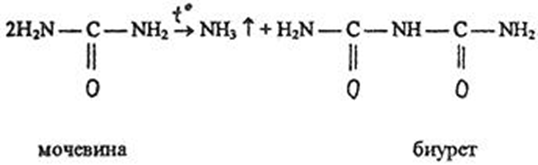 Сілтілі ортадағы биурет схема бойынша энолизденеді: 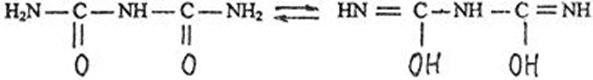 Энол түріндегі екі биурет молекуласы мыс (II) гидроксидімен әрекеттесіп, мыс комплексті қосылыс түзеді: 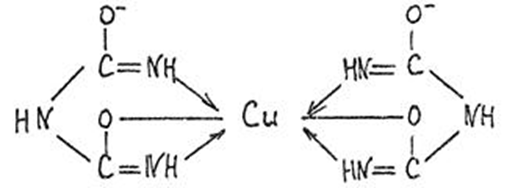 Сол сияқты, кез келген ақуыздың энолизацияланған пептидтік топтары бар мыстың күрделі қосылысы құрастырылады: 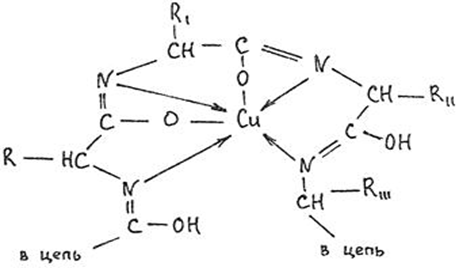 2. Нингидриндік реакция Реактивтер: нинидрин, 1% сулы ерітінді. Құрал-жабдықтар: пробиркалар, тамызғыштар. Зерттелетін материал: жұмыртқаның ақ ерітіндісі, өсімдік протеинінің ерітіндісі, 1% желатин ерітіндісі. Жұмыс барысы: 2 - 3 мл сұйылтылған ақуызға 95% ацетондағы нингидриннің 1% ерітіндісінің 3 - 4 тамшысын құямыз. Ерітіндіні араластырып, 700̊С су моншасына бірнеше минутқа қояды. Көк-күлгін түс пайда болады. Біріншіден, амин қышқылының (немесе ақуыздың) а-амин тобының нингидринмен әрекеттесуі нәтижесінде Шифф негізі пайда болады. Содан кейін ол альдегид пен аминодикетогидинденге қайта түзілуден, декарбоксилденуден және ыдыраудан өтеді.  Аминодикетогидинден басқа нинидрин молекуласымен конденсацияланады, ал пайда болған қосылыс, энолиздеуші, 1910 жылы осы реакцияны алғаш зерттеген зерттеушінің атымен «көк-күлгін Рюман» деп аталатын түсті түрге өтеді. 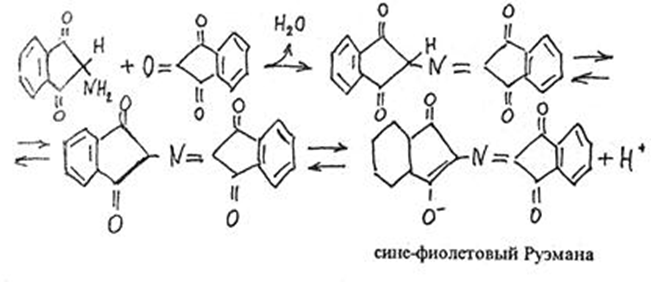 Әдетте нингидрин ерітіндісі дайындалатын органикалық еріткіштер (ацетон, этанол, пиридин және т.б.) болған кезде реакция жүреді: 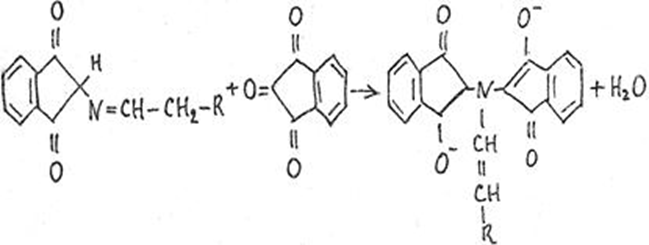 Бұл реакцияның өнімі оның құрамында аминқышқылдарының нингидринмен әрекеттесуі кезінде түзілетін қосылыстардың әртүрлі түстерін (көк, қызыл және т.б.) тудыратын бастапқы амин қышқылының радикалын (R) қамтиды. Қазіргі уақытта нингидрин реакциясы жеке аминқышқылдарын ашу үшін де, олардың мөлшерін анықтау үшін де кеңінен қолданылады [11]. 1.6 Ақуыз молекулаларында бензол сақиналарын анықтау алгоритмі 1.Ксантопротеин реакциясы Реактивтер: концентрленген азот қышқылы, сұйытылған ақуыз, сілті. Құрал-жабдықтар: пробиркалар, тамызғыштар. Зерттелетін материал: жұмыртқаның ақ ерітіндісі, өсімдік протеинінің ерітіндісі, 1% желатин ерітіндісі. Жұмыс барысы: 1 мл сұйылтылған ақуызға ақ тұнба немесе коагуляцияланған ақуыздан лайлану пайда болғанша 5-6 тамшы концентрлі азот қышқылын қосады. Қыздырған кезде ерітінді мен тұнба ашық сарыға айналады. Бұл жағдайда тұнба толығымен дерлік еріген. Қоспаны суытып, қышқыл реакциясы бар ерітіндіге сілтілі реакция пайда болғанша сілтінің артық мөлшерін шайқамай абайлап қосамыз. Алдымен тұнбаға түсетін қышқыл альбуминат тұнбасы ериді және сұйықтық ашық сарғыш түске боялады. Ксантопротеиндік реакция белоктардағы ароматты аминқышқылдарының қалдықтары (фенилаланин, тирозин және триптофан) болғанда ғана жүреді. Құрамында хош иісті аминқышқылдары жоқ желатин ксантопротеин сынамасын бермейді. Ароматты аминқышқылдарының радикалдарында нитрлену реакциясы нәтижесінде сары түсті нитроқосылыстар түзіледі. Сілтілік ортада сары түстің қызғылт сарыға өзгеруі хромофор тобының пайда болуына байланысты. Мысал ретінде тирозин радикалындағы ксантопротеин реакциясының механизмін қарастырайық: 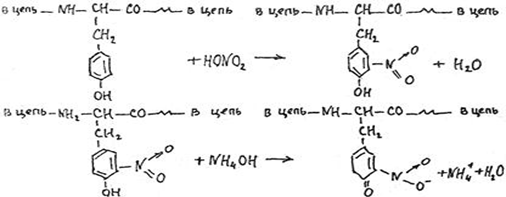 2. Сакагучи реакциясы. Реактивтер: 10% NaOH ерітіндісі, 0,1% спирт ерітіндісі а-нафтол, 2% натрий гипобромиті. Құрал-жабдықтар: пробиркалар, тамызғыштар. Зерттелетін материал: жұмыртқаның ақ ерітіндісі, өсімдік протеинінің ерітіндісі, 1% желатин ерітіндісі. Жұмыс барысы: Пробиркаға 2 мл сұйылтылған ақуыз ерітіндісін алып, 1 мл 10% натрий гидроксиді ерітіндісін, содан кейін 1-нафтолдың 0,2% спирттік ерітіндісінің бірнеше тамшысын қосады. 0,5 мл натрий гипобромиді ерітіндісін қосып араластырыңыз және қайтадан араластырамыз. Қызғылт сары-қызыл түс дамиды. Түстің пайда болуы 1-нафтолдың аргинин радикалдарының гуанидин топтарымен тотықтырғыштың қатысуымен әрекеттесуімен түсіндіріледі. Реакция механизмі әлі толық анықталмағанымен, бірқатар бақылаулар келесі схеманы қолдайды. Біріншіден, 1-нафтол тотықтырғыштың қатысуымен аргининнің гуанидин тобымен біріктіріледі: 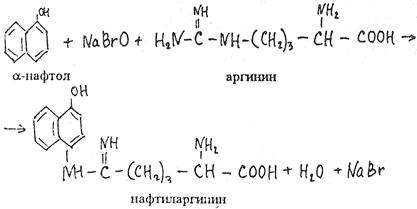 Содан кейін нафтиларгининді одан әрі тотықтырған кезде хинонеиминдік типті қосылыстар түзіледі: 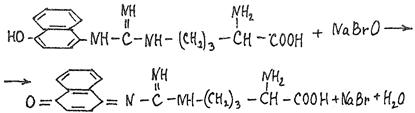 Имино тобындағы сутегі алкил немесе арил радикалымен ауыстырылатын хинонеиминдердің туындылары (бұл жағдайда нафтохинонеимин) әрқашан сары-қызыл реңктермен боялғандықтан, ерітіндінің сарғыш-қызыл түсі болады. Сакагучи реакциясы кезінде аталған нафтохинонеимин туындысының пайда болуына байланысты. Бірақ гуанидин қалдығының NH топтары мен 1-нафтолдың бензол сақинасының одан әрі тотығуы нәтижесінде одан да күрделі қосылыс түзілу мүмкіндігі жоққа шығарылмайды [11]. Отты" үрлеу" Құрал-жабдықтар: иілген шыны түтік (ұзындығы 30-45 см және диаметрі 2 см), оған ортасында тесік бар кортикальды тығын, мақта жүні, шыны таяқша, калий перманганаты, күкірт қышқылы (концентрацияланған), диэтил эфирі салынған. Ескерту: "отты үрлеу" ойын-сауық тәжірибесі калий перманганатының диэтил эфирімен тотығу-тотықсыздану реакциясына негізделген концентрацияланған күкірт қышқылының болуы. Біз калий перманганатының концентрацияланған күкірт қышқылымен қоспасын тікелей иілген шыны түтікке дайындаймыз. Иілген шыны түтіктің таза және құрғақ ұшымен біз кішкене кристалды калий перманганатын аламыз. Концентрацияланған күкірт қышқылын тамшуырға салыңыз. Бірнеше тамшы қышқыл сығып, тұзды сулаңыз. Біз дайындалған қоспасы бар түтікті студент көмекшісіне кенеттен Қозғалмай береміз. Диэтил эфирі бар мақта тампонын (өте тығыз емес) дайындаймыз. Мақта тампонын эфирмен шыны таяқшамен шыны түтіктің ішіне, қоспасы жоқ жерде тез (бірақ бос) итеріңіз. Сол жақтан ауызға ауа үрлейміз. Жанып жатқан эфирдің үлкен жалыны үрленеді. Перғауын жыландары Құрал-жабдықтар: 1 қасық уротропин ұнтағы ("құрғақ спирт"), 3 норсульфазол таблеткасы, демонстрациялық үстелдегі асбест тор, сіріңкелер. Ескерту: демонстрациялық тәжірибеден кейін бөлмені күйдірілген "құрғақ алкогольдің"иісінен желдетуді ұмытпаңыз. Біз тәжірибені келесідей дайындаймыз. Асбест торына уротропин ұнтағын слайдпен салыңыз. Слайдтың жоғарғы жағында бір-бірінен бірдей қашықтықта норсульфазол таблеткаларын орналастырамыз. Дайындалған тәжірибесі бар асбестті торды демо-үстелге қойдық. Поджигаем спичкой верхушку горки. - Норсульфазолдың үш таблеткасынан үш тәуелсіз "жыланның" пайда болуын қадағалаймыз. Егер реакция өнімдері бір "жыланға" жабысып қалса, біз пайда болған "жыландарды"садақпен түзетеміз. Демонстрациялық үстелден ілулі, жасыл реңді әдемі қара жылтыр "жыландар" пайда болады. Қызықты тәжірибесі пайдаланылуы мүмкін ғана емес, сабақтан тыс жұмыс, бірақ сабақтарында (демонстрациялау үшін белгілері мен жүру жағдайларын органикалық заттардың жанғыштығы мен жанғыштығын көрсету). 3.Химиялық хамелеон Құрал-жабдықтар: сыйымдылығы i л химиялық стақан, ақ экран, шыны таяқша, калий хроматының 10% ерітіндісі, сутегі пероксидінің 10% ерітіндісі, күкірт қышқылы (концентрацияланған), диэтил эфирі. Ескерту: ерітінді түсінің өзгеруі хромның тотығу күйінің өзгеруімен байланысты. Жұмыстың барысы: - Калий хроматының ерітіндісін стаканға құйыңыз (бозғылт сары түсі). Біз ерітіндіні бірнеше тамшы күкірт қышқылымен қышқылдандырамыз (пайда болған дихроматтың қызғылт сары түсі). Ерітіндіні шыны таяқшамен араластырыңыз. Ерітіндіге аздап эфир қосыңыз. Сутегі асқын тотығының ерітіндісін құйыңыз (пероксохроматтың көк түсі, әсіресе эфир қабаты). Сутегі пероксидінің ерітіндісін қосыңыз (хром иондарының жасыл түсі (III)). 4. Отсыз бу Құрал-жабдықтар: шыны пластиналары бар 2 жоғары шыны цилиндр, 25% аммиак ерітіндісі, тұз қышқылы (концентрацияланған). Ескерту: аммиак пен концентрацияланған тұз қышқылымен жұмыс істеу ережелерін қайталаңыз. Біз тәжірибені келесідей дайындаймыз. - Таза цилиндрге концентрацияланған тұз қышқылының бірнеше тамшысын құйыңыз. — Жабамыз, цилиндр жабу пластинкамен. - Басқа цилиндрге аммиак ерітіндісінің бірнеше тамшысын құйыңыз. — Біз бұл цилиндрді қақпақ тақтайшасымен жабамыз. — Біз оны бірінші цилиндрден белгілі бір қашықтыққа қойдық. - Оқушыларға екі цилиндрдің де "бос"екенін көрсетеміз. - Концентрацияланған тұз қышқылының тамшылары бар Цилиндр төңкерілген. - Біз оны аммиакпен цилиндрдің қақпағына қойдық. - Цилиндрлерді сол қолыңызбен ұстаңыз. - Мұқият (цилиндрлерді құлатпау үшін) оң қолыңызбен қақпақ тақталарын алыңыз. Цилиндрлердің ішіндегі барлық көлемде" ештеңе " ақ түтін пайда болады. 5.Химиялық кемпірқосақ Жабдықтар: пробиркаларды көрсетуге арналған штатив, демонстрациялық үлкен пробиркалар, темір (III) хлоридінің, калий роданидінің, сынап (II) нитратының, калий иодидінің, барий хлоридінің, калий хроматының, никель (II) сульфатының, гидроксидтің ерітінділері натрий, мыс (II) сульфаты, 25% аммиак ерітіндісі, кобальт хлориді. Ескерту: күн спектрінің түстерін алу ион алмасу және күрделі қалыптасу реакцияларына негізделген. Ақ фоны бар демонстрациялық штативке орналастырылған жеті үлкен түтікте ерітінділерді жұппен біріктіріңіз: 1-темір (III) хлориді және калий роданиді (қызыл түс), 2-сынап нитраты (II)және калий йодиді (қызғылт сары түс), 3-барий хлориді және калий хроматы (сары түс), 4-никель (II) сульфаты және натрий гидроксиді (жасыл), 5-мыс (II) сульфаты және натрий гидроксиді (көк түс), 6-мыс (II) сульфаты және аммиак ерітіндісі (көк түс), 7-кобальт хлориді (II) және калий роданиді (күлгін). 6.Жанартау атқылауы Құрал-жабдықтар: гипс, аммоний дихроматы, лучинка, үлкен қағаз парағы, алкоголь, сіріңке. Ескертпе: "вулкан" атқылауының негізінде-азот, су буы және хром (III) оксидінің қызған борпылдақ бөлшектерін түзе отырып, аммоний дихроматының ыдырау реакциясы. Біз тәжірибені келесідей дайындаймыз. Төбенің гипс макетін үлкен қағаз парағына қойдық (үшін хром (III) оксидін жинау). Шыңның ойығына аммоний дихроматын құямыз қорған. Қорғанның ортасындағы аммоний дихроматын алкогольмен ылғалдандыруға болады (бірақ міндетті емес). Жанып тұрған лучинканы дайындап, аудиториядағы жарықты сөндіреміз. Біз жанартаудың атқылауын жанып тұрған сәулемен қорғанға тигіземіз. Аммоний дихроматының ыдырау реакциясы экзотермиялық. Тұздың ыдырауы тез жүреді, азот пен су буларымен бірге хром (III) оксидінің бөлшектері пайда болады, олар "жанартау кратерінен"ыстық түрінде шығады. 7. Өрт бораны Құрал-жабдықтар: сыйымдылығы 2-5 л үлкен түбі дөңгелек кең мойынды колба, аммиактың 25% ерітіндісі, хром (III) оксиді, колбаның диаметріне сәйкес келетін қыртыстық тығынға салынған жағуға арналған үлкен қасық, жанарғы, пайдаланылған аммиак ерітіндісін төгуге арналған шыны сауыт. Ескерту: хром (III) оксидінің бөлшектері аммиактың тотығу процесінің экзотермиясына байланысты қызылға айналады және шамның ішінде әдемі ұшқын пайда болады. Біз тәжірибені келесідей дайындаймыз. Үлкен кең мойынды колбада (сіз пайдалана аласыз Эрленмейер колбасы) 20 мл концентрацияланған аммиак ерітіндісін құйыңыз. Шамның қабырғаларын аммиак ерітіндісімен шайыңыз, жақсы шамның мазмұнын шайқау. Аммиак ерітіндісін колбадан ағызу үшін бөтелкеге құйыңыз. Біз дайындалған колбаны қақпақ тақтайшасымен жабамыз. Катализаторды (хром оксиді (III)) қасыққа салыңыз заттарды жағу. Біз оны қыздырғыштың жалынында қызылға қыздырамыз. Шамнан тақтайшаны алыңыз (залдағы жарықты өшіріңіз). Аммиак газы бар колбаға қыздырылған катализаторы бар қасық қосыңыз. Катализаторды кішкене бөліктерге колбаға құйыңыз. Шамның ішінде отты боран пайда болады. ІІ. ПРАКТИКАЛЫҚ БӨЛІМ 2.1 Химиялық формулалар бойынша есептерді шешуге арналған алгоритмдік нұсқаулар Химиялық формулалар бойынша есептерді шешу келесі дағдыларды алдын-ала игеруді қажет етеді: химиялық (молекулалық) формулалар құру, салыстырмалы атомдық массалардың анықтамалық кестелерін, химиялық элементтердің периодтық жүйесін қолдану, есептер шарттары мен талаптарын жазу арифметикалық амалдарды (қосу, көбейту және т. б.) орындау, химиялық таңбалардан ақпарат алу, есептеу техникасын пайдалану және т. б. Кесте 2.1 - Салыстырмалы молекулалық массаларды есептеу алгоритмі Мг
Кесте 2.2 - Заттың химиялық формуласы бойынша элементтің массалық үлесін есептеу алгоритмі (ꞷ)
Кесте 2.3 - Егер ерітіндінің массалық үлесі мен ерітіндінің массасы белгілі болса, ерітіндінің массасын табу алгоритмі
Кесте 2.4 - Егер ерітіндінің массалық үлесі мен ерітіндінің массасы белгілі болса, ерітінді дайындауға қажетті су массасын табу алгоритмі
Кесте 2.5 - Заттың белгілі массасы бойынша зат мөлшерін есептеу алгоритмі
Кесте 2.6 - Газдың салыстырмалы тығыздығын есептеу алгоритмі
Кесте 2.7 - Заттың берілген мөлшері бойынша газ көлемін табу алгоритмі
2.2 Химиялық реакция теңдеулері бойынша есептерді шешуге арналған алгоритмдік нұсқаулар. Алгоритмдік рецепттерді қолдана отырып, химиялық теңдеулер бойынша есептерді шешу, ең алдымен, келесі дағдыларды алдын-ала игеруді қамтиды: химиялық теңдеулер, химиялық білімді түрлендіру және қолдану, химиялық белгілермен, формулалармен және теңдеулермен жұмыс жасау кезінде ақпарат алу; химиялық формулалар бойынша есептеу есептерін шешу, математикалық білімді қолдану, есептеу техникасын пайдалану және т. б.[17] Кесте 2.8 - Зат мөлшеріне байланысты массасын анықтау алгоритмі
Кесте 2.9 - Химиялық реакция теңдеулері бойынша газдардың көлемдік қатынасын есептеу алгоритмі
Кесте 3.0 - Термохимиялық реакция теңдеуімен жылу мөлшерін есептеу алгоритмі
Кесте 3.1 - Химиялық реакция теңдеулері бойынша есептеу алгоритмі
Кесте 3.2 - Теориялық мүмкін болатынмен салыстырғанда реакция өнімі шығымының массалық үлесін анықтау алгоритмі
Кесте 3.3 - Құрамында қоспалары бар бастапқы заттың белгілі массасынан өнімнің массасын есептеу алгоритмі
Кесте 3.4 - Элементтердің массалық үлесі бойынша заттың химиялық формуласын табу алгоритмі
Кесте 3.5 - Заттың химиялық формуласын оның тығыздығы және элементтердің массалық үлесі бойынша табу алгоритмі
Кесте 3.6 - Жану өнімдерінің тығыздығы мен массасы бойынша заттың молекулалық формуласын табу алгоритмі
2.3 Бейорганикалық заттарды зерттеуде эксперименттік есептерді шешудің алгоритмдері Химияны оқуда тәжірибелік есептерді шешу маңызды орын алады. Құрылымы бойынша тәжірибелік есептер де, есептеулер де шарт пен талаптан тұрады. Бұл есептердің ерекшелігі - оларды шешу үшін химиялық эксперимент жүргізу қажет. Олар бейорганикалық және органикалық заттарды зерттеуге байланысты тапсырмаларды қамтиды. Эксперименттік есептерді шешу химияның теорияларын, заңдары мен түсініктерін, фактілік материалдарды (заттардың құрамы, қасиеттері, алынуы, сипаттамалық реакциялары туралы), химия ғылымының тілі мен әдістерін терең және берік білуді талап етеді. Эксперименттік есептерді шешуді оңтайландырудың маңызды құралы оларды шешу алгоритмдерін жүзеге асыру болып табылады. Химиядан орта жалпы білім беретін және кәсіптік мектептің бағдарламасы эксперименттік есептердің келесі негізгі түрлерін шешуді қарастырады: Берілген затты тәжірибелік өндіруге арналған тапсырмалар; Заттардың түрленуін тәжірибе жүзінде жүзеге асыруға арналған тапсырмалар; Берілген затқа тән қандай химиялық реакцияларды шешуге арналған тапсырмалар; Заттарды эксперименттік анықтауға арналған тапсырмалар; Дәлелдеуді қажет ететін тапсырмалар (заттың сапалық құрамын растау); Ұсынылған (берілген) екі немесе үш заттардың әрқайсысын тану (анықтау, дәлелдеу, анықтау) тапсырмалары. Эксперименттік есептердің аталған түрлері бір-бірімен тығыз байланысты, әсіресе I және II; III, IV және V; V және VI түрлері. |

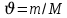
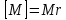
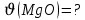
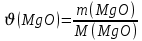
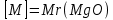
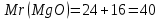
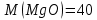 г/моль
г/моль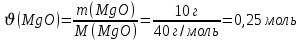
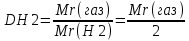
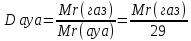
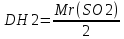
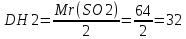
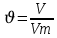
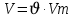
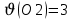 моль
моль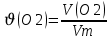
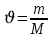 , массасын есептеңіз
, массасын есептеңіз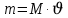
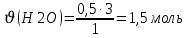
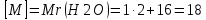
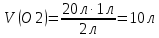
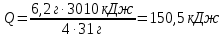
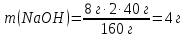 – тұтынылған және 10 г берілген (NaOH артық)
– тұтынылған және 10 г берілген (NaOH артық)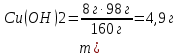
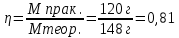
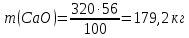
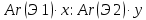
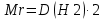
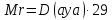 немесе
немесе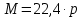
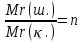
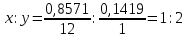
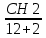 – қарапайым формула
– қарапайым формула