ДИПЛОМ Стадникова. Дипломная работа по специальности 020101. 65 Химия Научный
 Скачать 1.53 Mb. Скачать 1.53 Mb.
|
1010 л моль–1 с–1), тогда как традиционные "протоны губки" протонируются-депротонируются на 4–6 порядков более медленно [25], что повышает вероятность протонирования "протонных губок" снаружи. Таким образом, "протонные губки" можно рассматривать как слабые out-основания (кинетическая основность), но сильные in-основания (термодинамическая основность) (Схема 1b).МИНОБРНАУКИ РОССИИ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Южный федеральный университет» Химический факультет Кафедра органической химии Стадников Илья Сергеевич ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ 1,3-ДИБРОМПРОПАНА С 1-АМИНО- И 1,8-ДИАМИНОНАФТАЛИНАМИ ДИПЛОМНАЯ РАБОТА по специальности 020101.65 – Химия Научный руководитель – проф., д.х.н. Озерянский Валерий Анатольевич Рецензент – ст. преп., к.х.н. Морозов Павел Георгиевич Ростов-на-Дону – 2014 Содержание Введение………………………………………………………………………..............3 Глава 1. Взаимодействие органических дигалогенидов с 1,8-диаминонафталинами (литературный обзор)………………….……..........6 1.1 Реакции 1,8-диаминонафталина, незамещенного по атомам азота…..........7 1.2 Реакции N-алкилированных производных 1,8-диаминонафталина…........11 Глава 2. Обсуждение результатов 2.1. Реакция 1,3-дибромпропана с 1-амино- и 1,8-диаминонафталинами…...14 2.2. Протонирование и основность диамина 4....................................................15 Глава 3. Экспериментальная часть.........................................................................20 Выводы..........................................................................................................................26 Благодарности..............................................................................................................26 Список литературных источников..........................................................................27 Приложение..................................................................................................................30 Введение Хорошо известно, что «протонные губки», включая родоначальника 1,8-бис(диметиламино)нафталин (1) и подавляющее большинство его производных, обычно существуют в так называемой in,in-конформации, в которой метильные группы повернуты наружу, а неподеленные электронные пары азота обращены внутрь межазотного пространства [1,2]. Это имеет два важных следствия. Во-первых, возникает электростатическое отталкивание между неподеленными электронными парами, которое сильно дестабилизирует нейтральное основание. Это во многом определяет чрезвычайно высокую основность протонной губки (pKa = 12.1 в H2O [3], 18.62 в MeCN [4], 7.5 в ДМСО [5]). Действительно, протонирование приводит к образованию хелатных катионов 1H+, удаляет электростатическое и стерическое напряжение и, таким образом, обеспечивает значительный выигрыш свободной энергии. Вторыми следствием in,in-конформации является появление глубокого и жесткого гидрофобного кармана между группами NMe2. На сегодняшний день существует общее мнение, что протонирование-депротонирование соединения 1 происходит исключительно через «расщелину» в этом кармане (схема 1а, структура 2). Рентгеновская структура гидрофторида соединения 1 дает наглядное представление о деталях такого взаимодействия: отчетливо заметно, что основный (нуклеофильный) противоион близок к полному извлечению протона NH из межазотного пространства (Рис. 1) [6]. Отсюда можно заключить, что экспериментально измеримая величина pKa основания 1 и его производных с in,in-конформацией по своему типу относится к внутреннему протонированию.  Схема 1. Внутренний (a) и внешний (b) типы протонирования-депротонирования 1,8-бис(диметиламино)нафталина (1) 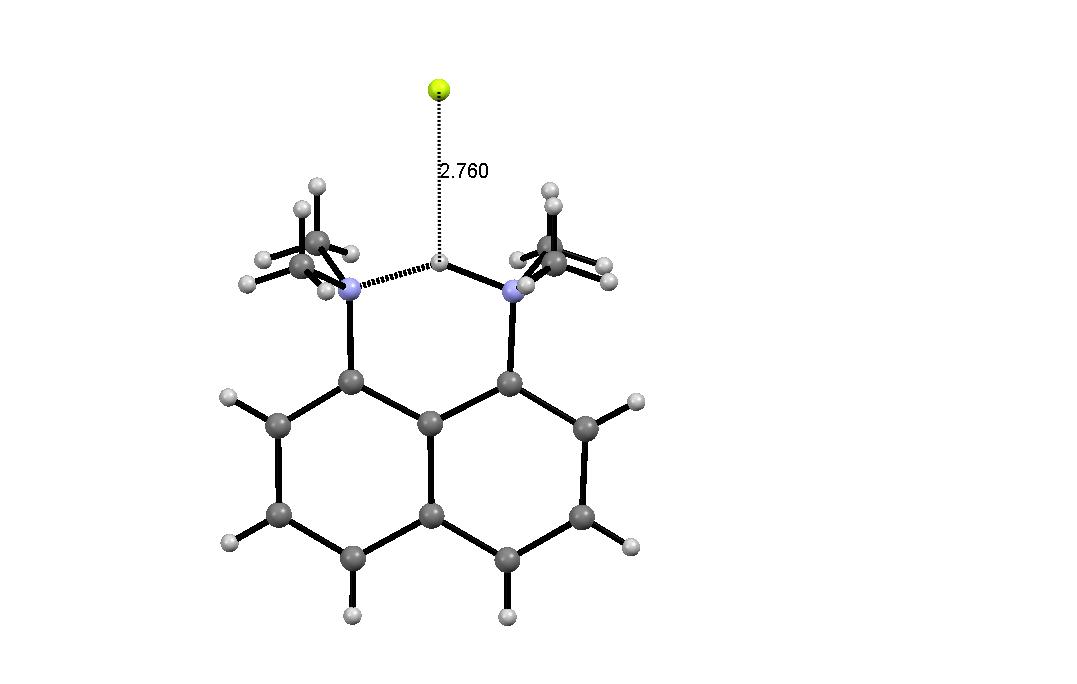 Рис. 1. Намечающееся депротонирование гидрофторида "протонной губки" по данным РСА при комнатной температуре с указанием близкого контакта (Å) между протоном и фторид-анионом [6]. Между тем, известен еще один вид конформации протонной губки, а именно 1(in,out) (схема 1b). Его существование в газовой фазе в качестве примеси к более стабильной 1(in,in) форме было впервые предложено Szemik-Hojniak с сотрудниками на основе флуоресцентной спектроскопии и abinitio расчетов [7]. Они оценили энергетический зазор между этими формами как 4.7 ккал/моль–1. Такая разница подразумевает, что конформер 1(in,in) сильно преобладает в обычных условиях; однако, как было показано экспериментально, при нагревании возникает равновесие, и при 180 oC содержание формы 1(in,out) достигает 33% [7]. Реальность in,out-конформации диамина 1 позволяет выдвинуть альтернативный механизм протонирования, а именно снаружи путем прямого out-протонирования формы 1(in,out) (схема 1b, структура 3) или через out-инверсию формы 1(in,in), индуцированную электростатически приближающимся с внешней стороны протоном с образованием комплекса 3 и последующим переносом протона в межазотное пространство: 1H+(out) 1H+(in). К настоящему времени не разработано ни одного прямого метода определения константы pKa для процесса out-протонирования (вполне возможно, что его просто не существует). Поэтому в настоящей работе был выбран подход, основанный на непосредственном измерении основности модельного соединения ряда «протонных губок», способного однозначно подвергаться out-протонированию. В качестве такого соединения нами был выбран нафто[1,8-bc]-1,5-диазобицикло[3.3.3]ундекан (4). 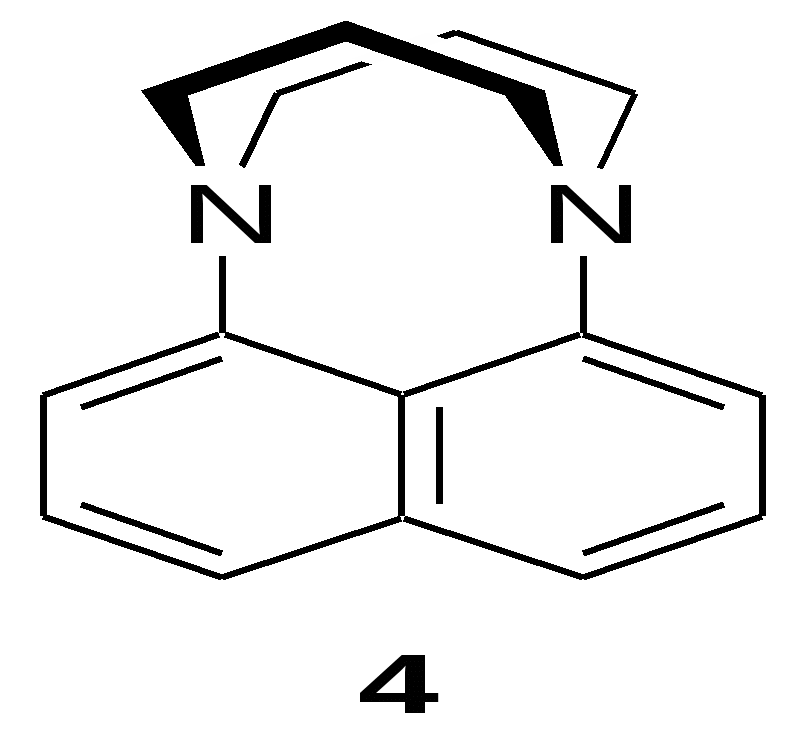 Для синтеза такой модели требовалось исследовать взаимодействие 1,8-диаминонафталина с 1,3-дибромпропаном, в связи с чем целями работы стали:
Глава 1 Взаимодействие органических дигалогенидов с 1,8-диаминонафталинами (литературный обзор) Реакции, выбранные нами для настоящего литобзора, в целом могут быть отнесены к реакциям алкилирования ароматических аминов галогеналканами в присутствии какого-либо основания. Специфика процессов взаимодействия 1,8-диаминонафталина 5 и его аналогов с дигалогенидами состоит в неоднозначности результатов алкилирования по причине бифункциональной природы как нуклеофила (ароматического диамина), так и электрофила (органического дигалогенида). Во-первых, могут образовываться продукты межмолекулярного взаимодействия, что снижает выходы целевых бициклических (6) и циклических (7) производных (Схема 2).  Схема 2. Основой путь реакции алкилирования бифункциональных нафтиламинов Во-вторых, существует неоднозначность в соотношении образующихся продуктов 6 и 7, которое зависит от длины органического фрагмента, разделяющего атомы галогенов (бром на схеме 2). В ряде случаев, о чем можно узнать ниже, получается только какой-то один из структурных изомеров (6 или 7). Общая тенденция такова: чем короче органический мостик, тем больше продукта 6. 1.1 Реакции 1,8-диаминонафталина, незамещенного по атомам азота Одно из первых упоминаний о взаимодействии незамещенного 1,8-диаминонафталина с органическими дигалогенидами описано в статье английских исследователей, которые получили бициклические соединения 4 и 8 с использованием дибромэтана и дибромпропана (Схема 3) [8].  Схема 3 Соединение 8 в этих условиях было получено с низким выходом (5%), наряду с другими продуктами. Вещество 4, из-за менее напряженных триметиленовых мостиков, получено уже с хорошим выходом, который, однако, в оригинальной работе не детализируется [8]. Несколько позже, канадские ученые сделали попытку получить соединение 9, которое объединяло бы в себе свойства протонной губки 1 (т.е. сильного органического основания) и криптанда 10 [9].  Однако, вопреки ожиданиям, исследователи смогли выделить только бис(морфолиновое) производное 11 с низким выходом (Схема 4).  Схема 4 Соединение 11 оказалось неплохим основанием в воде (pKa 7.5), но не обладает свойствами криптанда, поскольку является открытым диамином. Несколько позднее [10] было показано, что это же соединение образуется с выходом 10% и при использовании соответствующего дихлорида. Однако в этом случае приходится использовать более сильное основание (10% NaOH). Интересно, что алкилированный диамин 11 был в последствии использован как субстрат для азосочетания с солями диазония с целью синтеза новых азокрасителей с повышенными величинами λmax и гидрофобностью для лучшей растворимости в полиэфирных волокнах [10]. Множество интересных соединений получил Альдер с коллегами [11] алкилированием незамещенного диаминонафталина. Некоторые из них представлены на Схеме 5. В большинстве случаев растворителем являлся ДМФА или реакции проводились без растворителя в избытке соответствующего дигалогенида. Выходы продуктов 4, 11–16 составляли от 5% до 60%. Наилучшие результаты получаются тогда, когда вещества содержали пяти- и шестичленные циклы.  Схема 5 Несколько позднее английские ученые, при изучении кислотно-основных свойств производных диаминонафталина, синтезировали аналоги соединения 11 с дополнительными метокси- и этоксигруппами (Схема 6) [12]. Вероятно, пространственные помехи, вызванные присутствием орто-заместителей, оказываются причиной низких выходов.  Схема 6 В 2008 году появилось сообщение французских ученых о синтезе соединений 18–20 с использованием 2,2’-бис(бромметил)-1,1’-динафтила 23 (в том числе и в оптически чистой форме) (Схема 7) [13]. В частности, алкилирование диамина 2 дает смесь двух продуктов гетероциклизации – 24 (81–86%) и 25 (8–10%). Последний обработкой диметилсульфатом в присутствии гидрида натрия переведен с выходом 78% в тетраалкилпроизводное 26.  Схема 7 Несколько позднее итальянские исследователи [14] повторили синтез этих соединений в оптически чистой форме для их возможного использования в качестве хиральных лигандов для Rh- и Ru-катализаторов реакций стереоселективного кросс-сочетания. 1.2 Реакции N-алкилированных производных 1,8-диаминонафталина Обычно N,N’-диметил-1,8-диаминонафталин (21) используется для построения на его основе N,N'-мостиковых «протонных губок», поскольку N-метильные группы ограничивают образование побочных продуктов и способствуют селективному протеканию процесса гетероциклизации. Широкий спектр подобных соединений (22-28) был с хорошими и высокими выходами синтезирован Альдером и сотр. (Схема 8) [11].  Схема 8 Позднее этот ряд был расширен в работе [15], где дополнительно были с высоким выходом, правда, не с использованием дигалогенидов, а по реакции циклоконденсации с соответствующими карбонильными соединениями, синтезированы перимидины 29 и 30.  Вместе с тем, в работе аспиранта кафедры органической химии ЮФУ Д.А. Шевчука в 2010 году было показано, что при взаимодействии диамина 6 с органическими дигалогенидами (в частности, 1,2-дибромэтаном, 1,3-дибромпропаном) вместо ожидаемых димерных «протонных губок» 35 образуются N,N’-мостиковые соединения типа 28, как если бы для реакции был взят не триметил- 6, а диметилдиаминонафталин 4.  Схема 9 Очевидно, что найденное превращение сопровождается моно-деметилированием исходного субстрата 21Me, а движущей силой реакции является энтропийный фактор, всегда благоприятствующий внутримолекулярным процессам, особенно при замыкании ненапряженных циклов. Другие сведения о взаимодействии органических дигалогенидов с диаминонафталинами в литературе отсутствуют, т.е. можно заключить, что это – относительно редкий тип реакций, к которому не так часто прибегают исследователи по причине неоднознозначности их результата. Тем не менее, метод незаменим для получения многих циклических и бициклических молекул с фрагментами пери-диаминонафталина. Можно заметить, что до сих пор в литературе не встречаются молекулы, которые бы содержали, помимо нафталинового ядра остатка «протонной губки», дополнительные нафталиновые системы (исключения см. на Схеме 7) или четырехчленные циклы. Глава 2. Обсуждение результатов 2.1. Взаимодействие 1,3-дибромпропана с 1-амино- и 1,8-диаминонафталинами Прежде чем преступать к изучению модельного соединения 4, необходимо было его синтезировать наиболее оптимальным путем (наименьшее количество этапов синтеза, наивысший выход продукта, простота выполнения эксперимента). Оптимальным методом синтеза бицикла 4, на наш взгляд, стало бы алкилирование 1,8-диаминонафталина относительно доступным 1,3-дибромпропаном. Однако, по причине бифункциональности обоих компонентов (что вызывает определенные синтетические сложности, см. Литобзор, стр. 6) мы стали детально изучать эту реакцию со взаимодействия 1-аминонафталина и 1,3-дибромпропана. В результате поставленных синтезов (см. Экспериментальную часть) нам удалось выделить два продукта: 1,2,3,4-Тетрагидробензо[h]хинолин 32 (11%) и N,N'-нафт-1-ил-1,3-диаминопропан 33 (7%). Вывод о структурах этих веществ мы делали на основе анализа спектров ЯМР 1Н (см. Приложение, рис. 8 и 9).  Выяснилось, что 1,3-дибромпропан взаимодействует с аминогруппами различных молекул 1-аминонафталина, приводя к димерному продукту, но преимущественно замыкается в цикл на o-углероде (С(2)). Этой зависимости подвержен и 1,8-диаминонафталин, который дал в процессе реакции бицикл 4 и N,N'-триметилен-1,2,3,4,9,10,11,12-октагидро-1,12-диазабензо[c]фенантрен 34 (7%) (см. Экспериментальную часть). К сожалению, в процессе реакции 1,3-дибромпропана с 1-аминонафталином азетидинового цикла не образуется, в отличие от зарегистрированного N-фенилазетидина [26]. Так как мы нашли материал по получению N-фенилазетидина [26], было решено провести синтез последнего. И действительно, 1,3-дибромпропан замыкается в четырехчленный цикл на аминогруппе анилина, что не наблюдалось, как отмечалось ранее, относительно 1-аминонафталина. 2.2. Протонирование и основность диамина 4 Для реализации второй цели настоящей работы (оценка out-основности молекулы "протонной губки") мы выбрали, возможно, простейший аналог "протонной губки" с фиксированной конфигурацией атомов азота, способных исключительно к out-протонированию. Нафто[1,8-b,c]диазабицикло[3.3.3]ундекан (4) показался нам лучшей, если не единственной, моделью такого рода. Это соединение впервые было описано Альдером и сотрудниками, которые, однако, не опубликовали данные о его основности и протонных солях [7]. Со структурной точки зрения наиболее значительной особенностью соединения 4 является идеальное уплощение его атомов азота (сумма валентных углов при атомах азота, N = 360o!) [18]. Кроме того, из-за небольшой внутренней полости такие каркасные диамины как 4 обычно не способны инкапсулировать протон внутрь [18]. Проведя несколько пробных экспериментов, мы значительно усовершенствовали методику Альдера (см. Экспериментальную часть), наработали соединение 4 и подтвердили его исходные физико-химические свойства. Далее мы оценили силу соединения 4 как основания методом конкурентного транспротонирования с использованием спектроскопии ЯМР 1H [19]. Для этого был получен тетрафторборат 4·HBF4, который смешивали в эквимольном соотношении с нейтральными "протонными губками" известной основности. Мы нашли, что соль 4·HBF4 полностью депротонируется "протонной губкой" 1, однако при смешивании с 1,8-бис(диметиламино)-4-нитронафталином в CD3CN, т.е. гораздо более слабым основанием с pKa 14.11 в MeCN [20], лишь 77% исходной соли подверглось депротонированию. Эти данные позволяют вычислить для бицикла 4 величину pKa |
| Соединение |  |  |
| pKa1 | 10.29 | 5.77 |
| pKa2 | 1.93 | 1.84 |
Глава 3. Экспериментальная часть
Спектры ЯМР 1Н и 13C измеряли на приборах "Bruker DPX-250" (частота 250 МГц) и Bruker Avance 600 (600 МГц), внутренний стандарт – ТМС. ИК-спектры сняты на спектрометре FT FSM-1202. Хроматографирование проводили на Al2O3 (дополнительно прокаленный в сушильном шкафу при 200 оС) и силикагеле. Контроль над ходом реакций и чистотой полученных соединений осуществляли методом ТСХ на Al2O3 и пластинках Silufol; проявляли в УФ-свете, парах йода или брома. Температуры плавления измерялись в запаянных капиллярах на приборе типа "ПТП" и не подвергались исправлению. Растворители очищали по стандартным методикам.
Потенциометрическое титрование соединений 1 и 4 проводили путем медленной (по 0.1 мл) нейтрализации солянокислых солей (получены прибавлением 2.5 экв. 0.1 М HCl в среде 50% EtOH) раствором 0.1 М NaOH с контролем среды pH-метром. В обоих случаях на кривых потенциометрического титрования наблюдались два достаточно четких перегиба, что позволило определить обе константы pKa1 и pKa2.

Нафто[1,8-bc]-1,5-диазабицикло[3.3.3]ундекан (4). 1,8-Диаминонафталин (1 г, 6.4 ммоль), 1,3-дибромпропан (0.65 мл, 3.2 ммоль) и 1,8-бис(диметиламино)нафталин (5.5 г, 25.6 ммоль) кипятили в смеси ацетонитрила (30 мл) и толуола (30 мл) в течение 4 дней, добавляя каждые новые сутки по 0.65 мл (3.2 ммоль) 1,3-дибромпропана (всего - 2.60 мл, 12.8 ммоль реагента). После этого полученную смесь отфильтровали на воронке с ватой от осадка гидробромида «протонной губки», промывая последний диэтиловым эфиром (15 мл). В фильтрат добавили 30 мл воды и тв. КОН до сильнощелочной среды (рН 13–14). Органический слой отделили в делительной воронке и оставили упариваться досуха. Остаток разделяли с помощью ПТСХ (силикагель/CH2Cl2). Собирали вторую по подвижности желтоватую фракцию, которую, после дополнительно очищали в условиях ПТСХ (силикагель/EtOAc, самая подвижная фракция). Соединение смывали с сорбента ацетоном. Получили 0.42 г (26%) бицикла 4 в виде желто-оранжевых кристаллов с т. пл. 65–67 °C (из ацетона); лит. [11]. ЯМР 1H (250 МГц, CDCl3): 1.30–1.50 (м, 4H, -CH2), 3.28–3.39 и 3.46–3.57 (оба м, 4H и 4H, -CH2), 7.32 (уш. д, 2H, J = 6.8 Гц, H-2,7), 7.38 (т, 2H, J = 7.7 Гц, H-3,6), 7.72 (дд, 2H, J = 7.9, 1.8 Гц, H-4,5). см. Приложение рис. 4.

Тетрафторборат 4·HBF4 получен при добавлении 1 экв. водной 40% HBF4 к раствору соединения 4 в минимальном объеме EtOAc с последующим 5-кратным разбавлением Et2O при комнатной температуре. Образующийся осадок промывали Et2O, высушивали в вакууме и перекристаллизовывали диффузионным методом из смеси Et2O–CH2Cl2 при –20 оС; выход после очистки 61%. Бесцветные пластинки с т.пл. 196–197 oC. ЯМР 1H (600 МГц, CD3CN, 72 oC): 1.60–1.67 и 1.96–2.02 (оба м, 2H и 2H, -CH2), 3.40–3.97 (м, 8H, -CH2), 7.63–7.72 (м, 4H, H-2,3,6,7), 8.03–8.19 (уш. с, 2H, H-4,5), 9.8 (очень широкий сигнал, 1H, NН). ЯМР 1H (600 МГц, CD3CN, 10 oC): 1.49–1.56 и 1.88–1.99 (оба м, 2H и 2H (второй сигнал перекрывается пиком растворителя), -CH2), 3.31–3.93 (м, 8H, -CH2), 7.60–7.70 (м, 4H, H-2,3,6,7), 8.01 (уш. с, 1H, H-5), 8.17 (уш. с, 1H, H-4), 10.04 (уш. с, 1H, NН). ЯМР 1H (600 МГц, CD3CN, –40 oC): 1.54–1.61 и 1.93–1.99 (оба м, 2H и 2H (второй сигнал перекрывается пиком растворителя), -CH2), 3.22–3.28, 3.47–3.60, 3.86–3.92 (все м, 2H, 4H, 2H, -CH2), 7.57–7.63 (м, 3H, H-3,6,7), 7.69 (т, 1H, J = 7.6 Гц, H-2), 8.00 (уш. д, 1H, J = 8.2 Гц, H-5), 8.16 (уш. д, 1H, J = 8.0 Гц, H-4), 10.45 (уш. с, 1H, NН). ЯМР 13C (150 МГц, CD3CN, 50 oC): δ 24.3 (-C), 53.5 и 59.6 (-C), 125.4, 126.4, 129.4, 130.1, 131.9, 133.8 (2C), 134.7, 137.7, 142.8. ЯМР 13C (150 МГц, CD3CN, 10 oC, 1H–13C HSQC): δ 23.9 (-C), 53.0 и 58.9 (-C), 125.2 (C-3), 126.2 (C-7), 129.2 (C-5), 129.8 (C-2), 131.6 (C-9), 133.5 (C-4), 133.7 (C-6), 134.5 (C-1), 137.3 (C-10), 142.5 (C-8). C16H19BF4N2 (326.14): вычислено (%) C 58.92, H 5.87, N 8.59; найдено C 59.03, H 5.74, N 8.62. см. Приложение рис. 6.
Рентгеноструктурный анализ. Кристаллы соли 4·HBF4 получены при –20 oC медленной диффузией Et2O в раствор CH2Cl2. Структура решена прямым методом и уточнена методом наименьших квадратов по F2 в анизотропном (для неводородных атомов) приближении (диффрактометр Bruker APEX II). Координаты водородных атомов рассчитаны геометрически и уточнены в изотропном приближении в модели «наездника» с параметрами Uiso(H) = n·Ueq(Ci) (n = 1.2 для CH и CH2 групп и n = 1.5 для CH3 групп), где U(Ci) – эквивалентные термические параметры атомов, с которыми связаны атомы водорода. Атом водорода H(N) найден разностным Фурье-синтезом и уточнен в изотропном приближении по модели «наездника» с параметром Uiso(H) = 1.2 Ueq(N). Основные кристаллографические данные и экспериментальные детали приведены в Таблице 2. Структура задепонирована в Кембриджский банк структурных данных за номером CCDC 956638.
Таблица 2. Кристаллографические данные и параметры эксперимента для соли 4·HBF4
| Параметр | 4·HBF4 |
| Брутто-формула | C16H19BF4N2 |
| Молекулярный вес | 326.14 |
| T (K) | 100(2) |
| Кристаллическая система | моноклинная |
| Пространственная группа | P21/c |
| a (Å) | 12.8809(6) |
| b (Å) | 8.8823(4) |
| c (Å) | 13.1761(6) |
| (o) | 97.9550(10) |
| V (Å3) | 1493.00(12) |
| Z, Dc (Mг м–3) | 4, 1.451 |
| (мм–1) | 0.120 |
| Отражений всего/независимых | 14795/3948 |
| R(int) | 0.0194 |
| R1, wR2 (все данные) | 0.0417, 0.0975 |
| R фактор (%) | 3.46 |

N,N'-Триметилен-1,2,3,4,9,10,11,12-октагидро-1,12-диазабензо[c]фенан-трен. 1,8-Диаминонафталин (1 г, 6.4 ммоль), 1,3-дибромпропан (0.65 мл, 3.2 ммоль) и карбонат калия (1.7 г, 12.8 ммоль) кипятили в смеси ацетонитрила (30 мл) и толуола (30 мл) в течение 4 дней, добавляя каждые новые сутки по 0.65 мл (3.2 ммоль) 1,3-дибромпропана (всего - 2.60 мл, 12.8 ммоль реагента). Полученную смесь разбавили водой, добавили КОН до сильнощелочной среды и отделили органическую фазу от водной. После удаления растворителей смесь продуктов разделили на ПТСХ (силикагель/CH2Cl2). Собирали первую от старта фракцию. Дополнительно очищали вещество на ПТСХ (Al2O3/CH2Cl2). Выход составил 110 мг (7%). т.пл.=126–129 °C. ЯМР 1H (250 МГц, CDCl3) δ 7.85 – 6.53 (м, 16H), 3.49 – 2.58 (м, 42H), 2.12 – 1.75 (м, 12H), 1.69 – 1.41 (м, 8H), 1.41 – 1.10 (м, 3H). см. Приложение рис. 7.

1,2,3,4-Тетрагидробензо[h]хинолин. К 1-аминонафталину (0.20 г, 1.40 ммоль) добавили 1,3-дибромпропан (0.16 мл, 1.54 ммоль) и "протонную губку" (0.60 г, 2.80 ммоль), в качестве основания, и оставили кипятиться в смеси толуола (10 мл) и ацетонитрила (10 мл) на неделю. Образовавшийся осадок гидробромида "протонной губки" отфильтровали, промыв его диэтиловым эфиром. Фильтрат разбавили водой и защелочили KOH до pH=14 и отделили органическую фазу. После упаривания растворителей смесь продуктов делили на ПТСХ (силикагель/CH2Cl2). Собирали самую подвижную фракцию. Представляет собой желтоватые кристаллы с Тпл=38-40 °C. Выход 11%. ЯМР 1H (250 МГц, CDCl3) δ 7.80 – 7.58 (м, 2H), 7.46 – 7.28 (м, 2H), 7.13 (дд, J = 8.4 Гц, 2H), 3.45 (т, J = 24.6, 19.1 Гц, 3H), 2.90 (т, J = 6.4 Гц, 3H), 2.17 – 1.86 (квин, 3H). см. Приложение рис. 8.

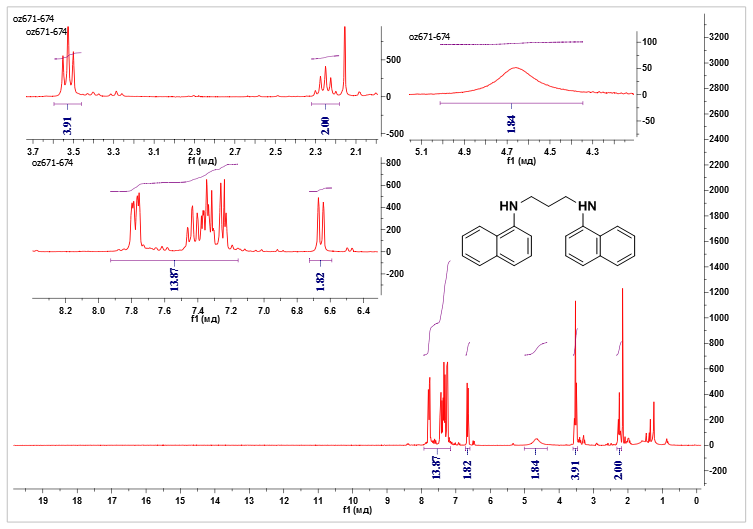
N,N’-нафтил-1,3-диаминопропан. К 1-аминонафталину (0.20 г, 1.40 ммоль) добавили 1,3-дибромпропан (0.16 мл, 1.54 ммоль) и "протонную губку" (0.60 г, 2.80 ммоль), в качестве основания, и оставили кипятиться в смеси толуола (10 мл) и ацетонитрила (10 мл) на неделю. Образовавшийся осадок гидробромида "протонной губки" отфильтровали, промыв его диэтиловым эфиром. Фильтрат разбавили водой и защелочили KOH до pH=14 и отделили органическую фазу. После упаривания растворителей смесь продуктов делили на ПТСХ (силикагель/CH2Cl2). Собирали первую фракцию. Выход 7% (30 мг).ЯМР 1H (250 МГц, CDCl3) δ 7.93 – 7.16 (м, 12H), 6.66 (д, J = 7.4 Гц, 2H), 4.66 (с, 2H), 3.53 (т, J = 6.4 Гц, 4H), 2.25 (квин, J = 6.4 Гц, 2H). см. Приложение рис. 9.

N-Фенилазетидин. Получен путем смешивания анилина (0.50 мл, 5.5 ммоль), 1,3-дибромпропана (0.62 мл, 6.1 ммоль) и K2CO3 (0.76 г, 5.5 ммоль) в 10 мл ДМСО с последующим нагреванием при 70 °С в течение 11 ч. Полученную смесь разбавили водой, добавили твердый NaOH до pH 13–14 и провели экстракцию продуктов с помощью Et2O (3*20 мл). Деление проводили на ПТСХ (SiO2*H2O/CH2Cl2). Собрали самую подвижную фракцию. Продукт представляет собой желтоватое масло; выход очень низкий. ЯМР 1H (250 МГц, CDCl3) δ 7.42 – 7.13 (м, 2H), 6.73 (м, J = 12.9, 7.9 Гц, 3H), 3.63 – 3.36 (т, 4H), 2.16 – 1.95 (квин, 2H). см. Приложение рис. 10.

Диизопропилэтиламин (основание Хюнига, ДИПЭА). Диизопропиламин (5.65 мл, 40 ммоль) был смешан с йодистым этилом (3.60 мл, 44 ммоль) в присутствии ацетонитрила (20 мл). Раствор кипятили в течение 7 ч. Затем полученную смесь разбавили водой и добавили твердый KOH до pH 13–14. Отделив органическую фазу, перегоняли ее над KOH, собирая фракцию с Ткип=127 °C. Выход 5.5 мл (70%). Продукт представляет собой желтоватую прозрачную жидкость с характерным запахом.
Выводы
1. В ходе модификации условий синтеза соединения 4 подобраны мягкие и гомогенные условия, требующие меньшие количества реагентов, чем описано ранее в литературе; выход бициклического продукта составил 26%, что более чем в пять раз превосходит лит. данные.
2. Показано, что взаимодействие 1,8-диаминонафталина с 1,3-дибромпропаном протекает более гладко и селективно, чем в случае 1-аминонафталина, дающего в сопоставимых условиях N,N’-димерные и N,C-циклические продукты. Образование N-арилазетидинов в реакциях 1,3-дибромпропана с ариламинами не выявлено.
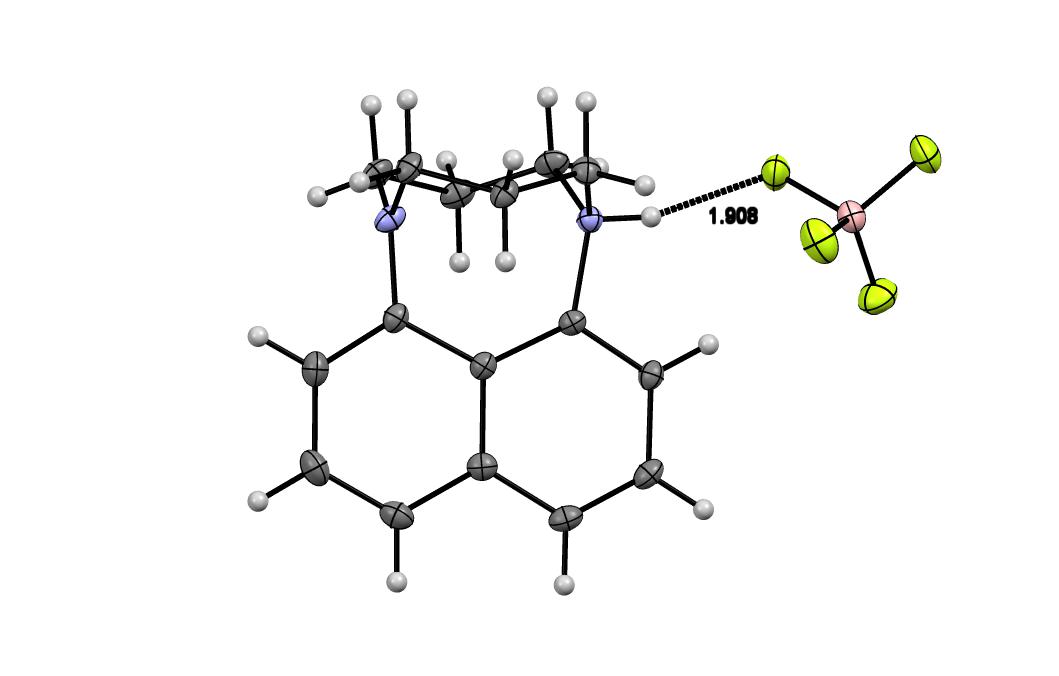
3. С помощью методов ЯМР 1Н и РСА показано, что протонирование соединения 4 протекает исключительно извне с образование out-катиона с коротким контактом между протоном NH и противоионом.
4. Проведено измерение основности нафто[1,8-b,c]диазабицикло[3.3.3]ундекана как наиболее близкого аналога "протонной губки", способного исключительно к out-протонированию. Фактически впервые определена величина pKa органического основания с идеально "плоским" атомом азота. Оцененная out-основность "протонной губки", по крайней мере, на 5.5 порядков ниже, чем in-основность этого вещества, измеряемая непосредственно.
Благодарности
Автор благодарит к.х.н. Г.С. Бородкина (НИИФОХ ЮФУ, г. Ростов-на-Дону) за проведение динамических ЯМР измерений. РС эксперимент проведен к.х.н. З.А. Стариковой (ИНЭОС РАН, г. Москва). Так же автор благодарит доцента кафедры аналитической химии (химфак ЮФУ) к.х.н О.И. Аскалепову за проведенное потенциометрическое титрование и старшего преподавателя кафедры природных и высокомолекулярных соединений (химфак ЮФУ) П.Г. Морозова за рецензирование данной работы.
Список литературных источников
1 Mallinson P.R. Charge density distribution in the "proton sponge" compound 1,8-bis(dimethylamino)naphthalene / P.R. Mallinson, K. Wozniak, C.C. Wilson, K.L. McCormack, D.S. Yufit // J. Am. Chem. Soc. – 1999. – 121. № 19. – P. 4640–4646.
2 Pozharskii, A.F. Proton sponges / A.F., Pozharskii, V. A., Ozeryanskii, в кн. The Chemistry of Anilines, ed. Z. Rappoport, Wiley. – 2007. – Chapter 17. – P. 931–1026.
3 Hibbert F. Temperature-jump study of proton transfer from protonated 1,8-bis(dialkylamino)-naphthalenes to hydroxide ion in water and aqueous dioxane / F. Hibbert // J. Chem. Soc. Perkin Trans. 2. – 1974. – N 15. – 1862–1866.;
4 Kaljurand I. Extension of the self-consistent spectrophotometric basicity scale in acetonitrile to a full span of 28 pKa units: unification of different basicity scales / A. Kütt, L. Sooväli, T. Rodima, V. Mäemets, I. Leito, I. A. Koppel // J. Org. Chem. – 2005. – № 3. – P.1019–1028.
5 Benoit R.L. Basicity of 1,8-bis(dimethylamino)naphthalene and 1,4-diazabicyclo[2.2.2]octane in water and dimethylsulfoxide / R.L Benoit, D. Lefebvre, M. Frechette // Can. J. Chem. – 1987. – 65. – P. 996–1001.
6 Darabantu M. The proton sponge-triethylamine tris(hydrogen fluoride) system as a selective nucleophilic fluorinating reagent for chlorodiazines / M. Darabantu, T. Lequeux, J.-C. Pommelet, N. Ple, A. Turck, L. Toupet // Tetrahedron Lett. – 2000. – 41. – N 35. - P. 6763–6767.
7 A. Szemik-Hojniak, J. M. Zwier, W. J. Buma, R. Bursi, J. H. Van der Waals, J. Am. Chem. Soc.. – 1999. – 120. – P. 4840–4844.
8 Alder, R.W. 1,5-Diazabicyclo[3.3.3]undecane derivative with almost planar bridgehead nitrogens / R.W., Alder, N.C., Goode, T.J., King, I.M., Mellor, B.W., Miller // J. Chem. Soc. Chem. Commun. – 1976. – P. 173–174.
9 Awwal, A. 1,8-Dimorpholinonaphthalene: proton transfer reactions / A., Awwal, R., Burt, T.J., King, I.M., Mellor, B.W. Miller // J.C.S.Chem.Commun. – 1976. – N 5. – P. 173–174.
10 Ayyangar, N. R. 1-Morpholino- and 1,8-dimorpholino-naphthalene: coupling components for new azodisperse / N.R., Ayyangar, A.G., Lugade, P.P. Moghe // Dyes and Pigments. – 1987. – Vol. 8. – P. 63–69.
11 Alder R.W. Preparation of a Range of N,N,N’,N’-Tetrasubstituted 1,8-Diaminonaphthalenes / R. W., Alder, M. R., Bryce, N. C., Goode, N., Miller, J. Owen // J . Chem. Soc., Perkin Trans 1. – 1981.– P. 2840–2847.
12 Hibbert, F. Acid-base properties of highly substituted diaminonaphthalenes. / F., Hibbert, G.R. Simpson // J.C.S., Perkin Trans.2 – 1987. – n.2. – P. 243–246.
13 Mazaleyrat J.-P. Binaphthyl substituted 1,8-bis(dimethylamino)naphthalenes, the first chiral, atropisomeric, proton sponges / J.-P., Mazaleyrat, K. Wright // Tetrahedron Lett. -2008. – v. 49. – P. 4537-4541.
14 Brancatelli, G. Basicity and bulkiness effects of 1,8-diaminonaphthalene, 8-aminoquinoline and their alkylated derivatives on the different efficiencies of η5-C5H5 and η5-C5Me5 ruthenium precatalysts in allylic etherification reactions. / G., Brancatelli, D., Drommi, G., Femino, M., Saporita, G., Bottari, F., Faraone // New J. Chem. – 2010. – v.34. – P. 2853–2860.
15 Ozeryanskii, V. A. peri – Naphthylenediamines. Study of interconversions of 2,3-dihydroperimidines and 1,8-bis(dialkylamino)naphthalenes. Convenient synthesis of 1,2,2,3-tetramethyl-2,3-dihydroperimidine and a monoisopropyl analog of the «proton sponge» / V. A. Ozeryanskii, A. F. Pozharskii, E.A. Filatova, V. I. Sorokin // Russ. Chem. Bull., Int. Ed.– 2001. – Vol. 50. – P. 846–853.
16 Ozeryanskii V.A. N,N,N'-Trialkyl-1,8-diaminonaphthalenes: convenient method of preparation from protonated "proton sponges" and the first X-ray information / V.A. Ozeryanskii, A.F., Pozharskii, M.G., Koroleva, D.A., Shevchuk, O.N., Kazheva, A.N., Chekhlov, G.V., Shilov, O.A., Dyachenko // Tetrahedron – 2005. – Vol. 61. – P. 4221-4232.
17 D. H. Aue, H. M. Webb, M. T. Bowers, J. Am. Chem. Soc. – 1975. – № 97. – P. 4136–4137.
18 R. W. Alder, R. E. Moss, R. B. Sessions, J. Chem. Soc., Chem. Commun. – 1983. – P. 997–998.
19 Staab H.A. Isomeric tetrakis(dimethyl-amino)naphthalenes: synthesis, structure-dependence of basicities, crystal structures, and physical properties / H.A. Staab, A. Kirsch, T. Barth, C. Krieger, F.A. Neugebauer // Eur. J. Org. Chem.. – 2000. – № 8. – P. 1617–1622.
20 Курасов Л.А. Нитрование 1,8-бис(диалкиламино)нафталинов / Л.А. Курасов, А.Ф. Пожарский, В.В. Кузьменко, Н.А. Клюев, А.И. Чернышев, С.С. Горяев, Чикина Л.Л. // Журн. орган. химии. - 1983. – 19. – № 3. – C. 590–597.
21 A. H.-J. Wang, R. J. Missavage, S. R. Byrn, I. C. Paul, J. Am. Chem. Soc. – 1972. – 94. – P. 7100–7104.
22 C. Cox, H. Wack, T. Lectka, Angew. Chem., Int. Ed. Engl. – 1999. – 38.– P. 798–800.
23 Ozeryanskii V.A. Extreme magnetic separation of geminal protons in protonated N,N,N’-trimethyl-1,8-diaminonaphthalene. A puzzle of the fourth methyl group/ V.A. Ozeryanskii, A.F. Pozharskii, A. Filarowski, G.S. Borodkin, // Org. Lett.. – 2013. – 15. – P. 2194–2197.
24 K. Wozniak, T. M. Krygowski, B. Kariuki, W. Jones, E. Grech, J. Mol. Struct.. – 1990. – 240. – P. 111–118.
25 F. Hibbert, Acc. Chem. Res.. – 1984. – № 17. – P. 115–120.
26 Ismailov V.M. Aniline Alkylation with Di- and Tribromopropane/ V.M. Ismailov, I.A. Mamedov, N.N. Yusubov// Russian J.Org. Chem. –2009. –Vol. 45. – No. 8. – P. 1250−1251.
П
 риложение
риложение

Р
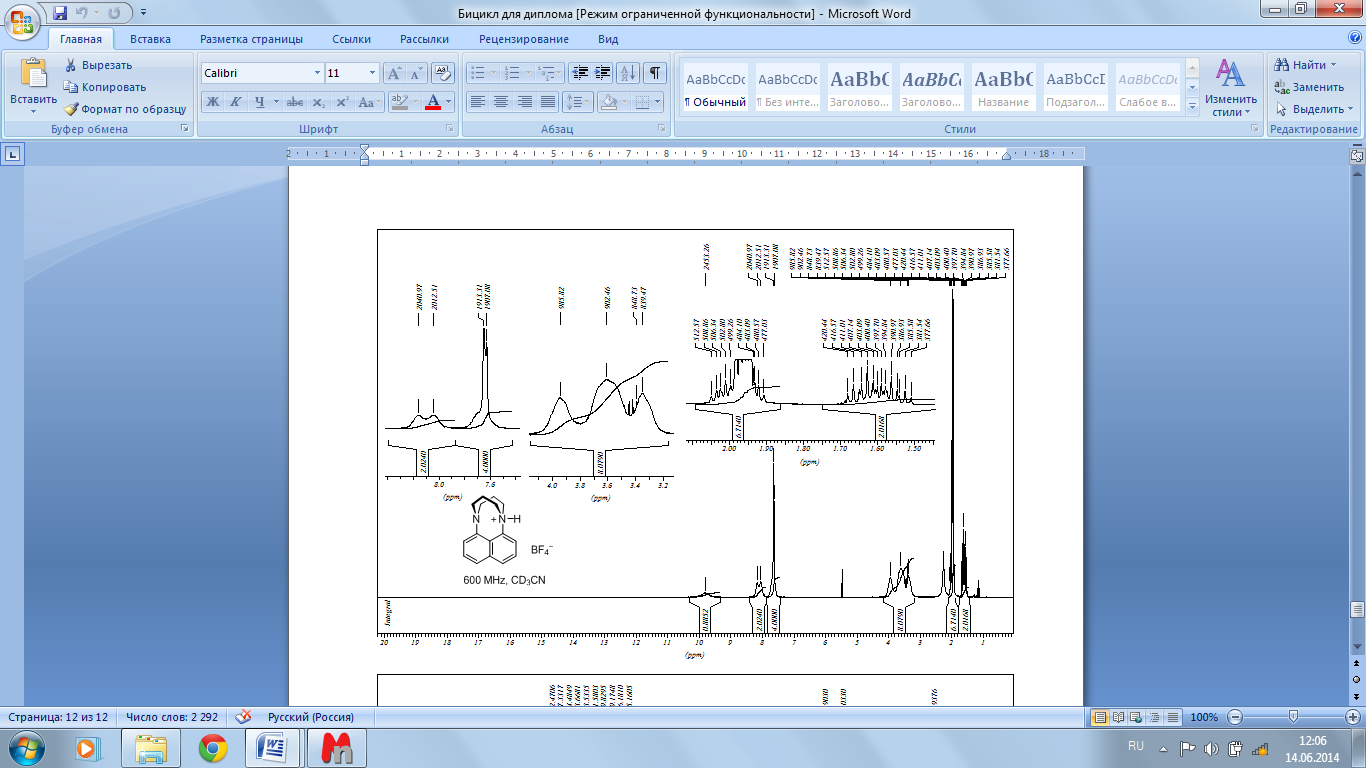 ис. 4. ЯМР 1H (250 МГц, CDCl3) Нафто[1,8-bc]-1,5-диазабицикло[3.3.3]ундекана
ис. 4. ЯМР 1H (250 МГц, CDCl3) Нафто[1,8-bc]-1,5-диазабицикло[3.3.3]ундеканаРис. 5. ЯМР 1H (600 МГц, CD3CN) тетрафтробората нафто[1,8-bc]-1,5-диазабицикло[3.3.3]ундекана
Р
 ис. 6. ЯМР 13С (600 МГц, CD3CN) тетрафтробората нафто[1,8-bc]-1,5-диазабицикло[3.3.3]ундекана
ис. 6. ЯМР 13С (600 МГц, CD3CN) тетрафтробората нафто[1,8-bc]-1,5-диазабицикло[3.3.3]ундеканаР
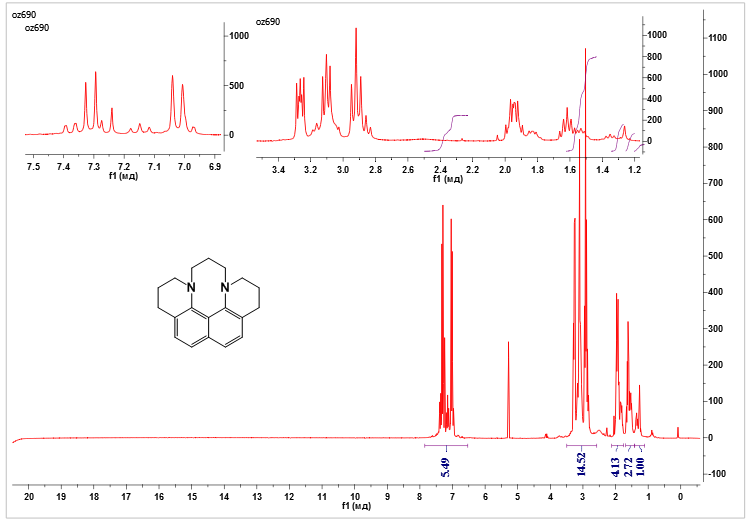 ис. 7. ЯМР 1H (250 МГц, CDCl3) N,N'-триметилен-1,2,3,4,9,10,11,12-октагидро-1,12-диазабензо[c]фенантрена
ис. 7. ЯМР 1H (250 МГц, CDCl3) N,N'-триметилен-1,2,3,4,9,10,11,12-октагидро-1,12-диазабензо[c]фенантренаР
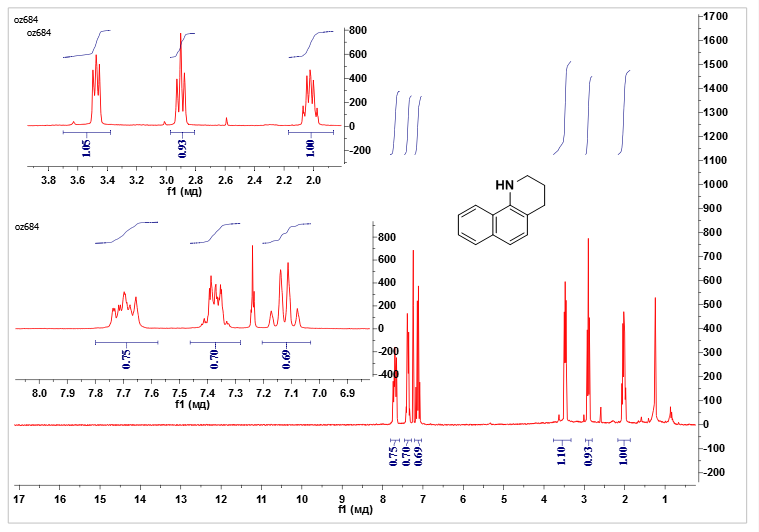
 ис. 8. ЯМР 1H (250 МГц, CDCl3) 1,2,3,4-Тетрагидробензо[h]хинолина
ис. 8. ЯМР 1H (250 МГц, CDCl3) 1,2,3,4-Тетрагидробензо[h]хинолинаРис. 9. ЯМР 1H (250 МГц, CDCl3) N,N’-нафтил-1,3-диаминопропана
Р
 ис. 10. ЯМР 1H (250 МГц, CDCl3) N -фенилазетидина
ис. 10. ЯМР 1H (250 МГц, CDCl3) N -фенилазетидина