экзамен. Экзамен по химии. 1 семестр. Экзамен по химии. 1 семестр. Теория химического строения органических соединений А. М. Бутлерова. Основные положения теории химического строения
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
|
Экзамен по химии. 1 семестр. 1. Теория химического строения органических соединений А.М. Бутлерова. Основные положения теории химического строения. Первое положение: Атомы в молекулах органических веществ соединены между собой в строго определенной последовательности согласно их валентности. Второе положение: Свойства веществ зависят не только от качественного и количественного состава вещества, но и от порядка расположения атомов в молекуле (явление изомерии). Третье положение: Свойства органических веществ зависят не только от состава вещества и порядка соединения атомов, но и от взаимного влияния атомов друг на друга. 2. Классификация органических реакций: реакции замещения, разложения. 1. Реакции замещения – реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов. а) радикальное замещение  неполное замещение неполное замещение полное замещение полное замещениеб) электрофильное замещение  (нитроэтан) (нитроэтан)в) нуклеофильное замещение  (хлорпропан → пропанол) (хлорпропан → пропанол)2. Реакции разложения – реакции образования новых веществ более простого строения. а) полное C 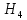 → C + 2 → C + 2 б) неполное 2C 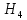 → → + 3 + 3 в) крекинг 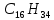 → → 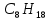 + + 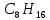 3. Классификация органических реакций: реакции присоединения, отщепления. 3. Реакции присоединения – реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну. а) гидрирование (+  ) )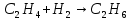  H к наиболее гидрированному OH к наименее гидрированному б) галогенирование (+галогены) 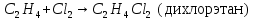 в) гидратация ( 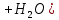 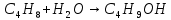  H к наиболее гидрированному Сl к наименее гидрированному г) гидрогалогенирование 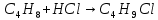 д) полимеризация – соединение многих молекул низкомолекулярного вещества (мономеров) в крупные молекулы (макромолекулы) полимеры. 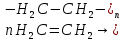 е) окисление по типу присоединения     OH OH H2C=CH–CH3 + [O] + HOH → CH2–CH–CH3 4. Реакции отщепления – реакции, в результате которых из молекулы одного вещества образуются молекулы нескольких новых веществ. а) дегидрирование (-  ) )C3H8 → C3H6 + H2 б) дегидратация ( 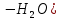 C2H5OH 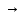 C2H4↑ + H2O C2H4↑ + H2Oв) дегидрогалогенирование C3H7Cl + KOH 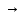 C3H6 + KCl + H2O C3H6 + KCl + H2Oг) дегалогенирование C2H4Cl2 + Zn 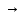 C2H4 + ZnCl2 C2H4 + ZnCl2Нет в вопросах! 5. Реакции поликонденсации – реакции получения полимеров с выделением побочного продукта (H2O, NH3, HCl).       R R NH2 – CH – COOH + NH2–CH–COOH → NH2–CH–CO–NH–CH–COOH + H2O   R R 6. Реакции изомеризации – получение изомеров. 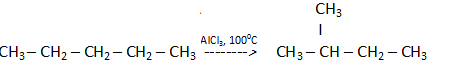 4. Классификация органических соединений по строению. Ациклические: 1) Насыщенные (предельные) - Алканы CnH2n+2 H3C – CH3 (одинарная связь) 2) Ненасыщенные (непредельные) - Алкены CnH2n H2С = СH2 (двойная связь) - Алкины CnH2n-2 HС ≡ СH (тройная связь) - Алкадиены CnH2n H2С = С = СH2 (две двойные связи)   CH2 Циклические:   CH2 CH2 1) Циклоалканы СnH2n (C3H6 - циклопропан) 2) Арены CnH2n-6 (C6H6 - бензол) 3) Гетероциклические 5. Классификация органических соединений по наличию функциональной группы. Кислородсодержащие: - Спирты R – OH - Альдегиды 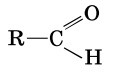 (RCHO) (RCHO)- Кетоны 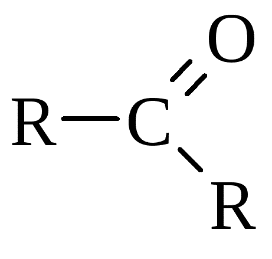 - Карбоновые кислоты 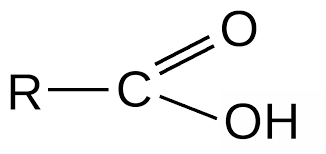 (RCOOH) (RCOOH)- Эфиры: 1. Простые эфиры R – O – R 2. Сложные эфиры 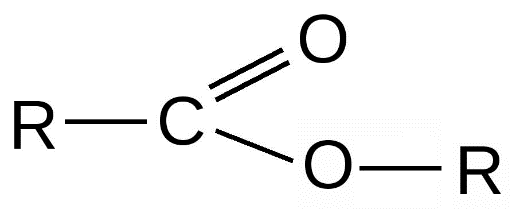 Азотсодержащие: - Амины R – NH2 - Аминокислоты 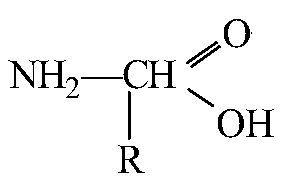 6. Строение атома углерода. Первое валентное состояние атома углерода (sp3–гибридизация). CH4 - метан В процессе sp3-гибридизации происходит смешение одной s- и трёх p-орбиталей. В результате образуются четыре одинаковые гибридные орбитали, имеющие форму неправильного друг друга восьмёрки, расположенные относительно под углом 109°28', при котором достигается их максимальное удаление друг от друга. Таким образом, атом углерода образует одинаковые четыре σ-связи, которые к углам тетраэдра, в котором находится атом углерода. Вsp3-гибридном состоянии находятся все атомы углерода в метане и остальных алканах, в алмазе. 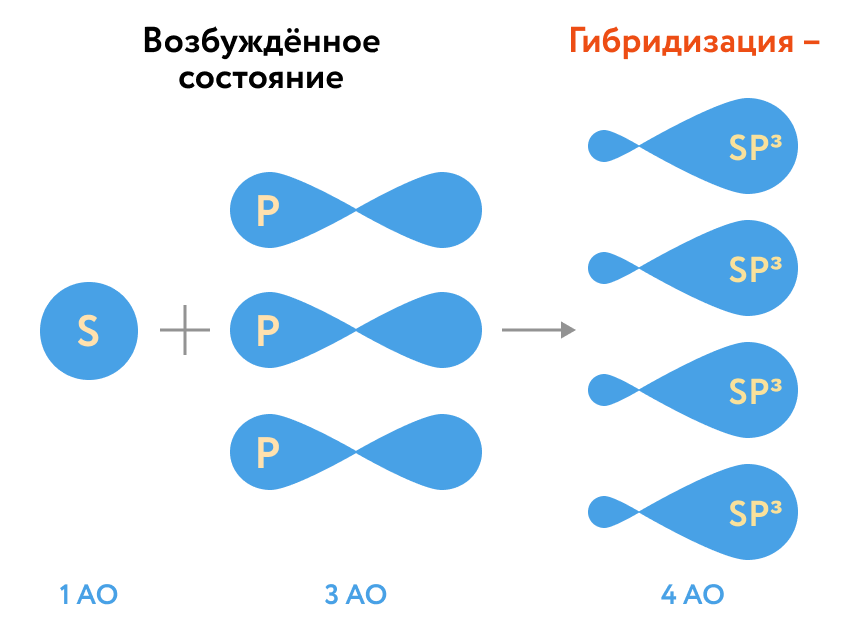 sp3- гибридизация атома углерода в молекуле, если он связан с 4-мя атомами. 7. Строение атома углерода. Второе валентное состояние атома углерода (sp2–гибридизация). С2H4 – этилен В процессе sp2 -гибридизации происходит смешение одной s- и двух p-орбиталей. Образуются три одинаковые гибридные орбитали, расположенные относительно друг друга под углом 120°C, лежат в одной плоскости и перемещении к вершинам треугольника. Атом углерода образует три σ- и одну π-связь, которая перпендикулярна плоскости σ-связь. В sp2–гибридном состоянии находятся атомы углерода в графите, бензоле, атомы углерода, соединённые двойными связями, в алкенах, атом углерода, связанный с карбонильным кислородом. sp2-гибридизация атома углерода при связях с 3-мя атомами. 8. Строение атома углерода. Третье валентное состояние атома углерода (sp–гибридизация). C₂H₂ - ацетилен В процессе sp–гибридизациипроисходит смешение одной s- и одной р-орбитали. Образуются две одинаковые гибридные орбитали, которые расположены относительно друг друга под углом 180°C и лежат на одной линии. Атом образует две σ-связи и две π-связи, расположенные в двух перпендикулярных плоскостях. В sp-гибридном состоянии находятся атомы углерода, соединённые тройной связью в молекулах алкинов, атом углерода в оксиде углерода (IV) и др. sp-гибридизация атома углерода, если он образует связи с 2-мя атомами. 9. Алканы. Определение, изомерия и номенклатура алканов. Алканы – предельные углеводороды (парафины), в молекулах которых атомы углерода связаны между собой одинарной сигма связью с общей формулой CnH2n+2. C6H14 – гексан  10. Алканы. Определение, состав и получение алканов. Получение в промышленности. Выделением из природных источников нефти и газа. Гидрированием алгенов. СН2=CH2+H2 → CH3–CH3 Крекингом нефтепродуктов. C16H 34→ C8H16+C8H18 Гидрированием угля. nC+nH2 → CnH2n+2 Получение в лаборатории. Гидрированием алкенов или алкинов. СН2=CH2+H2 → CH3–CH3 Реакция Вюрца – из галогенпроизводных соединений с натрием. СН3Сl+CH3Cl+2Na → C2H6+2NaCl C2H5Cl+C3H7Cl+2Na → C5H12+2NaCl Сплавлением солей карбоновых кислот со щелочами. CH3COONa+NaOH → CH4+Na2CO3 Гидролиз карбидов (+H2O) Al4C3+12H2O → 3CH4+4Al(OH)3 Реакция восстановления галогенпроизводных соединений. СH3Cl+H2 → CH4+HCl 11. Алканы. Определение, химические свойства алканов. 1) Реакция замещения c разрывом связи С-H CH4 + Cl2 → CH3Cl + HCl СH3Cl+Cl2 → CH2Cl2+HCl 2) Реакция нитрирования (реакция Коновалова) CH4 + HNO3 → CH3NO2 + H2O 3) Реакция сульфирования с высшими алканами (c серной кислотой) C17H36 + H2SO4 → C17H35SO3H + H2O 4) Реакции отщепления а) Реакция дегидрирования C2H6→C2H4+H2 б) Термическое разложение- крекинг C16H34→C8H18+C8H16 в) Пиролиз метана 2CH4→ [1500°] C2H2+3H2 5) Реакция изомеризации 6) Реакции окисления a. Реакция горения CH4+2O2→CO2+H2O 2C2H6+7O2→4CO2+6H2O б. При недостатке кислорода металл образует альдегид. CH4+O2→HCHO+H2O в. Конверсия метана CH4+H2О → CO2+3H2и 12. Алкены. Определение, изомерия и номенклатура алкенов. Алкены (этилены) – вещества, в молекулах которых атомы углерода связаны между собой двойной связью, с общей формулой CnH2n. Гомологический ряд начинается с этена (C2H4). C5H10 - пентен  13. Алкены. Определение, состав и получение алкенов. 1) В лаборатории этилен получают реакцией дегидратации этанола: t, H2SO4 (к) CH3-CH2-OH → CH2=CH2+H2O C2H5OH → C2H4+H2O 2) В промышленности получают реакцией дегидрирования алканов: C2H6 → C2H4+H2 14. Алкены. Определение, химические свойства алкенов. I. Реакции присоединения 1. Гидрирование. CH2=CH-CH3+H-H → CH3-CH2-CH3 C3H6 + H2 → C3H8 2. Галогенирование. CH2=CH-CH3+Br-Br → CH2Br-CHBr-CH3 C3H6 + Br2 → CH3H6Br2 3. Гидрогалогенирование. CH2=CH-CH3+H-Cl → CH3-CHCl-CH3 C3H6 + HCl → C3H7Cl 4. Гидратация. C2H4 + H2O → C2H5OH 5. Полимеризация. nH2С= CH2 → n(– H2C– H2C–) II. Реакции окисления 1. Горение C2H4 + 3O2 → 2CO2 + 2H2O 2. Качественная реакция на непредельные углеводороды – обесцвечивание раствора перманганата калия (KMnO4). CH2=CH2 + [O] + H2O →KMnO4 CH2OH – CH2OH этиленгликоль 15. Алкадиены. Определение, изомерия и номенклатура алкадиенов. Алкадиены – вещества, в молекулах которых атомы углерода связаны между собой двумя двойными связями, с общей формулой СnH2n-2. С5H8 H2C=C=CH-CH2-CH3 пентадиен-1,2 H3C-CH=C=CH-CH3 пентадиен-2,3 H2C=CH-CH2-CH=CH2 пентадиен-1,4 16. Алкадиены. Определение, состав и получение алкадиенов. 7. Алкины. Определение, состав и химические свойства алкинов. Алкины (ацетиленовые) – вещества, в молекулах которых атомы углерода связаны между собой тройной связью, с общей формулой CnH2n-2. I. Реакции присоединения 1. Гидрирование C3H4 + H2 → C3H6 2. Галогенирование C2H2 + Br2 → C2H2Br2 3. Гидратация C2H2 + H2O →  4. Гидрогалогенирование C3H4 + HCl → C3H5Cl 5. Полимеризация 3C2H2 → C6H6 (бензол) II. Реакции окисления 1. Горение 2C2H2 + 5O2 → 4CO2 + 2H2O 8. Арены. Определение, состав и химические свойства аренов. Углеводороды, в молекулах которых содержится бензольное кольцо, называют ароматическими углеводородами (или аренами). R – бензол  Изомерия: 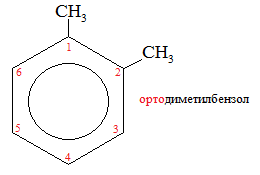 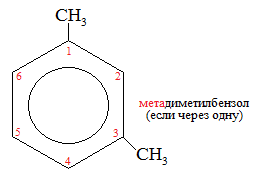 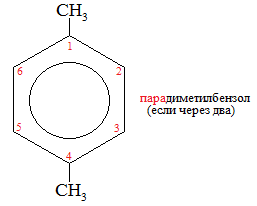 I. Реакции замещения 1. Реакция галогенирования C6H6 + Br2 → FeBr3 C6H5Br + HBr 2. Реакция нитрирования C6H6 + HNO3 →H2SO4 (к), t H2O + C6H5 – NO2 3. Реакция сульфирования C6H6 + H2SO4 →H2SO4 (к), t H2O + C6H5 – SO3H 4. Реакция алкилирования (атом водорода на алкильный радикал) C6H6 + CH3Cl →AlCl3 C6H5CH3 + HCl II. Реакции присоединения 1. Гидрирование 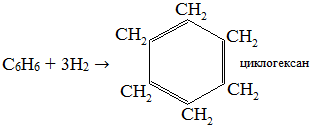 2. Галогенирование 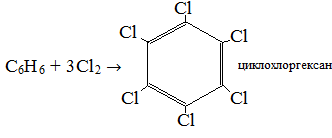 III. Реакции окисления 1. Горение 2C6H6 + 5O2 → 12CO2 + 6H2O 2. 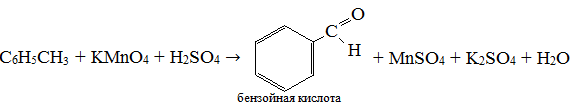 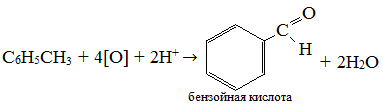 9. Природные источники углеводородов. Природный газ встречается повсеместно. Нефть и попутный газ залегают в недрах Земли между породами. Над нефтью находятся попутные газы. Каменный уголь. Полезное ископаемое, образовалось из отмерших остатков растений. 10. Нефть, нахождение в природе, состав и свойства нефти, переработка нефти. Нефть и попутный газ залегают в недрах Земли между породами. Нефть – маслянистая жидкость темно-бурого цвета, практически нерастворима в воде. Легче воды. В ней 900 различных соединений. Основные – алканы от 6 до 50 атомов С. Необработанная нефть – сырая. Она проходит ректификацию (разделение на отдельные компоненты). Нефть подают в нижнюю часть колонны, нагревают до 340-360. Газообразные углеводороды поднимаются вверх и расслаиваются по тарелкам. Чем выше тарелка, тем ниже темп кипения. 11. Природный и попутный нефтяные газы, каменный уголь. Их практическое использование. Природный газ – эффективное и дешевое топливо для ТЭС, котельных установок, доменных и стекловаренных печей. Фракция попутного газа, содержащая пропан, используется как топливо для двигателей, работающих на сжиженном газе. Сухой газ – топливо и химическое сырье. 12. Спирты и фенолы. Определение, состав и химические свойства спиртов и фенолов. Спирты – органические вещества, состоящие из одной или нескольких гидроксильных групп, соединенных с водородным радикалом. R – OH (_ол)  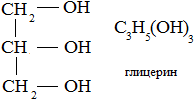 Фенолы – производные ароматических углеводородов, содержащие в молекуле гидроксильную группу, соединенную с бензольным кольцом. 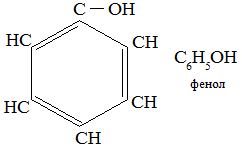 I. Кислотные свойства 1. Спирты взаимодействуют с щелочными и щелочноземельными металлами. 2CH3OH + 2Na → 2CH3ONa + H2 2. Многоатомные спирты и фенол взаимодействуют с щелочами C6H5OH + 2NaOH → C6H5ONa + 2H2O 3. Многоатомные спирты взаимодействуют с нерастворимыми основаниями – качественная реакция на глицерин взаимодействием Cu(OH)2 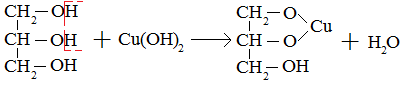 II. Реакции замещения 1. Взаимодействие спиртов с галогенводородными соединениями. C2H5OH + HBr → C2H5Br + H2O 2. Взаимодействие спиртов с карбоновыми кислотами  метиловый эфир уксусной кислоты CH3OH + CH3COOH → CH3COOCH3 + H2O 3. Взаимодействие спиртов и фенола с неорганическими кислотами  III. Реакции дегидратации спиртов 1. C2H5OH → C2H4 + H2O 2. CH3OH + CH3OH → CH3 – O – CH3 + H2O IV. Реакциигорения 1. C2H5OH + 3O2 → 2CO2 + 3H2O V. Качественная реакция на фенол – взаимодействие с FeCl3  13. Альдегиды. Определение, состав и химические свойства альдегидов. Альдегиды – органические вещества, молекулы которых содержат альдегидную группу CHO, общая формула RCHO.   1. Реакция серебряного зеркала – качественная реакция на альдегиды.  2. Реакция с Cu(OH)2  3. Реакция гидрирования с образованием спиртов HCHO + H2 → CH3OH 14. Карбоновые кислоты. Определение, состав и химические свойства карбоновых кислот. Карбоновые кислоты – сложные органические кислородсодержащие вещества, молекулы которых содержат карбоксильную группу COOH, соединенную с углеводородным радикалом. Общая формула RCOOH. HCOOH – метановая (муравьиная) кислота CH3COOH – этановая (уксусная) кислота C2H5COOH – пропановая (пропионовая) кислота 1. Диссоциируют на ионы CH3COOH → CH2COO- + H+ 2. Взаимодействуют с активными металлами 2CH3COOH + 2Na → 2CH3COONa + H2 3. Взаимодействуют с оксидами металлов 2CH3COOH + MgO → (CH3COO)2Mg + H2O 4. Взаимодействуют с основаниями 2CH3COOH + Zn(OH)2 → (CH2COO)Zn + 2H2O 5. Взаимодействуютссолямислабыхкислот 2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O 6. Взаимодействуют со спиртами с образованием сложных эфиров CH3COOH + C2H5OH → CH3COOC2H5 + H2O 7. Реакция галогенирования. CH3COOH + Cl2 → CH2ClCOOH + HCl Сложные эфиры. Определение, состав и химические свойства сложных эфиров. Жиры. Определение, состав и химические свойства жиров. Углеводы. Определение. Классификация, нахождение в природе, получение углеводов. Углеводы – сложные органические вещества с общей формулой Cx(H2O)y Классификация: - Простые (моносахариды) - Сложные (дисахариды и т.д.) Моносахариды. Определение, состав и химические свойства моносахариды. Моносахариды – простые углеводы, которые не способны гидролизоваться с образованием более простых углеводов, с общей формулой CnH2*nOn Крахмал. Состав, нахождение в природе и свойства крахмала. Целлюлоза. Состав, нахождение в природе и свойства целлюлозы. Белки. Определение, состав и строение белков. Белки. Определение, функции и свойства белков. Ферменты и витамины. Метан. Состав и химические свойства метана. CH4 1. Реакция галогенирования CH4 + Cl2 → CH3Cl + HCl 2. Реакция нитрирования (реакция Коновалова) CH4 + HNO3 → CH3NO2 + H2O 3. Пиролиз метана 2CH4→ [1500°] C2H2+3H2 4. Реакция горения CH4+2O2→CO2+H2O 5. При недостатке кислорода металл образует альдегид. CH4+O2→HCHO+H2O 6. Конверсия метана CH4+H2О → CO2+3H2 Этан. Состав и химические свойства этана. C2H6 1. Реакция галогенирования C2H6 + Cl2 → CH5Cl + HCl 2. Реакция нитрирования (реакция Коновалова) C2H6 + HNO3 → CH5NO2 + H2O 3. Реакция гидрирования C2H6→C2H4+H2 4. Реакция горения 2C2H6 + 7O2→ 4CO2+ 6H2O 5. Изомеризация Ацетилен. Состав и химические свойства ацетилена. C2H2 1. Гидрирование C2H2 + H2 → C2H4 2. Галогенирование C2H2 + Br2 → C2H2Br2 3. Гидратация C2H2 + H2O →  4. Гидрогалогенирование C2H2 + HCl → C2H3Cl 5. Горение 2C2H2 + 5О2 → 4СО2 + 2Н2О Бензол. Состав и химические свойства бензола. C6H6 I. Реакции замещения 1. Реакция галогенирования C6H6 + Br2 → FeBr3 C6H5Br + HBr 2. Реакция нитрирования C6H6 + HNO3 →H2SO4 (к), t H2O + C6H5 – NO2 3. Реакция сульфирования C6H6 + H2SO4 →H2SO4 (к), t H2O + C6H5 – SO3H 4. Реакция алкилирования (атом водорода на алкильный радикал) C6H6 + CH3Cl →AlCl3 C6H5CH3 + HCl II. Реакции присоединения 1. Гидрирование  2. Галогенирование  III. Реакции окисления 1. Горение 2C6H6 + 5O2 → 12CO2 + 6H2O 2. Этанол. Состав и химические свойства этанола. C2H5OH 1. Спирты взаимодействуют с щелочными и щелочноземельными металлами. 2C2H5OH + 2Na → 2C2H4ONa + H2 2. Взаимодействие с галогенводородными соединениями. C2H5OH + HBr → C2H5Br + H2O 3. Взаимодействие с карбоновыми кислотами C2H5OH + CH3COOH → CH3COOCH2CH3 + H2O 4. Взаимодействие с неорганическими кислотами C2H5OH + HСl → C2H5Cl + H2O 5. Дегидратация спиртов C2H5OH → C2H4 + H2O 6. Горение C2H5OH + 3O2 → 2CO2 + 3H2O Этаналь. Состав и химические свойства этаналя.  1. Реакция серебряного зеркала CH3CHO + Ag2O → CH3COOH + 2Ag 2. Реакция с Cu(OH) 2  3. Реакция гидрирования с образованием спиртов CH3CHO + H2 → C2H5OH Уксусная кислота. Состав и химические свойства уксусной кислоты. CH3COOH 1. Диссоциирует на ионы CH3COOH → CH2COO- + H+ 2. Взаимодействует с активными металлами 2CH3COOH + 2Na → 2CH3COONa + H2 3. Взаимодействует с оксидами металлов 2CH3COOH + MgO → (CH3COO)2Mg + H2O 4. Взаимодействует с основаниями 2CH3COOH + Zn(OH)2 → (CH2COO)Zn + 2H2O 5. Взаимодействует с солями слабых кислот 2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O 6. Взаимодействует со спиртами с образованием сложных эфиров CH3COOH + C2H5OH → CH3COOC2H5 + H2O 7. Реакция галогенирования. CH3COOH + Cl2 → CH2ClCOOH + HCl Генетическая связь между классами органических соединений.  |
