Билет 11 ОХТ. билет 11. Экзаменационный билет 12 Классификация массообменных процессов. (8 баллов)
 Скачать 129.99 Kb. Скачать 129.99 Kb.
|
|
Экзаменационный билет № 12 Классификация массообменных процессов. (8 баллов). Технологические процессы, скорость протекания которых определяется скоростью переноса вещества (массы) из одной фазы в другую, называют массообменными, а аппараты для проведения этих процессов – массообменными аппаратами. 1.Абсорбция- поглощение газового компонента из смеси газов жидким поглотителем, обратный процесс называется десорбция. 2.Экстракция- разделение гомогенных жидких смесей другой жидкостью, в которой одна из смесей растворяется, а остальные не смешиваются (не реагируют). 3.Перегонка и ректификация- это разделение гомогенной жидкой смеси путем перевода пар-жидкость. 4.Адсорбция-поглощение компонента газа, пара или жидкости твердым поглотителем, то есть переход распределяемого компонента из газовой или жидкой фазы в твердую. Обратный процесс-десорбция. Если процесс адсорбции происходит с ионным обменом то он называется ионосорбция . Если процесс адсорбции происходит с химической реакцией то он называется хемосорбция 5.Кристаллизация- выделение твердой фазы из растворов или расплавов. Обратный процесс- растворение, расплавление или экстракция. 6.Сушка- процесс удаление влаги из твердого материала путем ее испарения при повышенной температуре, обратный процесс- увлажнение. Распределяемое вещество внутри каждой фазы переносится путем диффузии, поэтому массообменные процессы часто называют диффузионными. Из теории переноса следует, что количество вещества, диффундирующее в пределах фазы прямо пропорционально поверхности раздела фаз и движущей силе переноса. Движущей силой массообменных процессов является разность химических потенциалов, поскольку распределяемый компонент переносится от точки с большей концентрацией к точке с меньшей концентрацией; в газовой фазе может быть выражена через парциальные давления, либо для всех случаев- разность концентраций. Любой массообменный процесс стремится к равновесию- когда движущая сила становится равной нулю. В массообмене принимают участие минимум две фазы и распределяемый компонент, который переносится из фазы в фазу. Скорость химико-технологических процессов. Общие кинетические закономерности процессов химической технологии. (8 баллов). Цель любого химико-технологического процесса состоит в том, чтобы получить целевой продукт из имеющегося сырья с возможно более низкой себестоимостью. Для этого необходимо обеспечить минимальные расходные коэффициенты сырья, материалов, электроэнергии, воды, топлива. Для снижения расходных коэффициентов сырья технологический процесс необходимо вести так, чтобы степень превращения, выход целевого продукта и селективность (для сложных реакций) были возможно более высокими и достигались в возможно более короткое время, т.е. скорость процесса должна быть возможно более высокой. Это объясняется тем, что скорость характеризует интенсивность процесса, а интенсивность является одним из основных показателей, определяющих экономичность химического производства. Поэтому окончательный выбор условий можно сделать только после изучения кинетики процесса, которая изучает вопросы скорости химических превращений. Учитывая кинетику процесса, можно выбрать такие условия, при которых реакция будет протекать не только с высоким выходом продукта, но и с большой скоростью. Скорость химической реакции определяется как скорость изменения числа молей произвольно выбранного реагента в реакционной системе и определяется как: = В неоднородных системах, когда реакция проходит на границе раздела фаз, например жидкость - твердое тело скорость реакции часто относят к единице площади межфазной поверхности: = Для реакции в газовой фазе в присутствии твердого катализатора удобно выражать скорость реакции в расчете на единицу массы твёрдой фазы: = В связи с уменьшением числа молей исходного вещества в результате реакции производная имеет отрицательное значение. Поэтому в правой части выражений ставят знак « - » необходимый, для того чтобы скорость реакции имела положительную величину. Кинетические закономерности основных процессов химической технологии могут быть сформулированы в виде общего закона: скорость процесса прямо пропорциональна движущей силе и обратна пропорциональна сопротивлению. Назвав величину, обратную сопротивлению, коэффициентом скорости, основные кинетические уравнения выглядят следующим образом: для гидромеханических (1) - 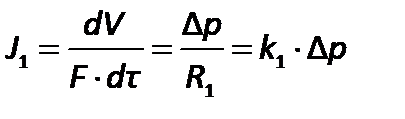 , ,тепловых (2) - 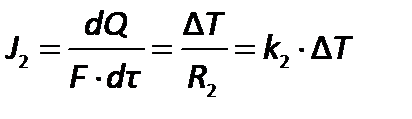 , ,массообменных процессов (3) - 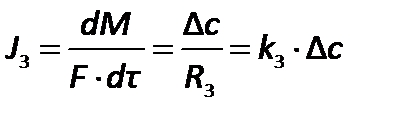 где k1, k2, k3 – коэффициенты скорости процессов; F – площадь сечения аппарата (1), поверхность теплообмена (2), поверхность контакта фаз (3); V – объем реактора; Q – количество переданного тепла; М – количество вещества, перенесенного из одной фазы в другую; p, T, c –движущие силы процессов: гидромеханического – разность давлений, теплового – разность температур, массообменного – разность концентраций, соответственно; Коэффициенты скорости зависят главным образом от скорости движения потоков материалов, поэтому вывод всех химических закономерностей основывается на законах движения материальных потоков – на гидродинамике. Блок-схема процесса синтеза аммиака (8 баллов). Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн тонн. У аммиака большой спектр применения. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности и медицине. Жидкий аммиак используют в качестве растворителя, холодильного агента. N2 (г.) + 3H2 (г.) = 2NH3 (г.) Реакция синтеза аммиака обратимая, экзотермическая, гомогенная. Реакция протекает с уменьшением объема. Максимального выхода аммиака можно достичь, проводя процесс при высоком давлении и низких температурах, с циркуляцией процесса (отвод полученного аммиака) Синтез аммиака протекает с заметной скоростью только в присутствии катализатора, причем катализаторами данной реакции служат твердые вещества. Современный процесс производства аммиака Современный процесс получения аммиака основан на его синтезе из азота и водорода при температурах 380 - 450 0C и давлении 250 атм с использованием железного катализатора: N2 (г.) + 3H2 (г.) = 2NH3 (г.) Азот получают из воздуха. Водород получают восстановлением воды (пара) с помощью метана из природного газа. 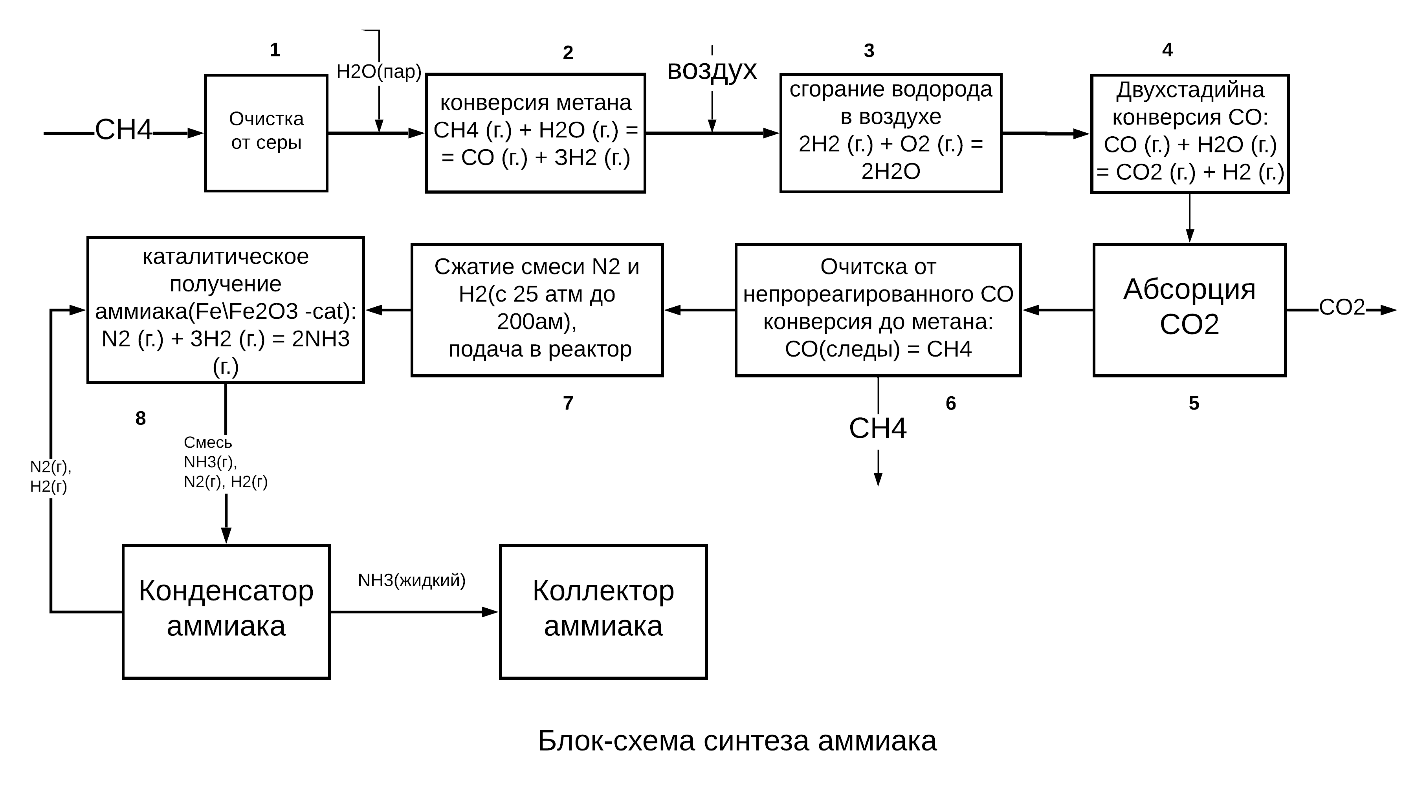 1-я стадия. Удаление серы из природного газа. Это необходимо, поскольку сера представляет собой каталитический яд (см. разд. 9.2). 2-я стадия. Получение водорода восстановлением пара при 750 0C и давлении 30 атм с помощью никелевого катализатора: CH4 (г.) + H2O (г.) = СО (г.) + ЗН2 (г.) 3-я стадия. Впуск воздуха и сгорание части водорода в кислороде вводимого воздуха: 2H2 (г.) + O2 (г.) = 2H2O (г.) В результате получается смесь водяного пара, моноксида углерода и азота. Водяной пар восстанавливается с образованием водорода, как на 2-й стадии. 4-я стадия. Окисление моноксида углерода, образующегося на стадиях 2 и 3, до диоксида углерода по следующей реакции «сдвига»: СО (г.) + H2O (г.) = CO2 (г.) + H2 (г.) ***Этот процесс проводится в двух «реакторах сдвига». В первом из них используется катализатор из оксида железа и процесс проводится при температуре порядка 400 0C Во втором используется медный катализатор и процесс проводится при температуре 220°С. 5-я стадия. Абсорция СО2. ***Вымывание диоксида углерода из газовой смеси при помощи буферного щелочного раствора карбоната калия или раствора какого-либо амина, например этаноламина NH2CH2CH2OH. Диоксид углерода в конце концов сжижают и используют для производства мочевины, либо выпускают в атмосферу. 6-я стадия. После 4-й стадии в газовой смеси остается еще около 0,3% моноксида углерода. Поскольку он может отравлять железный катализатор во время синтеза аммиака (на 8-й стадии), моноксид углерода удаляют путем конверсии водородом в метан на никелевом катализаторе при температуре 325°С. 7-я стадия. Газовую смесь, которая теперь содержит приблизительно 74% водорода и 25% азота, подвергают сжатию; при этом ее давление возрастает от 25-30 атм до 200 атм. Поскольку это приводит к повышению температуры смеси, ее сразу же после сжатия охлаждают. 8-я стадия. Газ из компрессора поступает теперь в «цикл синтеза аммиака». Схема, приведенная на рис. 7.2, дает упрощенное представление об этой стадии. Сначала газовая смесь попадает в каталитический конвертер, в котором используется железный катализатор и поддерживается температура 380-450°С. Газовая смесь, выходящая из этого конвертера, содержит не более 15% аммиака. Затем аммиак сжижают и направляют в приемный бункер, а непрореагировавшие газы возвращают в конвертер. Химизм процесса производства азотной кислоты. (8 баллов). Сырьем для получения азотной кислоты служат технически-очищенные аммиак, воздух и вода. Процесс производства азотной кислоты состоит из нескольких последовательных стадий: Каталитическая конверсия аммиака с целью получения оксида азота(II): 4NH3 + 5О2 → 4NO + 6Н2О; 2) окисления оксида азота(II) до диоксида азота: 2NO + О2 → 2NO2; 3) Конечным этапом является поглощение диоксида азота водой в избытке кислорода: 4NO2 + О2 + 2Н2О → 4HNO3; NH3 + 2О2 → HNO3 + Н2О. Все реакции протекают с выделением тепла, т.е. являются экзотермическими. Две последние реакции обратимы, поэтому итоговая концентрация чистой азотной кислоты невысока(45-58%). Для повышения концентрации в реакции оксида азота (IV) с водой смещают равновесие, увеличивая давление. Также разбавленную азотную кислоту могут смешивать с серной кислотой и нагревать. Азотная кислота испаряется и конденсируется. При обогащении 6 т руды, содержащей 2% цинка, получено 350 кг концентрата, содержащего 25% цинка. Определить выход концентрата, степень извлечения, степень концентрации. (8 баллов). Решение: Выход концентрата = (350/6000) *100% = 5,8% Степень извлечения = ((350*0,25) / (6000*0,02)) *100% = 72,9% Степень концентрации = 25% / 2% = 12,5 раз Ответ: Выход концентрата – 5,8%, степень извлечения цинка – 72,9%, степень концентрации – 12,5 раз. |
