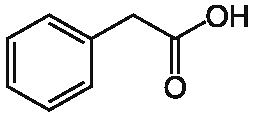
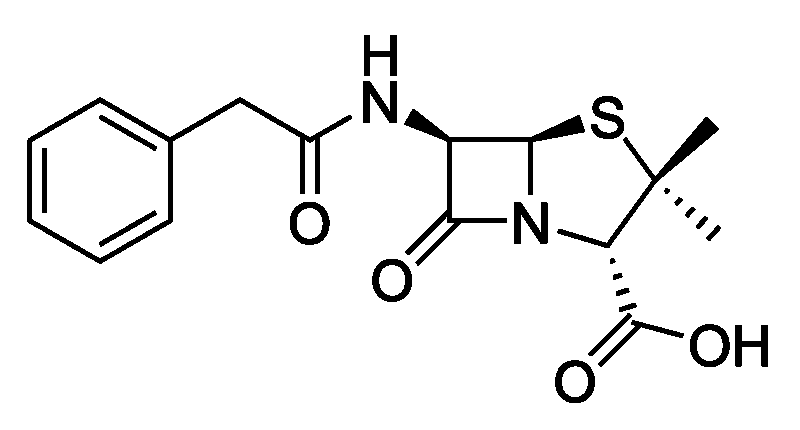
билет 14. Экзаменационный билет 14 в кал поступило несколько серий лекарственного вещества следующей структуры При оценке качества лекарственного вещества в образцах одной серии показатели Описание
 Скачать 247.5 Kb. Скачать 247.5 Kb.
|
|
Экзаменационный билет №14 1. В КАЛ поступило несколько серий лекарственного вещества следующей структуры: 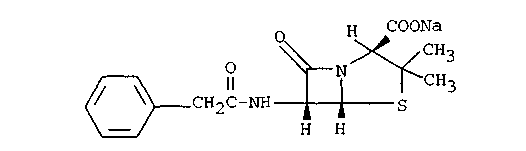 При оценке качества лекарственного вещества в образцах одной серии показатели «Описание» и «Растворимость» не отвечали требованиям НД - порошок был отсыревшим и трудно растворялся в воде. Дайте обоснование причинам изменения его качества по данным показателям в соответствии со свойствами. Предложите испытания для характеристики качества. Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и их использование для оценки качества. В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций. Ответ Бензилпенициллина натриевая соль (Benzyllpenicillinum natrium)/ Физ. Свойства.: белый, мелкокрист порошок, горький, гигроскопичный. Разрушают кислоты, щелочи, нагревание. Очень легко р-рим в воде, р-рим в этиловом и метиловом спирте. Функц. группы: β-лактамное и тиазолидиновое кольца, карбоксильная, карбамидная группы Подлинность. ИК-спектр, УФ-спектр (два мах.: 257, 263 нм.) Чистота. Продукты разрушения дают на УФ-спектре мах поглащения при 280 нм. Оптическая плотность 0,18% раствора при 280 нм должна составлять не более 0,18. Качественные реакции: 1. Щелочной гидролиз. 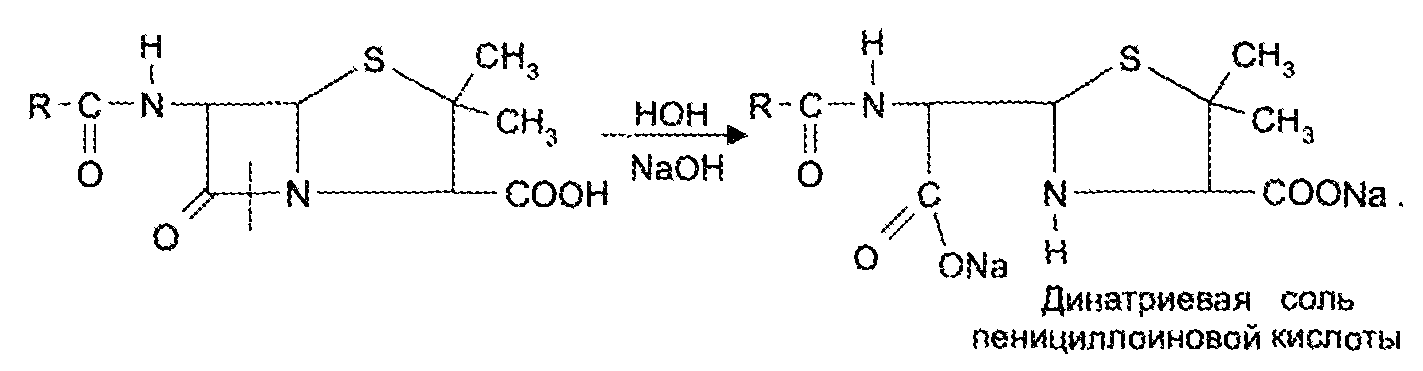 2. Взаимодействие с щелочным раствором гидроксиламина. +FeCl3 => фиолет. цвет р-ра +Сu(NO3)2 => зеленый осадок 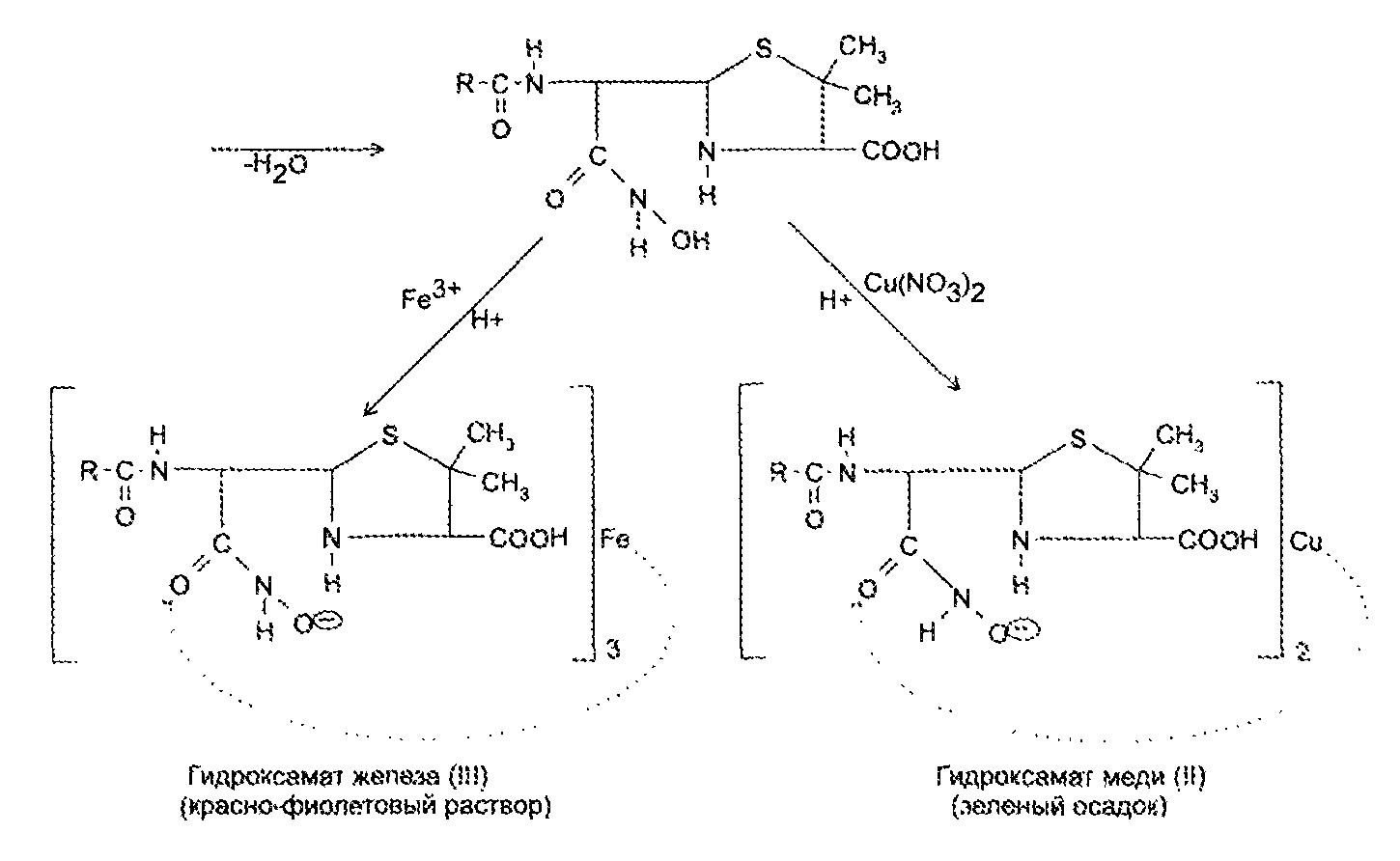 3. Кислотный гидролиз. 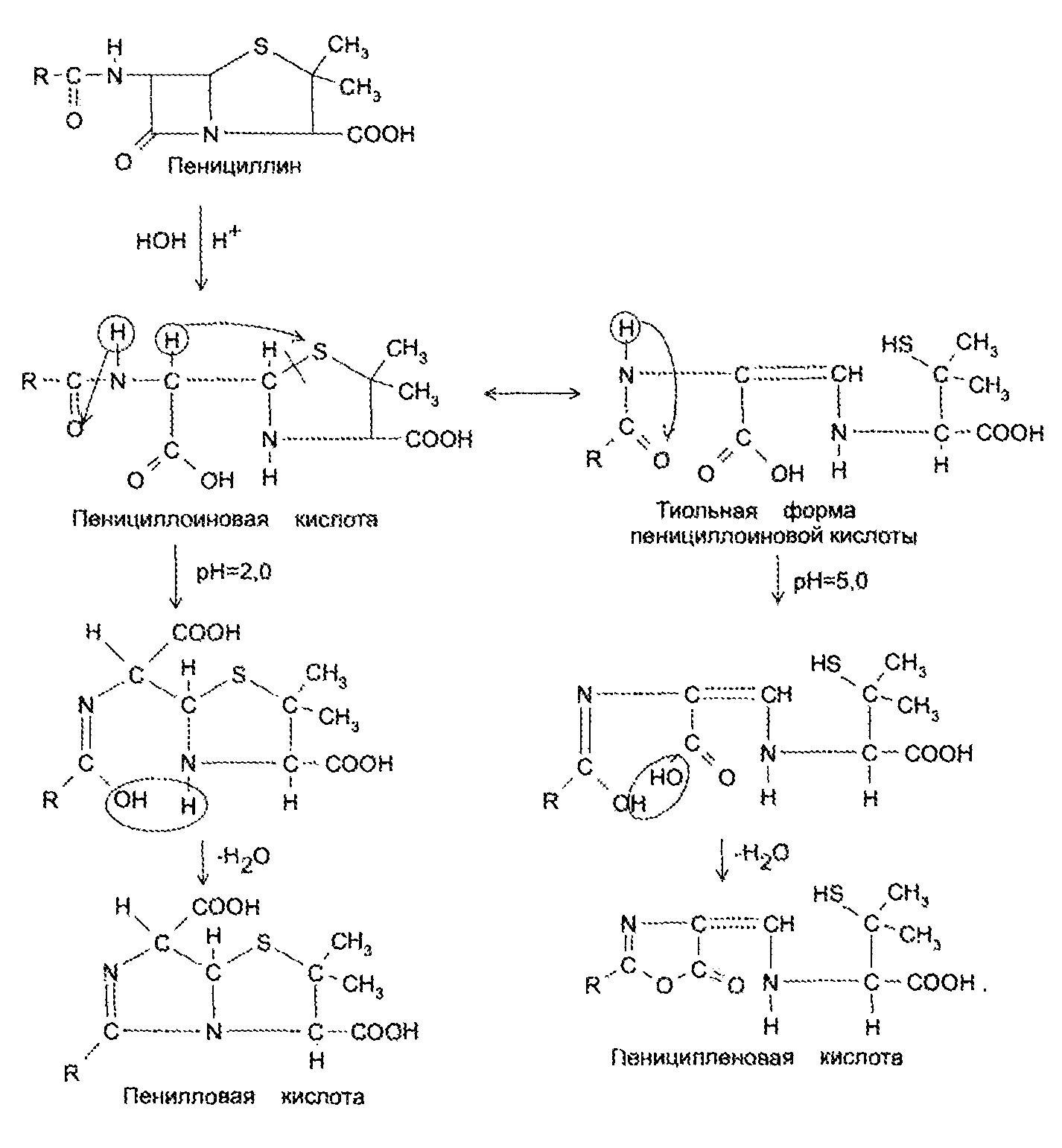 Избыток НCl растворяет осадок пенилловой кислоты: 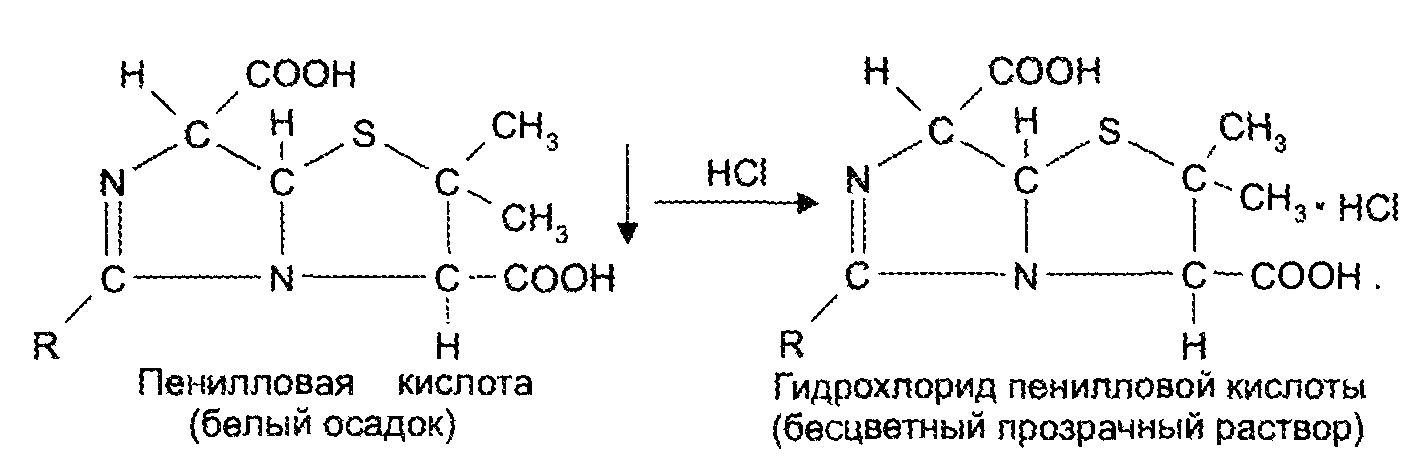 Реакция с бензиллпенициллина с хромотроповой кислотой дает продукты реакции желтого цвета. Количественное определение
 Содержание определяют по формуле V – разность в объемах 0,01 н раствором между опытным и контрольным титрованием Э – величина эквивалента 1 мл 0,01 м раствора иода в граммах стандартного образца натриевой соли бензилпенициллина А –навеска препарата 2. При производстве пенициллина в начале ферментации было добавлено в питательную среду определенное количество фенилуксусной кислоты, что привело к снижению выхода целевого продукта. • Какая ошибка была допущена в данном процессе? Ответ Пенициллины – группа антибиотиков, продуцируемых грибом Penicillium. Пенициллины – исторически значимые антибиотики, так как с их помощью удалось излечить серьезные инфекции (сифилис, инфекции, вызываемые стафилококками и стрептококками). По химическому строению пенициллины представляют собой –лактамы. Механизм действия пенициллинов заключается в ингибировании формирования пептидогликанов клеточной стенки бактерии.
Для промышленного производства пенициллина используют культуру Penicilliumchrysogenum и среду, содержащую кукурузный экcтракт, гидрол, лактозу и минеральные соли. Вместо кукурузного экстракта может быть применена арахисовая мука, жмыхи, мука из хлопковых семян и другие источники. Возможность широкого использования продуктов растительного происхождения обусловлена тем, что у Penicillium chysogenum имеются сильные протеолитические ферменты. В качестве углеводов часто используют сахарозу или смесь лактозы с глюкозой в соотношении 1:1. Глюкоза может снижать биосинтез антибиотика; на средах, содержащих лактозу или сахарозу (в условиях депрессии), биосинтез антибиотика идёт активнее. Важную роль в процессе биосинтеза пенициллина играет сера, которая содержится в структуре антибиотика. В качестве источников серы используются натрия сульфат и натрия тиосульфат. Избыток ионов меди не влияет на рост гриба, но подавляет биосинтез пенициллина. Эффект торможения биосинтеза снимается добавлением в среду ионов железа. Р. chrysogenum в качестве источника фосфора может использовать не только фосфаты, но и фитаты (соли инозитфосфорных кислот): этот продуцент содержит фермент, разрушающий фитин с освобождением неорганического фосфора. Температура в период первой фазы должны быть 30 °С, во вторую фазу 20 °С, рН в период роста гриба - ниже 7,0, потребление углеводов должно быть медленным, что достигается использованием лактозы, либо дробным внесением глюкозы. Синтез того или иного пенициллина зависит от наличия специфичного вещества в среде, иначе говоря, предшественника, который микроорганизм включает в молекулу антибиотика без предварительного расщепления. Следует отметить, что предшественники биосинтеза пенициллина (фенилуксусная кислота, фенилацетамид, феноксиуксусная кислота) при определённых концентрациях и рН среды оказывают токсическое влияние на продуцента. Фенилуксусная кислота наименее токсична. Добавление ее в среду в концентрации выше 500 мкг/мл угнетает рост мицелия, особенно в первые 24 ч его развития. Фенилуксусная кислота добавляется в концентрации от 100 до 500 мкг/мл через 24 ч развития Р. Chrysogenum. При таких условиях обеспечивается наибольший выход бензилпенициллина, который через 72 ч развития может достигать 500-1000 мкг/мл. При развитии гриба без внесения предшественника образуется около 45% бензилпенициллина (пенициллин G) и около 53% пенициллина К (радикал - н-гептилпенициллин). При добавлении к среде фенилуксусной кислоты (С6Н5СН2СООН) меняется соотношение образующихся компонентов в сторону резкого увеличения бензилпенициллина, количество которого в зависимости от возраста достигает 75-99% от смеси пенициллинов. В процессе культивирования Р. chrysogenum в среде, не содержащей фенилуксусной кислоты, в ней накапливаются серосодержащие соединения не -лактамного характера, близкие к цистеину и метионину. Добавление в cреду фенилуксусной кислоты способствует более интенсивному метаболизму серосодержащих компонентов в соединения -лактамного характера. Таким образом, фенилуксусная кислота используется как предшественник бензилпенициллина. Но добавление ее в начале ферментации способствует замедлению роста мицелия. 3. В условиях промышленного производства с натриевой солью данного соединения получают препараты для инъекций. Объясните принципы выбора растворителя, используемого для производства инъекционных лекарственных форм, содержащих лекарственное вещество с указанной формулой? Какие требования предъявляют к растворителю? Укажите особенности способов получения данного растворителя в промышленных условиях? Объясните принципы работы оборудования. Ответ Натриевая соль указанного препарата является антибиотиком - натриевая соль бензилпенициллина. Выбор растворителя зависит от физико-химических свойств антибиотиков. Антибиотики это специфические продукты жизнедеятельности микроорганизмов, избирательно задерживающие их рост или полностью подавляющие развитие. Антибактериальная активность антибиотиков выражается в ЕД, а для изготовления лек. форм необходимо знать массу. Н-р: 1 млн ЕД бензилпенициллина натриевой соли соответствует по массе 0,625 1 млн ЕД ампициллина натриевой соли соответствует по массе 0,58 1 млн ЕД эритромицина натриевой соли соответствует по массе 1,11 Основными физико-химическими свойствами антибиотиков являются: Недостаточная растворимость в воде, что затрудняет получение инъекционных растворов: Недостаточная стабильность водных растворов, в водной среде они подвергаются гидролизу и др. Большинство антибиотиков теряют свою активность от взаимодействия с веществами, поэтому применение стабилизаторов не дает нужного эффекта. Изменение активности в зависимости от рН среды. Например, для бензилпенициллина величина рН желудочного сока уже разрушает его, поэтому пероральное применение невозможно. Плохая совместимость антибиотиков с лекарственными и вспомогательными веществами. Термолабильность большинства антибиотиков делает невозможной тепловую стерилизацию. Для растворов антибиотиком можно применять только стерилизующую фильтрацию через мембранный фильтр. Исходя из свойств раствор бензилпенициллин натриевой соли следует готовить в асептических условиях на воде для инъекций без термической стерилизации. Требования к воде для инъекций: согласно ФС-42-2620-97 вода для инъекций должна удовлетворять всем требованиям, предъявляемым к воде очищенной (ФС-42-2619-97), то есть стерильность, рН 5,0-6,8, не должно быть восстанавливающих веществ, угольного ангидрида, нитритов, нитратов, хлоридов, сульфатов, кальция и тяжелых металлов. Аммиак и сухой остаток-предел установленных норм. Кроме того, вода для инъекций должна быть апирогенна. В промышленных условиях вода для инъекций получается апирогенная высокого качества. Термокомпрессионный аквадистиллятор. В этом аппарате происходит поверхностное парообразование в тонком слое на стенках трубок. Унос капельной фазы предотвращается большой высотой парового пространства. Однако, в виду сложности устройства аппарат сложен в эксплуатации. Дистиллятор Финн-Аква. В этом аппарате получается высококачественная вода для инъекций за счет питательной сепарации и поверхностного парообразования. Этот аппарат более технически совершенен и производителен по сравнению с термокомпрессионным аквадистиллятором. В нем рационально расходуется энергия вторичного пара. Получение воды методом обратного осмоса. Обратный осмос- это переход растворителя (воды) из раствора через полупроницаемую мембрану под действием внешнего давления. Для обратного осмоса применяют мембраны двух типов: пористы е и непористые. Пористые мембраны адсорбируют молекулы воды своей поверхностью. При этом образуется сорбционный слой толщиной в несколько десятков ангстрем. Непористые мембраны образуются молекулами воды на поверхности контакта водородные связи. Под действием избыточного давления эти связи разрываются, молекулы воды диффундируют противоположную сторону мембраны внутрь мембранного слоя и на их место проникают следующие. Через такую мембрану соли и почти все химические соединения не проникают. Метод дистилляции имеет преимущество: высокая степень очистки, надежность, возможность получения горячей воды, возможность обработки аппарата паром не лишен недостатков: высокая стойкость, неэкономичность (за счет большого расхода энергии и воды). Метод обратного осмоса имеет преимущество: экономичность. Недостатки: возможность контаминации, необходимость частой замены мембран (2-4 раза в год). 4. В условиях аптеки изготавливают капли для носа данного соединении состава: Rp.: Benzylpenicillini- natrii 100 000 ED Solutionis Ephedrini hydrochloridi 2% - 10 ml M.D.S: по З капли в нос 4 раза в день. Примечание: изотонический эквивалент натриевой соли указанного соединения по натрия хлориду - 0,15; Эфедрина гидрохлорида - 0,28. Впишите в состав прописи латинское название соединения. Предложите оптимальную технологию изготовления капель для носа по этой прописи. Какие условия должны быть обеспечены? Каковы требования к микробиологической чистоте препарата? Что можно сказать об осмотической активности этого раствора? Какое количество по массе указанного соединения взвесит фармацевт при изготовлении раствора? Учитывая свойства выписанных ингредиентов в прописи, какой вывод можно сделать о стабильности данного раствора? Ответ Выписана сложная жидкая лекарственная форма - капли. Форма бланка 148. Рецепт в аптеки не хранится. Эфедрин г/хлорид - вещество сп.Б на ПКУ. Лечебные дозы не проверяются; бензилпеницилин натривая соль - антибиотик, следует сделать пересчет 1 млн ЕД -0,625; 100 тыс. ЕД - 0,06 Готовить следует в асептических условиях, т.к. антибиотик теряет свою активность от окружающих микробов, нерационально совмещать антибиотики, в частности бензилпенициллин -натриевую соль с солями алкалоидов, т.к. активность антибиотиков теряется в первые 4-6 часов до 40% Предложение: приготовить 2 лекарственной формы: раствор бензилпенициллин- натриевой соли, например, 100 ООО ЕД – 10 мл и раствор эфедрина г/хл 2% 10мл, и использовать поочередно через интервал времени. Применять свежеприготовленные растворы. Стерилизовать раствор антибиотиков нельзя, он термолабилен. Воду используют очищенную стерильную. Срок годности 1 сутки. Флакон оранжевого стекла, т.к. вещество светочувствительное. Согласно приказу № 214 капли в нос должны быть изотоничны. Расчет изотоничности по натрию хлориду: Количество бензилпенициллина очень малое по массе, на изоосмолярность не влияет. Эфедрин г/хл Кизот = 0,28 1,0 эф г/хл =0,28 NaCl 0,2-х Рабочая пропись №1 V=10мл Воды очищенной стерильной 10 мл Натрия хлорида 0,09 Бензилпенициллина 0,06 V=10мл 1.Готовить в асептических условиях. Подготовить стерильный флакон объемом 15мл с пробкой. В стерильный флакон отмерить воды очищенной 10мл, часть (5 мл) поместить в стерильную подставку. На ручных весах 1,0 отвесить 0,06 бензилпенициллина и 0,09 натрия хлорида растворить в подставке в 5 мл воды, после полного растворения профильтровать во флакон для отпуска через промытый стерильный фильтр с тампоном глазной ваты, проверить на чистоту и остальную воду процедить через тот же тампон. Закрыть, проверить снова на чистоту, оформить и отпустить. Этикетка «Наружное». Срок годности 1 сутки. Применять как антибактериальное средство. Рабочая пропись №2 V=10мл Воды очищенной стерильной 10 мл Натрия хлорида 0,06 Эфедрина г/хл 0,02 V=10мл
5. Приведите нормативное обоснование требованиям к оформлению рецепта на данную лекарственную форму, срок действия и срок хранения его в аптеке. Нормируется ли отпуск ингредиентов, входящих в состав данной лекарственной формы? Ответ обоснуйте. Каким видам внутриаптечного контроля качества обязательно и целесообразно подвергнуть данные порошки? Имеются ли среди ингредиентов данной прописи подлежащие предметно-количественному учету в аптеке? Если имеются, назовите. Каковы профессиональные действия материально-ответственного лица при осуществлении предметно-количественного учета в аптеке? Ответ В составе рецепта содержится эфедрина гидрохлорид – раньше это было сильнодействующее вещество (Согласно «Списков сильнодействующих и ядовитых веществ», установленных Постановлением Правительства РФ № 964 от 29 декабря 2007 года, но с 1января 2013г. эфедрин исключен из списков сильнодействующих веществ»но он входит в Список прекурсоров, оборот которых в Российской Федерации ограничен и в отношении которых устанавливаются меры контроля в соответствии с законодательством Российской Федерации и международными договорами Российской Федерации (список IV) Приказом МЗ и СР РФ № 110 от 12 февраля 2007 года утвержден «Порядок назначения и выписывания лекарственных препаратов, изделий медицинского назначения и специализированных продуктов лечебного питания». Согласно приказу МЗ и Ср РФ № 110 рецепты на прекурсоры ( в том числе эфедрина гидрохлорид) выписываются на рецептурном бланке формы № 148 – 1/У – 88, рецепт оформляется штампом МО, подписью и личной печатью врача и печатью МО «Для рецептов». Срок действия рецептов 10 дней, срок хранения в аптеке в течение 3 лет. Рецепты на эфедрин, псевдоэфедрин в чистом виде и в смеси с другими лекарственными веществами для лечения больных с затяжными и хроническими заболеваниями могут выписываться на курс лечения до 1 месяца. В этих случаях на рецептах должна быть надпись «По специальному назначению», скрепленная подписью врача и печатью МО «Для рецептов». Норма отпуска Эфедрина гидрохлорида 0,6 (приказ № 110). Нормы отпуска других эфедринсодержащих препаратов: Теофедрина, теофедрина-Н и Нео-теофедрина – 30 таблеток Солутана (раствор 50 мл) – 1 флакон Спазмовералгина, Спазмовералгина-нео – 50 таблеток Других комбинированных лекарственных средств, содержащих эфедрина гидрохлорид, подлежащих ПКУ – 1 упаковка Комбинированных лекарственных средств, содержащих псевдоэфедрина гидрохлорид, подлежащих ПКУ – 1 упаковка Согласно приказу МЗ РФ от 16.07.97 № 214 «Инструкция по контролю качества лекарственных средств, изготовляемых в аптеках» данную лекарственную форму целесообразно подвергнуть обязательным видам внутриаптечного контроля: письменному, органолептическому и контролю при отпуске. Эфедрина гидрохлорид – прекурсор, подлежащий предметно – количественному учёту. Правила ведения и хранения, а также формы специальных журналов регистрации операций, в результате которых изменяется количество прекурсоров, утверждены постановлением Правительства РФ от 09.06.2010 N 419 «О порядке представления сведений о деятельности, связанной с оборотом прекурсоров наркотических средств и психотропных веществ, и регистрации операций, в результате которых изменяется количество прекурсоров наркотических средств, психотропных веществ» В количественном выражении пркурсоры Списка IV учитываются в специальном «Журнале регистрации операций, в результате которых изменяется количество прекурсоров наркотических средств и психотропных веществ» Регистрация операций, при которых изменяется количество прекурсоров, ведется по каждому наименованию прекурсора на отдельном развернутом листе журнала регистрации или в отдельном журнале регистрации. Журналы регистрации должны быть сброшюрованы, пронумерованы и скреплены подписью руководителя юридического лица (или индивидуального предпринимателя) и печатью юридического лица (или индивидуального предпринимателя). Руководитель юридического лица (или индивидуального предпринимателя) назначает лиц, ответственных за ведение и хранение журналов регистрации. Записи в журналах регистрации производятся лицом, ответственным за их ведение и хранение, шариковой ручкой (чернилами) в хронологическом порядке непосредственно после каждой операции по каждому наименованию прекурсора на основании документов, подтверждающих совершение этой операции. Документы или их копии, подтверждающие совершение операции или их копии, заверенные в установленном порядке, подшиваются в отдельную папку, которая хранится вместе с соответствующим журналом регистрации. Нумерация записей в журналах регистрации по каждому наименованию прекурсора осуществляется в пределах календарного года в порядке возрастания номеров. Нумерация записей в новых журналах начинается с номера, следующего за последним номером в заполненных журналах. Не использованные в текущем календарном году страницы журналов регистрации прочеркиваются и не используются в следующем календарном году. Запись в журналах регистрации каждой проведенной операции заверяется подписью лица, ответственного за их ведение и хранение, с указанием фамилии и инициалов. Исправления в журналах регистрации заверяются подписью лица, ответственного за их ведение и хранение. Подчистки и незаверенные исправления в журналах регистрации не допускаются. Журнал регистрации хранится в металлическом шкафу (сейфе), ключи от которого находятся у лица, ответственного за ведение и хранение журнала. Заполненные журналы вместе с документами, подтверждающими осуществление операций, хранятся юридическим лицом или индивидуальным предпринимателем в течение 10 лет после внесения в них последней записи. По истечении указанного срока журналы подлежат уничтожению по акту, утверждаемому руководителем юридического лица или индивидуальным предпринимателем. 6. Дайте характеристику природному растительному источнику эфедрина, указанному в составе прописи. Приведите латинские названия растения, сырья, семейства. Укажите сырьевую базу. Какие методики существуют в фармакогнозии для подтверждения наличия эфедрина в лекарственном растительном сырье? Какая методика количественного определения эфедрина включена в ФС? Приведите схему методики с обоснованием выбора экстрагента, условий экстракции, очистки и собственно количественного определения. Каковы условия хранения лекарственного сырья, содержащего эфедрин? Ответ Природный растительный источник эфедрина — трава эфедры — Неrba Ерhedrae. Производящее растение — эфедра хвощевая (эфедра горная, эфедра хвощевидная) — Ерhedra equisetina. Семейство эфедровых - Ерhedrасеае. Сырьевая база:  Подлинность: Алкалоиды извлекают из сырья путем смачивания сырья концентрированным раствором аммиака. Раствор аммиака вытесняет алкалоиды-основания из солей. Затем эфедрин извлекают органическим растворителем (эфиром, хлороформом, бензолом и др.). Извлечение проводят многократно новыми портами до полного истощения сырья. Органический растворитель отгоняют. Сухой остаток представляет собой очищенную сумму алкалоидов. Испытание на подлинность проводят с реактивом Майера — тетрайодомеркурат калия (К2 ВiJ4)— образует осадки белого или желтоватого цвета. Можно провести и другую реакцию: сухой остаток следует растворить в 1 мл воды, добавить раствор сульфата меди и раствора едкого натра. Образуется синее окрашивание. При взбалтывании этого раствора с 1 мл эфира — эфирный слой окрашивается в фиолетово-красный цвет, а водный — сохраняет синее окрашивание. Количественное определение: Основано на титриметрическом методе прямого титрования. Сухой остаток растворяют в 10 мл воды, добавляют 2 капли раствора бромфенолового синего и по каплям разведенной уксусной кислоты до получения зеленовато-желтого окрашивания. Полученный раствор титруют 0,1 н раствором нитрата серебра до фиолетовой окраски раствора и осадка. Эфедрина в сырье должно быть не менее 1,6%. Хранение: Сырье хранят по списку Б с предосторожностями, отдельно от прочего лекарственного сырья, в сухом, хорошо проветриваемом помещении. Во избежание отравления раздражения слизистых оболочек при упаковке и погрузке эфедры следует надевать марлевые повязки и защитные очки, тщательно мыть руки после работы. Применение: Основным лекарственным средством является эфедрин, выпускаемый в виде гидрохлорида. Применяется при лечении заболеваний аллергического характера (бронхиальная астма, крапивница, вазомоторный насморк и др.). Вызывая сужение сосудов, он повышает артериальное давление. Используют также при отравлениях наркотиками и снотворными. Местно применяют раствор эфедрина как сосудосуживающее средство и средство для расширения зрачка (с диагностической целью в офтальмологии). 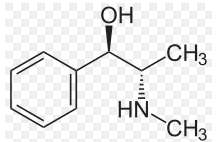 |