ЗАНЯТИЕ 3 Электролитическая диссоциация. Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
Электролитическая диссоциацияЭлектролиты и неэлектролиты. Теория | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nao | – 1ē | Na+ | |
| 1s22s22p63s1 | | 1s22s22p6 | |
| нейтральный атом натрия; на внешнем электронном слое находится один электронов | | положительно заряженный ион натрия; на внешнем электронном слое находится 8 электронов (как у ближайшего благородного газа неона) | |
| Fo | + 1ē | F– | |
| 1s22s22p5 | | 1s22s22p6 | |
| нейтральный атом фтора; на внешнем электронном слое находится 7 электронов | | отрицательно заряженный ион фтора; на внешнем электронном слое находится 8 электронов | |
Распад электролитов на ионы в расплавах осуществляется за счёт действия высоких температур, а в растворах за счёт действия молекул растворителя.
Особенностью ионных соединений является то, что в узлах их кристаллической решётки имеются уже готовые ионы и в процессе таких веществ растворения диполям растворителя (воды) остаётся только разрушить эту ионную решётку (рис. 18).
Вещества, образованные полярными ковалентными связями, переходят в раствор в виде отдельных молекул, которые, как и молекулы Н2О, представляют собой диполи, например:

В этом случае диполи Н2О, ориентируясь соответствующим образом вокруг растворенной молекулы электролита, вызывают в ней дальнейшую поляризацию ковалентной связи, а затем и её окончательный гетеролитический разрыв (рис. 29).
H – Cl H+ + Cl
Рис. 29. Схема электролитической диссоциации в растворе полярной молекулы HCl
Процесс электролитической диссоциации протекает одновременно с процессом растворения веществ, и поэтому в растворах все ионы находятся в гидратированном состоянии (окружены оболочками из молекул Н2О).
Однако для простоты в уравнениях химических реакций ионы изображаются без окружающих их гидратных оболочек: H+, NO3–, K+ и т.д.
2. Ионы электролитов в растворе или расплаве за счёт теплового движения хаотически перемещаются по всем направлениям. Но если в раствор или расплав опустить электроды и пропустить электрический ток, то положительно заряженные ионы электролита начинают двигаться к отрицательно заряженному электроду – катоду (поэтому они иначе называются катионами), а отрицательно заряженные ионы – к положительно заряженному электроду – аноду (поэтому они иначе называются анионами).
Таким образом, электролиты являются проводниками второго рода. Они переносят электрический заряд за счёт направленного движения ионов. Металлы же являются проводниками первого рода, т.к. проводят электрический ток за счёт направленного движения электронов.
3. Процесс электролитической диссоциации обратим. Наряду с распадом молекул на ионы всегда протекает обратный процесс – соединение ионов в молекулы или ассоциация. Поэтому в уравнениях реакций электролитической диссоциации веществ вместо знака равенства «=» ставят знак обратимости «
HF
CH3COOH
Общая характеристика электролитов
Одни электролиты в растворах полностью распадаются на ионы. Они называются сильными.
Другие электролиты только частично распадаются на ионы, т.е. большая часть их молекул остаётся в растворе в недиссоциированном виде. Такие электролиты называются слабыми.
Данное свойство вещества не абсолютно и зависит не только от его природы, но и от природы растворителя. Чем больше диэлектрическая постоянная растворителя, тем сильнее его ионизирующая слабость. Так в водных растворах (ε(Н2О) = 80). LiCl и NaCl ведут себя как сильные электролиты. Но если их растворить в уксусной кислоте (ε = 6) или ацетоне (ε = 21), то они начинают проявлять свойства слабых электролитов.
В водных растворах сильными электролитами являются соли, растворимые основания (образованные, как правило, щелочными и щелочноземельными металлами), некоторые неорганические или минеральные кислоты (HCl, HBr, HI, H2SO4, HNO3 и др.).
В тоже время многие органические кислоты, некоторые неорганические кислоты (HNO2, HF, H2S, H2SiO3, H3PO4 и т.д.), нерастворимые в Н2О основания ведут себя как слабые электролиты.
Вещества, в которых частицы связаны различными видами химической связи, распадаются на ионы сперва по ионным связям
KНSO4 ® K+ + НSO4–,
а затем – по наиболее полярным ковалентным связям
НSO4– ® Н+ + SO42–.
Гетеролитический разрыв малополярных или неполярных ковалентных связей в процессах диссоциации таких веществ, как правило, не происходит.
Количественно процесс распада молекул электролита на ионы оценивается с помощью степени электролитической диссоциации α.
Степень диссоциации – это отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе (распавшихся и нераспавшихся):
NО = NД + NH (число непродиссоциированных молекул электролита в растворе)
Так как число частиц вещества (N) и их химическое количество (n) связаны между собой соотношением N = n ∙ NA, то степень диссоциации можно ещё рассчитать и другим способом:
Для сильных электролитов α близка к единице. Практически все их молекулы в растворе находятся в диссоциированном виде, процесс ассоциации протекает крайне незначительно.
В связи с этим в уравнениях диссоциации данных веществ вместо знака обратимости «
HCl H+ + Cl–
KOН ® K+ + OH–
K2SO4 ® 2K+ + SO42–
Слабые электролиты
Для слабых электролитов степень диссоциации очень мала (α<<1). Так для воды при 20оС α ≈ 1 ∙ 10-9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов наряду с диссоциацией непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
В результате диссоциации электролита происходит увеличение числа его частиц в растворе. Это позволяет экспериментально определить степень диссоциации по измерению тех свойств раствора, которые зависят только от количества содержащихся в нём частиц растворённого вещества, но не от их природы, размеров, массы. К таким свойствам относятся температура кипения и замерзания раствора, осмотическое давление и некоторые другие.
Для растворов слабых электролитов значения α, определённые различными способами, как правило, совпадают и всегда значительно меньше единицы, что хорошо согласуется с теорией Аррениуса.
Как показали экспериментальные исследования, степень диссоциации слабых электролитов зависит от температуры раствора и его концентрации.
Таблица 8. Изменение степени диссоциации уксусной кислоты в зависимости от ее молярной концентрации в растворе
| Ссн3соон, моль/дм3 | 0,2 | 0,1 | 0,05 | 0,01 | 0,005 | 0,001 |
| α, % | 0,95 | 1,4 | 1,9 | 4,2 | 6,0 | 12,4 |
При повышении температуры раствора степень диссоциации увеличивается, т.к. при этом лучше обеспечивается поляризация и облегчается последующий разрыв ковалентной полярной связи в молекулах электролита. При понижении температуры – α уменьшается.
Возрастает α и при уменьшении концентрации растворов, т.е. при их разбавлении (табл. 8), т.к. при этом толщина разделяющей ионы водной прослойки становится больше, поэтому электростатическое взаимодействие между ними, приводящее к ассоциации ионов в молекулы наблюдается реже.
При бесконечно большом разведении степень диссоциации электролита стремится к своему максимальному значению, т.е. к единице (рис. 30).
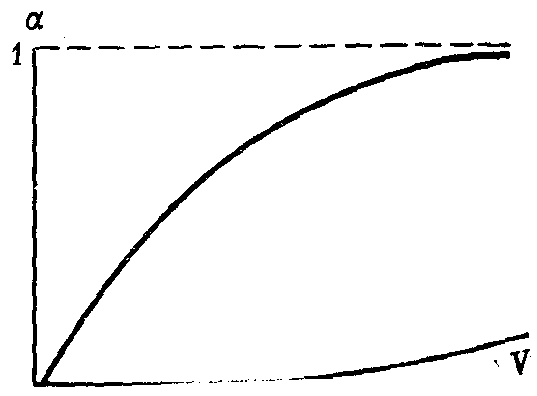
Рис. 30. Изменение степени электролитической диссоциации α с разбавлением V (схема)
Таким образом, для слабых электролитов α не является постоянной величиной. Поэтому их способность к распаду на ионы удобнее сравнивать по константе диссоциации, которая представляет собой константу равновесия обратимой реакции электролитического разложения молекул электролита.
Например:
HNO2
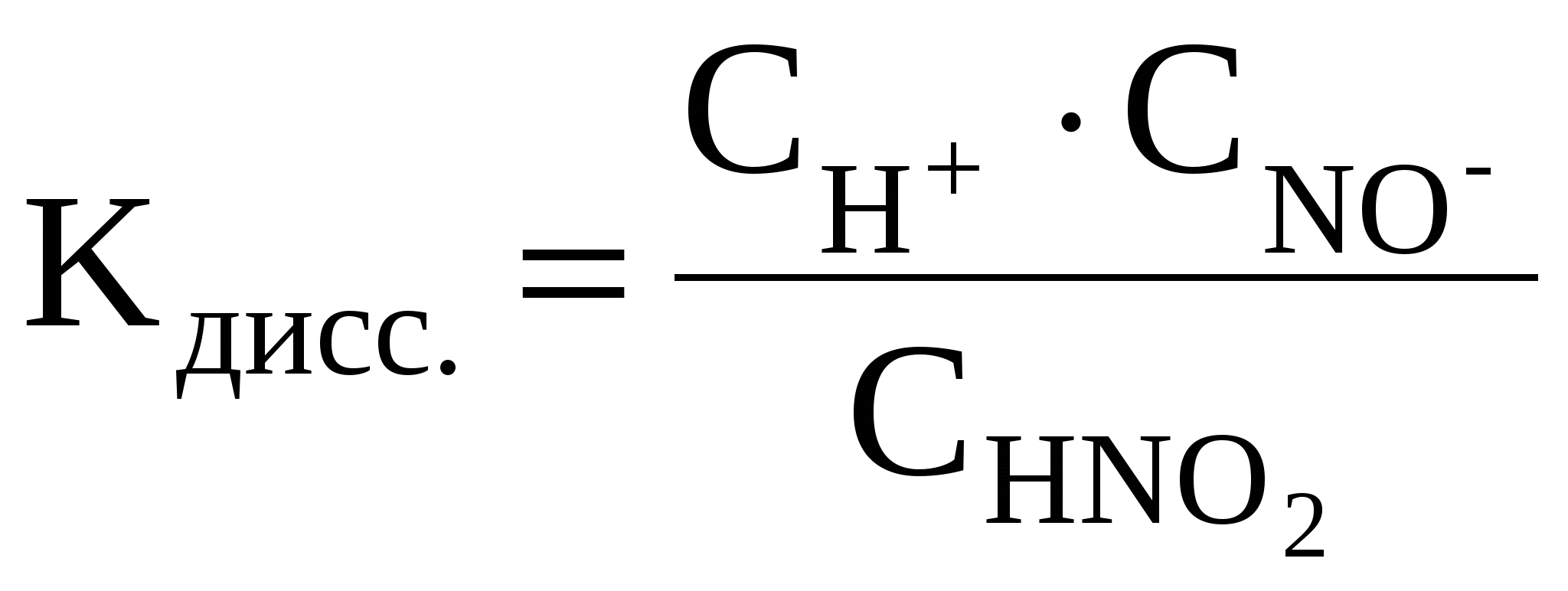
где СН+, СNO2–, CHNO2 – равновесные молярные концентрации ионов H+, NO2– и непродиссоциированных молекул HNO2.
Константа диссоциации слабых электролитов не зависит от их концентрации в растворе даже при значительном разбавлениии и при данной температуре остается постоянной величиной (табл. 9). С увеличением температуры раствора константа диссоциации слабых электролитов во многих случаях изменяется сложным образом (рис. 31).
Таблица 9. Зависимость величины Kдисс. уксусной кислоты в растворе от ее молярной концентрации при Т = 298 K
| Ссн3соон, моль/дм3 | 0,1 | 0,05 | 0,0012 | 0,0003 |
| Kдисс. | 1,845·10–5 | 1,845·10–5 | 1,850·10–5 | 1,855·10–5 |

Рис. 31. Зависимость константы диссоциации Kнекоторых слабых электролитов в водных растворах от температуры t(°С)
Чем меньше Kдисс., тем более слабым является данный электролит. Например, уксусная кислота (Kдисс. = 1,85·10–5) почти в 220 000 раз сильнее циановодородной HCN (Kдисс. = 4,8·10–10) и примерно в 10 раз слабее муравьиной кислоты (Kдисс. = 1,8·10–4).
Существуют слабые электролиты (многоосновные кислоты, многокислотные основания) процесс распада которых на ионы протекает ступенчато, т.е. в несколько стадий. При этом каждая стадия характеризуется своей величиной константы диссоциации.
Например, в 2 стадии осуществляется диссоциация сероводородной кислоты:
1) H2S
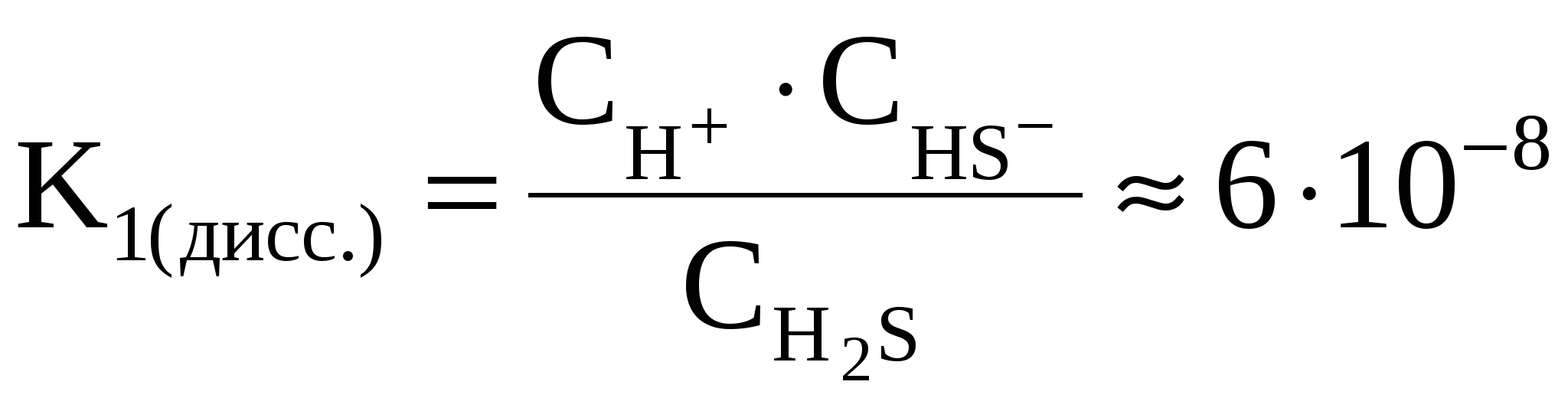
2) HS–
Суммарное уравнение реакции диссоциации H2S выглядит следующим образом:
H2S
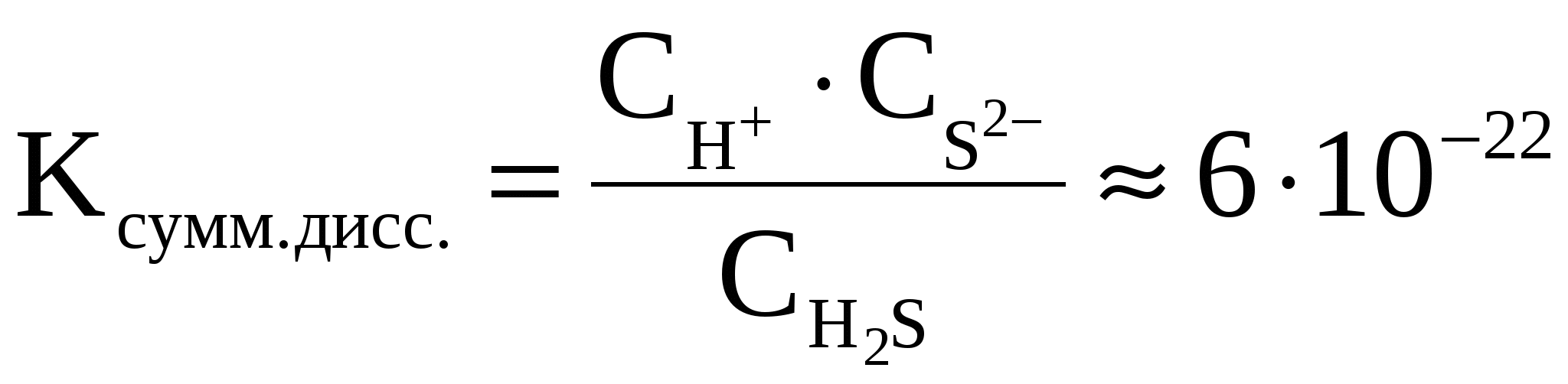
Величина константы диссоциации для суммарного уравнения и значения констант диссоциации отдельных стадий связаны между собой соотношением:
Kсумм. = K1 · K2 · K3 …
При ступенчатой диссоциации распад слабого электролита на каждой последующей стадии происходит в меньшей степени, чем на предыдущей, т.е. K1 > K2 > K3 и т.д. Это объясняется тем, что отрыв иона происходит уже не от нейтральной молекулы (как на первой стадии), а от частицы с все более возрастающим зарядом и требует поэтому больших затрат энергии.
Часто для оценки силы слабого электролита вместо величины константы диссоциации используют ее десятичный логарифм, взятый с обратным знаком (pK)
pK = -lg Kдисс.
В этом случае чем больше величина pK, тем более слабым является электролит.
Степень диссоциации слабого электролита уменьшается если внести в его раствор даже в небольшом количестве сильный электролит, содержащий в своем составе одноименные ионы.
Например, если в раствор СН3СООН добавить ацетат натрия CH3COONa, то за счет диссоциации соли концентрация ацетат-ионов СН3СОО– резко увеличится. В соответствии с принципом Ле Шателье это приведет к смещению равновесия реакции
СН3СООН
в левую сторону. Аналогичный эффект наблюдается если в раствор СН3СООН добавить небольшое количество сильной кислоты.
Таким образом, диссоциация слабой кислоты подавляется в присутствии собственной соли или сильной кислоты. То же можно сказать и о слабом основании, диссоциация которого будет подавляться в сильнощелочной среде или в присутствии соли, содержащей одноименный катион.
При добавлении большого количества соответствующего сильного электролита слабый электролит практически не будет диссоциировать.
Существует количественная связь между степенью диссоциации слабого электролита и его концентрацией в растворе, называемая законом разбавления Оствальда.
Для бинарного электролита, молекулы которого распадаются только на 2 иона, можно показать, что
где С – исходная молярная концентрация электролита в растворе; α – степень диссоциации электролита; С ∙ α – концентрация распавшихся молекул электролита и образовавшихся при этом ионов.
В
 ильгельм Фридрих Оствальд (1853 – 1932)
ильгельм Фридрих Оствальд (1853 – 1932)Родился в Риге. Учился в Дерптском университете, здесь же в 1878 г. получил степень доктора. С 1882 г. был профессором Рижского университета. С 1887 г. перешел на кафедру физической химии в Лейпциге, где работал до 1928 г.
В. Оствальд изучал электрическую проводимость органических кислот. Познакомившись с работами С. Аррениуса он стал его сторонником. В. Оствальд внес существенный вклад в теорию электролитической диссоциации. В частности, он предложил свой известный закон разбавления, показал, что аналитические реакции в растворах следует рассматривать как ионные, и объяснил цвет растворов многих веществ специфической окраской ионов. В. Освальду принадлежат также исследования по катализу.
Так как степень диссоциации слабых электролитов мала, то можно пренебречь этой величиной в знаменателе. Тогда K = C·α2, откуда
Для электролитов, молекулы или формульные единицы которых распадаются на большее число ионов, закон разбавления Оствальда носит более сложный характер.
Сильные электролиты
Согласно теории электролитической диссоциации С. Аррениуса сильные электролиты в растворах должны полностью распадаться на ионы (α = 1). Но экспериментально определенные значения степени диссоциации для сильных электролитов даже в разбавленных растворах, как правило, получается меньше единицы (табл. 10). С увеличением концентрации растворов наблюдается еще более существенное отклонение значения α от максимального (табл. 10).
Таблица 10. Зависимость величины степени диссоциации KCl (вычисленной на основании измерения электропроводности его растворов при 18оС) от концентрации
| СKCl, моль/дм3 | 0,01 | 0,1 | 1 | 2 |
| α, % | 94,2 | 86,2 | 75,6 | 71,2 |
Чтобы объяснить это неожиданное противоречие, теорию Аррениуса, в первой трети двадцатого века пересмотрели и уточнили. Наибольший вклад в ее дополнение и развитие внесли ученые Дебай и Гюккель.
Они показали, что сильные электролиты как в разбавленных, так и в концентрированных растворах (вплоть до насыщенных) диссоциируют практически нацело. Но при этом между некоторой частью ионов противоположного знака заряда возникают электростатические силы взаимодействия, по своей величине меньше чем силы ионной связи. За счет действия этих сил вокруг каждого иона создается «атмосфера» (сферическая оболочка), состоящая из ионов противоположного знака (рис. 32).
Ввиду того, что радиус этой ионной атмосферы относительно большой, атмосферы соседних ионов пересекаются друг с другом (рис. 32). Это обусловливает довольно сложные взаимодействия между всеми компонентами раствора и оказывает определенное влияние на его свойства.
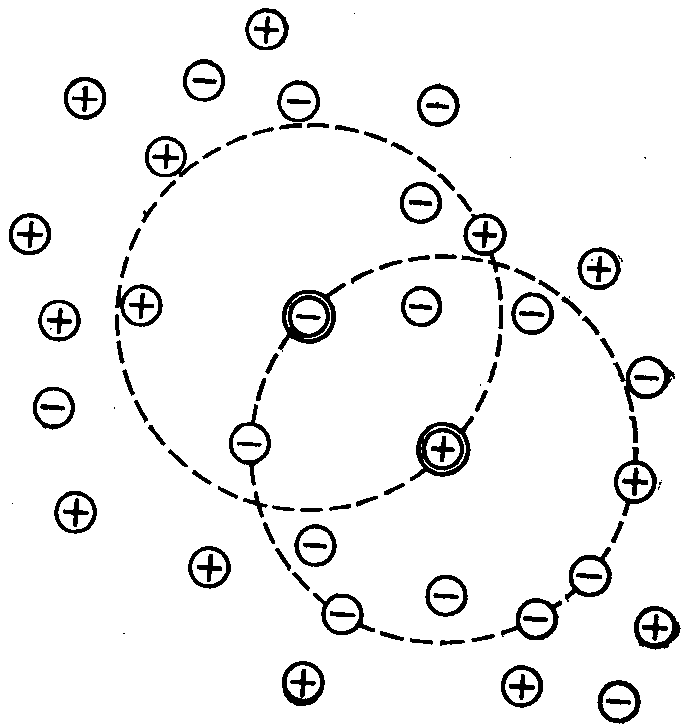
Рис. 32. Модель ионной атмосферы, принятая теорией Дебая и Гюккеля
Д
 ебай Петер Йозеф Вильгельм (1884 – 1966) — физик, лауреат Нобелевской премии по химии за 1936 год.
ебай Петер Йозеф Вильгельм (1884 – 1966) — физик, лауреат Нобелевской премии по химии за 1936 год.По национальности голландец. Окончил Высшую техническую школу в Ахене (1905) и Мюнхенский университет (1910). Профессор в Цюрихе (1911 и 1920), Утрехте (1912), Гёттинген (1914), Лейпциге (1927), Берлине (1935). Директор Института физики имени кайзера Вильгельма в Берлине (1935). С 1940 профессор Корнеллского университета в Итаке. С 1924 года Иностранный член АН СССР.
Основные направления научной деятельности: теория теплоёмкостей твёрдого тела при низких температурах (модель Дебая); Теория теплопровод-ности диэлектрических кристаллов, понятие температуры Дебая; понятие дебаевской длины, введённое в ходе изучения явлений электролиза; дипольная теория диэлектриков. Метод Дебая-Шеррера для наблюдения интерференции рентгеновских лучей в кристаллических порошках и жидкостях. Также Дебаю принадлежит ряд работ по теории твёрдого тела, теории проводимости электролитов и др.
В частности, во внешнем электрическом поле подвижность ионов в растворах сильных электролитов уменьшается за счет «тормозящего действия» их ионных атмосфер, которые перемещаются в противоположном от ионов направлении. При этом электропроводность раствора, а значит и сила тока в нем понизятся (рис. 33). Это создаст эффект уменьшения реального числа кинетически активных частиц растворенного вещества. В результате все свойства растворов электролитов, зависящие от концентрации в них ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита. Таким образом, экспериментально измеряется не истинная, а кажущаяся степень диссоциации сильного электролита.
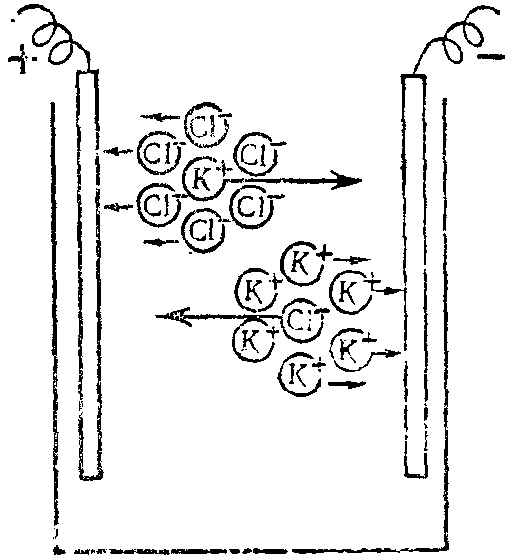
Рис. 33. Движение ионов и их ионных атмосфер в растворе сильного электролита под действием внешнего электрического поля
Для оценки состояния ионов в растворе используют не их аналитическую концентрацию, а величину, называемую активностью (а).
Под активностью ионов подразумевают ту их эффективную (условную) концентрацию, соответственно которой они количественно проявляют себя в растворе.
Активность иона а равна его молярной концентрации С, умноженной на коэффициент активности γ
а = С · γ
Коэффициенты активности различных ионов отличаются друг от друга. Кроме этого они зависят от концентрации раствора. В концентрированных растворах коэффициент активности обычно меньше единицы, что указывает на взаимодействие между ионами, приводящие к их взаимному связыванию. В разбавленных растворах γ приближается к единице. Это свидетельствует о слабом межионном взаимодействии, т.к. в таких растворах расстояния между ионами настолько велики, что действие межионных сил почти не проявляется.
В разбавленных растворах природа ионов мало влияет на значения их коэффициентов активности. Установлено, что в таких системах величина γ зависит лишь от заряда иона и от ионной силы раствора I (табл. 11).
Таблица 11. Коэффициенты активности одно-, двух- и трехзарядных ионов в растворах с различной ионной силой
| Ионная сила раствора, I | Коэффициент активности | ||
| однозарядные ионы | двухзарядные ионы | трехзарядные ионы | |
| 0 | 1 | 1 | 1 |
| 0,001 | 0,96 | 0,87 | 0,72 |
| 0,002 | 0,95 | 0,81 | 0,63 |
| 0,005 | 0,92 | 0,72 | 0,48 |
| 0,01 | 0,89 | 0,63 | 0,35 |
| 0,05 | 0,81 | 0,43 | 0,15 |
| 0,1 | 0,76 | 0,34 | 0,084 |
| 0,2 | 0,70 | 0,24 | 0,041 |
| 0,5 | 0,62 | 0,15 | 0,014 |
Под ионной силой раствора понимают полусумму произведений молярных концентраций всех находящихся в растворе ионов на квадрат их заряда
I = ½ (C1z12 + C2z22 + … + Cnzn2),
где С1, С2, …, Сn – молярные концентрации ионов в растворе; z1, z2, …, zn – заряды ионов, находящихся в растворе.
Э
 рих Арманд Артур Йозеф Гюккель (1896 — 1980) — один из основоположников квантовой химии, создатель теории сильных электролитов (совместно с П. Дебаем).
рих Арманд Артур Йозеф Гюккель (1896 — 1980) — один из основоположников квантовой химии, создатель теории сильных электролитов (совместно с П. Дебаем). В 1922 Хюккель совместно с Максом Борном выполнил исследование вращательно-колебательных спектров многоатомных молекул. В 1923-1925 совместно с Петером Дебаем разработал теорию растворов сильных электролитов (теория Дебая-Гюккеля). Свойства разбавленных растворов сильных электролитов в растворителях с высокой диэлектрической проницаемостью были количественно истолкованы ими на основе предположения о полной диссоциации электролитов при учёте электростатического взаимодействия между заряженными частицами.
В разбавленных растворах ионная силы которых меньше или равна 0,01 (I ≤ 0,01), коэффициент активности рассчитывается по формуле lg γ = –0,5 z2
В растворах со средним разбавлением (0,5 > I > 0,01)
В еще более концентрированных растворах коэффициент активности рассчитывают по более сложным формулам.
Ионная сила плазмы крови человека и большинства других биологических жидкостей близка к 0,15. Ионная сила изотонического раствора NaCl (0,9%) также равна 0,15. Таким образом при проведении биохимических исследований, выполнении опытов на изолированных органах и тканях необходимо использовать не только изотонические растворы, но и растворы с одинаковой ионной силой.
При значительном увеличении ионной силы раствора в нем уменьшается количество свободной воды, не участвующей в гидратации ионов. Это приводит к дегидратации природных полиэлектролитов (белков, нуклеиновых кислот и др.), в результате чего изменяется их конформация и наблюдается частичное высаливание, т.е. выпадение данных полимеров из растворов в осадок.
Теория сильных электролитов, созданная Дебаем и Гюккелем, имеет достаточно сложный математический аппарат и безоговорочно применима к растворам, концентрация ионов в которых не превышает 0,1 моль/л. В этом случае выводы теории очень хорошо согласуются с экспериментальными данными.
Для растворов с более высокой концентрацией она уже не характеризует достаточно полно чрезвычайно сложную картину взаимодействия между всеми частицами, находящимися в системе.
В настоящее время установлено, что в более концентрированных растворах между заряженными ионами возможно образование ионных пар или ионных двойников, которые образуются за счет действия кулоновских сил и проявляют свойства электронейтральных частиц.
Например, образование ионных двойников из исходных индивидуальных ионов в растворе KCl можно схематически представить следующим образом:
K+ + Cl– = K+Cl–
Такая ассоциация ионов обнаружена в водных растворах калий-хлорида при концентрации соли ≈ 27-30 моль/л.
В неводных растворителях с низкой диэлектрической проницаемостью данные процессы возможны и при более низких концентрациях растворенных веществ.
Экспериментально установлено, что в концентрированных растворах электролитов наряду с незаряженными ионными парами могут образовываться и частицы более высокого порядка: ионные тройники, нейтральные ассоциаты, состоящие из двух и более ионных пар и т.д.
Вывод теоретических уравнений для расчета коэффициентов активности в таких системах возможен при установлении более точных представлений о строении электролитов, о природе и учете всех сил, которые действуют в растворе между находящимися в нем частицами растворителя и растворенного вещества.
Диссоциация воды. Водородный показатель
Чистая вода очень плохо проводит электрический ток, но всё же обладает измеримой электропроводностью, которая объясняется частичной диссоциацией молекул Н2О на ионы водорода и гидроксид-ионы:
Н2О
По величине электропроводности чистой воды можно вычислить концентрацию в ней ионов Н+ и ОН–. При 25оС она равна 10-7 моль/л.
Константа диссоциации Н2О рассчитывается следующим образом:
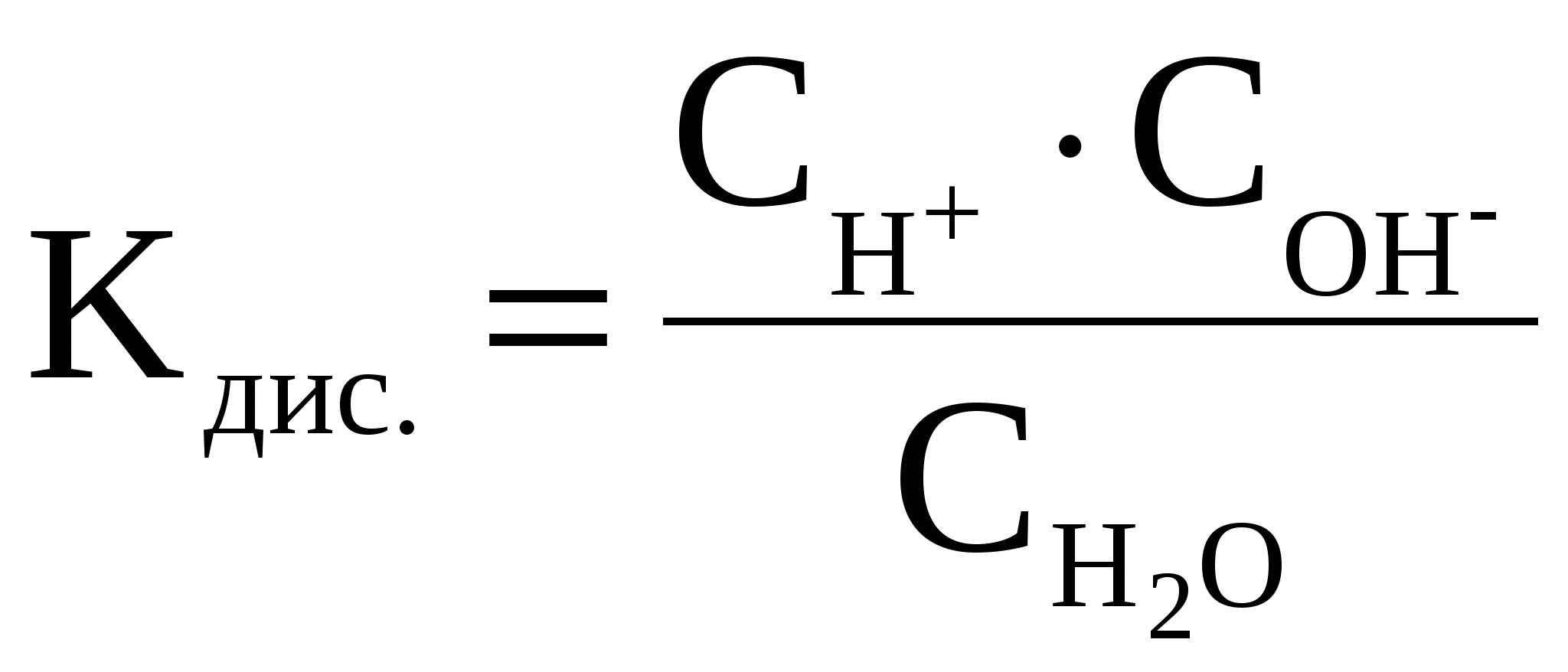
Перепишем это уравнение:
Следует подчеркнуть, что данная формула содержит равновесные концентрации молекул Н2О, ионов Н+ и ОН–, которые установились на момент наступления равновесия в реакции диссоциации Н2О.
Но, поскольку степень диссоциации Н2О очень мала, можно считать, что концентрация недиссоциированных молекул Н2О в момент наступления равновесия практически равна общей начальной концентрации воды, т.е. 55,56 моль/дм3 (1 дм3 Н2О содержит 1000 г Н2О или 1000 : 18 ≈ 55,56 (молей). В разбавленных водных растворах можно считать, что концентрация Н2О будет такой же. Поэтому, заменив в уравнении (42) произведение двух постоянных величин
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение молярных концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Она называется иначе ионным произведением воды.
В чистой воде при 25оС
Поэтому для указанной температуры:
При увеличении температуры значении
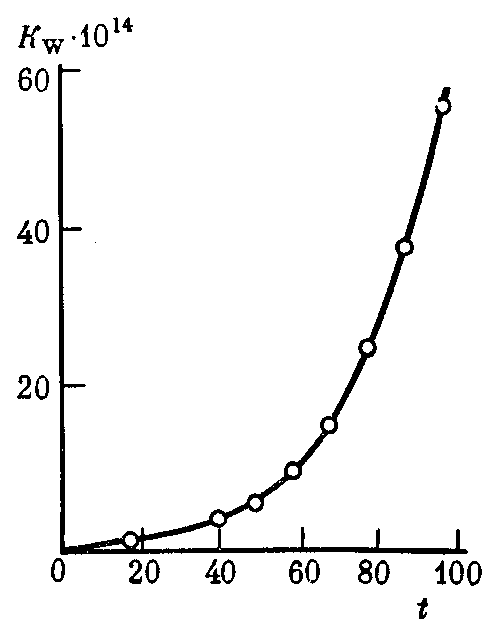
Рис. 34. Зависимость константы диссоциации воды Kwот температуры t(°С)
Растворы, в которых концентрации ионов Н+ и ОН– одинаковы, называются нейтральными растворами. В кислых растворах больше содержится ионов водорода, а в щелочных – гидроксид-ионов. Но какова бы ни была реакция среды в растворе, произведение молярных концентраций ионов Н+ и ОН– останется постоянным.
Если, например, к чистой Н2О добавить некоторое количество кислоты и концентрация ионов Н+ при этом увеличится до 10-4 моль/дм3, то концентрация ионов ОН– соответственно понизится так, что произведение
нейтральный раствор
кислый раствор
щелочной раствор
На практике для количественной характеристики кислотности или щёлочности раствора используют не молярную концентрацию в нём ионов Н+, а её отрицательный десятичный логарифм. Эта величина называется водородным показателем и обозначается через рН:
рН = –lg [H+]
Например, если
Для измерения рН раствора существуют различные методы. Очень удобно приблизительно оценивать реакцию раствора с помощью специальных реактивов, называемых кислотно-основными индикаторами. Окраска этих веществ в растворе меняется в зависимости от концентрации в нём ионов Н+. Характеристика некоторых наиболее распространённых индикаторов представлена в таблице 12.
Таблица 12. Важнейшие кислотно-основные индикаторы
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый красный | красный рН < 4,2 | оранжевый 4,2 < рН < 6,3 | жёлтый рН > 6,3 |
| Фенолфталеин | бесцветный рН < 7 | бесцветный 7 < pH < 8 | малиновый рН > 8 |
| Лакмус | красный рН < 5 | фиолетовый 5< pH < 8 | синий рН > 8 |
Из таблицы 12 следует, что с помощью индикаторов мы можем определить не точное значение рН раствора, а тот интервал, внутри которого это значение может лежать.
Существует также универсальный индикатор, с помощью которого можно определить приблизительное значение (с точностью до единицы) рН раствора в широком интервале от 0 до 14.
Для многих химических и биологических процессов величина рН раствора имеет большое значение. Так, рН крови человека имеет строго постоянное значение 7,36±0,04. Отклонение от него в ту или иную сторону даже на незначительную величину приводит к развитию в организме различных патологических (болезненных) процессов, которые могут завершиться летальным исходом или смертью. Растения нормально произрастают, если значение рН почвенного раствора лежит в определённом интервале, характерном для данного вида растения. От величины рН зависят и свойства природных вод, в частности, их коррозионная активность.
Общая характеристика катионов II аналитической группы
И
 з солей этих катионов хорошо растворимыми в воде являются лишь нитраты. Оксиды и гидроксиды трудно растворимы. Cеребра (I) гидроксид неустойчив: в момент образования большая часть молекул разлагается по схеме:
з солей этих катионов хорошо растворимыми в воде являются лишь нитраты. Оксиды и гидроксиды трудно растворимы. Cеребра (I) гидроксид неустойчив: в момент образования большая часть молекул разлагается по схеме:2 AgOH ↔ Ag2O↓ + H2O
С
 еребра (I) гидроксид – сильное основание и поэтому растворимые его соли (например, нитрат) гидролизу практически не подвергается, т.к. является солью сильного основания и сильной кислоты.
еребра (I) гидроксид – сильное основание и поэтому растворимые его соли (например, нитрат) гидролизу практически не подвергается, т.к. является солью сильного основания и сильной кислоты.Свинца (II) гидроксид – слабое основание, проявляющее амфотерные свойства. Отсюда следует, что свинца (II) нитрат гидролизу подвергается, и раствор этой соли имеет кислую реакцию.
Соляная кислота с ионами серебра, свинца, ртути (I) образует трудно растворимые осадки хлоридов. Так как остальные катионы, изучаемые нами, не дают нерастворимых хлоридов, соляная кислота может быть использована в качестве группового реактива на катионы II группы.
Химический анализ катионов II группы имеет большое значение в определении качества изделий из стекла, пищевых продуктов и т.д., поэтому при изучении реакций катионов II группы и при проведении анализа смеси катионов этой группы, следует быть очень внимательными и вдумчиво относиться к условиям проведения тех или иных реакций.
Действие группового реактива HCl
Разбавленная соляная кислота дает с катионами II группы белые осадки хлоридов. Свинца (II) хлорид – осадок кристаллический, серебра хлорид – аморфный, ртути (I) хлорид – похож на суспензию.
AgNO3 + HCl → AgCl ↓ + HNO3
Ag+ + Cl‾ → AgCl ↓
Pb(NO3)2 + 2 HCl → PbCl2↓ + 2 HNO3
Pb2+ + 2Cl‾ → PbCl2 ↓
Hg2(NO3)2 + 2 HCl → Hg2Cl2↓ + 2 HNO3
Hg22+ + 2Cl‾ → Hg2Cl2 ↓
ОПЫТ:берут три пробирки,в одну из них вносят 5 капель соли серебра, а в другую такое же количество соли свинца, в третью – соли ртути (I) и прибавляют в каждую из пробирок 1-2 капли 2 н. раствора соляной кислоты. Наблюдают выпадение осадков.
Работа с осадками:
Необходимо внимательно изучить внешний вид и свойства осадков:
а) осадок свинца (II) хлорида растворим в горячей воде. Этим свойством пользуются для отделения катиона свинца от катиона серебра (серебра хлорид растворяется в горячей воде незначительно).
Нужно иметь в виду, что свинца (II) хлорид в значительной мере растворим и в холодной воде, и поэтому групповой реактив HCl не полностью осаждает ионы свинца.
ОПЫТ: к осадку PbCl2 добавляют 10-15 капель дистиллированной воды и нагревают до полного растворения. При охлаждении кристаллы свинца (II) хлорида снова выпадают.
б) осадок серебра хлорида нерастворим в разбавленных кислотах (HNO3, H2SO4), но растворим в растворе NH4OH с образованием комплексной соли
AgCl + 2 NH4OH → [Ag(NH3)2]Cl + 2 H2O
Комплексную соль серебра (аммиакат серебра) можно разрушить:
1) действием азотной кислоты:
[Ag(NН3)2]Cl + 2 HNO3 → AgCl ↓ + 2 NH4NO3
[Ag(NН3)2]+ + 2H+ → AgCl ↓ + 2 NH4+
2) действием калия иодида (избытком):
[Ag(NН3)2]Cl + KI + 2 H2O → AgI ↓ + KCl + 2 NH4OH
[Ag(NН3)2]+ + I‾ + 2 H2O → AgI ↓ + 2 NH4OH
В первом случае выпадает осадок белого цвета, во втором случае – осадок бледно-желтого цвета.
Реакцию растворения хлорида в избытке аммония гидроксида с последующим разрушением комплексного аммиаката серебра одним из указанных способов используют в качестве реакции обнаружения иона серебра.
Опыт: к полученному осадку серебра хлорида прибавляют 2 н. раствор NH4OH до растворения осадка, затем делят раствор на 2 порции. К одной части раствора прибавляют 2 н.раствор азотной кислоты, а к другой – калия иодид в избытке. Наблюдают выпадение осадков.
в) осадок ртути (I) хлорида Hg2Cl2 растворяется только "царской водке" (3 капли HNO3 конц. + 9 капель HCl конц.) медленно, в течение 3-х минут, окисляясь при этом в Hg(NO3)2 или HgCl2.
С раствором аммиака ртути (I) хлорид взаимодействует с образованием хлорида димеркураммония, который, вследствие чрезвычайной неустойчивости, немедленно разлагается на трудно растворимый меркураммоний и металлическую ртуть. Последняя при этом выделяется в мелко раздробленном состоянии, придавая осадку черную окраску:
Hg2Cl2 + 2 NH4OH → [NH2Hg2]Cl↓ + NH4Cl + 2 H2O
[NH2Hg2]Cl → [NH2Hg]Cl↓ + Hg↓
ОПЫТ: осадок Hg2Cl2 белого цвета обработать 3 каплями концентрированного аммиака. Осадок приобретает черную окраску. Эта реакция характерна для ионов одновалентной ртути и служит для их обнаружения.
Едкие щелочи (NaOH или KOH)
Образуют с катионами II аналитической группы осадки:
а) ионы серебра – бурый осадок оксида серебра:
2 AgNO3 + 2 NaOH → Ag2O↓ + 2 NaNO3 + H2O
2 Ag+ + 2 OH‾ → Ag2O↓ + H2O
Осадок в избытке щелочи не растворяется.
б) ионы ртути (I) – черный осадок оксида ртути (I):
Hg2(NO3)2 + 2 KOH → 2 HgOH↓ + 2 KNO3
Hg2O↓ H2O
Hg22+ + 2 OH‾ → Hg2O↓ + H2O
в) ионы свинца – белый осадок свинца (II) гидроксида:
Pb(NO3)2 + 2 NaOH → Pb(OH)2↓ + 2 NaNO3
Pb2+ + 2 OH‾ → Pb(OH)2↓
Свинца (II) гидроксид обладает амфотерными свойствами и поэтому в избытке щелочи растворяется с образованием гидроксокомплекса свинца:
Pb(OH)2 + 2 NaOH → Na2[Pb(OH)4]
Pb(OH)2 + 2 OH‾ → [Pb(OH)4]2‾
Опыт: в одну пробирку добавляют 3 капли соли серебра, в другую – 3 капли соли свинца, в третью – соли ртути(I) и в каждую из пробирок добавляют 3 капли натрия гидроксида. К выпавшим осадкам добавляют избыток щелочи и убеждаются в нерастворимости оксида серебра и ртути(I), и в растворимости свинца (II) гидроксида в избытке щелочи.
