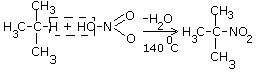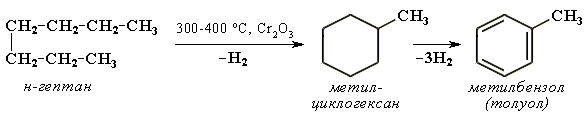1-12органика. Электронное сторение атома с в основном, в возбужденным состоянии, карбоанионная, карбокатионная. Тетраэдическая можель атома С
 Скачать 378.33 Kb. Скачать 378.33 Kb.
|
|
Тривиальные названия особенно часто имеют природные соединения - аминокислоты, углеводы, алкалоиды, стероиды. Употребление некоторых укоренившихся тривиальных и полутривиальных названий разрешается правилами ИЮПАК. К таким названиям относятся, например, «глицерин» и названия многих широко известных ароматических углеводородов и их производных. Рациональная номенклатура предельных углеводородов В отличие от тривиальной названия основываются на строении молекул. Названия сложных структур состовляют из названия блоков те радикалов связанных с основным навиболее важным узлом молекулы по этой номенклатуре алканы рассматриваются как производные метана у которого атомы водорода замещены соответствующими радикалами. Выбор метанового углерода произвольный поэтому 1 соедин может иметь неск названий.по этой номенклатуре алкены рассматривают как производные этилена а алкины-ацетилена. 7. Гомология органических соединений или закон гомологов — состоит в том, что вещества однойхимической функции и одинакового строения, отличающиеся друг от друга по своему атомному составу лишьна nСН 2, оказываются сводными и во всем своем остальном хим. характере, а различие их физическихсвойств возрастает или вообще изменяется правильно по мере увеличения разницы в составе,определяемой числом n групп СН 2. Такие хим. сходственные соединения образуют так наз. гомологическийряд, атомный состав всех членов которого возможно выразить общею формулою в зависимости от составапервого члена ряда и числа атомов углерода; органические вещества одного названия типо алканы только. Изомеры- соединения имеющие одинаковый состав но разное строение и свойства. 8. Нуклеофильные и электрофильные реагенты. Участвующие в замещения реакциях реагенты подразделяются на нуклеофильные и электрофильные. Нуклеофильные реагенты, или нуклеофилы, предоставляют свою паруэлектронов на образование новой связи и вытесняют из молекулы RX уходящую группу (X) с парой электронов, образовывавшей старую связь, например: (где R — органический радикал). К нуклеофилам относятся отрицательно заряженные ионы (Hal-, ОН-, CN-, NO2-, OR-, RS-, NH2-, RCOO- и др.), нейтральные молекулы, обладающие свободной парой электронов (например, Н2О, NH3, R3N, R2S, R3P, ROH, RCOOH), и металлоорганич. соединения R — Me с достаточно поляризованной связью С — Me+, т. е. способные быть донорами карбанионов R-. Реакции с участием нуклеофилов (нуклеофильное замещение) характерны главным образом Для алифатических соединений, например гидролиз (ОН-, Н2О), алкоголиз (RO-, ROH), ацидолиз (RCOO-, RСООН), аминирование (NH-2, NH3, RNH2 и др.), цианирование (CN-) и т. д. Электрофильные реагенты, или электрофилы, при образовании новой связи служат акцепторами пары электронов и вытесняют уходящую группу в виде положительно заряженной частицы. К электрофилам относятся положительно заряженные ионы (например, Н+, NO2+), нейтральные молекулы с электронным дефицитом, например SO3, и сильно поляризованные молекулы (СН3СОО-Br+ и др.), причём поляризация особенно эффективно достигаетсякомплексообразованием с коэффициентами Льюиса (Hal+ — Hal- · А, R+ — Cl- · A, RCO+ — Cl- · А, где A= A1C13, SbCl5, BF3 и др.). К реакциям с участием электрофилов (электрофильное замещение) относятся важнейшие реакцииароматических углеводородов (например, нитрование, галогенирование, сульфирование, реакция Фриделя — Крафтса): 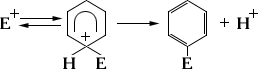 (E+ = Hal+, NO+2, RCO+, R+ и др.) В определённых системах реакции с участием нуклеофилов осуществляются в ароматическом ряду, а реакции с участием электрофилов — в алифатическом (чаще всего в ряду металлоорганических соединений). 53. взаимодействие оксосоединений с металлорганическими (кетон или альдегид плюс металорганика) Реакции широко используются для получения спиртов.при присоединении к формальдегиду реактива гриньяра(R-MgX) образуется первичный спирт, другим альдегидом вторичные, а кетонам тритичные спирты 9. Электронные смещения в насыщенных соединениях (индукционный эффект) и сопряженных системах(мезомерный эффект) 1. Полярность связи обусловлена неравномерным распределением электронной плотности–поляризацией. Полярность молекулы количественно оценивают величиной ее дипольного момента. Из дипольных моментов молекулы могут быть вычислены дипольные моменты отдельных связей. Чем больше дипольный момент, тем связь полярнее. Причиной полярности связи служит различие в электроотрицательности связанных атомов. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего эл. поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер. По поляризуемости пи-связь значительно превосходит сигма-связь, так как максимум электронной плотности пи-связи располагается дальше от связываемых ядер.
Мезомерный эффект — передача электронного влияния заместителей по сопряженной системе. При этом заместитель сам является участником сопряженной системы. Он может вносить в систему сопряжения пи-связь (карбонильная, карбоксильная и другие группы), неподеленную пару электронов гетероатома (галогены, амино- и гидроксигруппы), вакантную или заполненную одним или двумя электронами р-АО. Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М).Эти заместители способны к передаче пары электронов в общую сопряженную систему, т. е. являются электронодонорными. Заместители, понижающие (-М). -М-эффектом обладают ненасыщенные группировки и положительно заряженные атомы, т. е. электроноакцепторные заместители. Графически смещение электронной плотности обозначается изогнутыми стрелками, показывают, какие п- или пи-электроны смещаются и куда. (+М) передается по системе сопряженных связей на значительно большее расстояние. 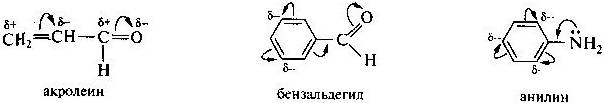 (скажешь:1- вправо,начинается с +, 2 – шестиугольник,по верху,минусы, 3-шестиугольник,по низу,минусы) 3.  (скажешь:таблица,Например: О плюс J , плюс М, электронодонорный,от алкильных групп до алкоксигрупп) 10. Классификация органических реакций по типу. Примеры. По характеру химических превращений различают реакции:
CH3-CH3 + Cl2 –(hv)---- CH3-CH2Cl + HCl C6H5CH3 + Cl2 ---500 C--- C6H5CH2Cl + HCl
Такие реакции характерны для органических соединений, содержащих кратные(двойные или тройные) связи. К реакциям этого типа относятся реакции присоединения галогенов, галогеноводородов и воды к алкенам и алкинам CH3-CH=CH2 + HCl ---- CH3-CH(Cl)-CH3
Это реакции, приводящие к образованию кратных связей. При отщеплении галогеноводородов и воды наблюдается определенная селективность реакции, описываемая правилом Зайцева, согласно которому атом водорода отщепляется от того атома углерода, при котором находится меньше атомов водорода. Пример реакции CH3-CH(Cl)-CH2-CH3 + KOH →CH3-CH=CH-CH3 + HCl
n(CH2=CHCl) (-CH2-CHCl)n
Наиболее интенсивная из окислительных реакций – это горение, реакция, характерная для всех классов органических соединений. При этом в зависимости от условий горения углерод окисляется до С (сажа), СО или СО2, а водород превращается в воду. Однако для химиков-органиков большой интерес представляют реакции окисления, проводимые в гораздо более мягких условиях, чем горение. Используемые окислители: растворы Br2 в воде или Cl2 в CCl4; KMnO4 в воде или разбавленной кислоте; оксид меди; свежеосажденные гидроксиды серебра (I) или меди(II). 3C2H2 + 8KMnO4 +4H2O→3HOOC-COOH + 8MnO2 + 8KOH
R1COOH + HOR2 H+ R1COOR2 + H2O
Y R Y—R ‖ + ‖ → ǀ ǀ R Y R—Y Y ‖ + → R 11. Классификация органических реакций по механизму. Примеры. Механизм реакции предполагает детальное постадийное описание химических реакций. При этом устанавливают, какие именно ковалентные связи разрываются, в каком порядке и каким путем. Столь же тщательно описывают образование новых связей в процессе реакции. Рассматривая механизм реакции, прежде всего обращают внимание на способ разрыва ковалентной связи в реагирующей молекуле. Таких способов два – гомолитический и гетеролитический. 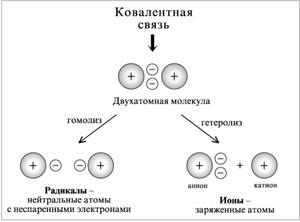 Радикальные реакции протекают путем гомолитического (радикального) разрыва ковалентной связи: 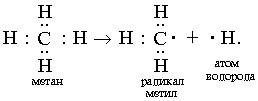 Радикальному разрыву подвергаются неполярные или малополярные ковалентные связи (С–С, N–N, С–Н) при высокой температуре или под действием света. Углерод в радикале СН3• имеет 7 внешних электронов (вместо устойчивой октетной оболочки в СН4). Радикалы неустойчивы, они стремятся захватить недостающий электрон (до пары или до октета). Один из способов образования устойчивых продуктов – димеризация (соединение двух радикалов): СН3 • + • СН3 Н • + • Н Радикальные реакции – это, например, реакции хлорирования, бромирования и нитрования алканов: 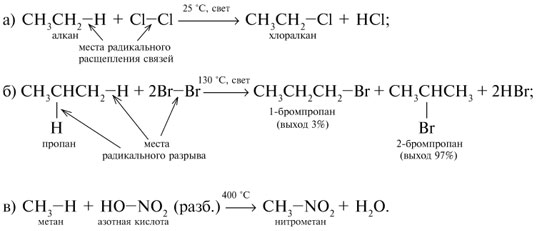 Ионные реакции протекают с гетеролитическим разрывом связи. При этом промежуточно образуются короткоживущие органические ионы – карбкатионы и карбанионы – с зарядом на атоме углерода. В ионных реакциях связывающая электронная пара не разъединяется, а целиком переходит к одному из атомов, превращая его в анион: 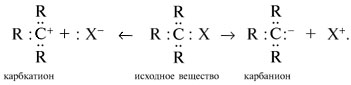 К гетеролитическому разрыву склонны сильно полярные (Н–O, С–О) и легко поляризуемые (С–Вr, С–I) связи. Различают нуклеофильные реакции (нуклеофил – ищущий ядро, место с недостатком электронов) и электрофильные реакции (электрофил – ищущий электроны). Утверждение, что та или иная реакция является нуклеофильной или электрофильной, условно всегда относится к реагенту. Реагент – участвующее в реакции вещество с более простой структурой. Субстрат – исходное вещество с более сложной структурой. Уходящая группа – это замещаемый ион, который был связан с углеродом. Продукт реакции – новое углеродсодержащее вещество (записывается в правой части уравнения реакции). К нуклеофильным реагентам (нуклеофилам) относят отрицательно заряженные ионы, соединения с неподеленными парами электронов, соединения с двойными углерод-углеродными связями. К электрофильным реагентам (электрофилам) относят положительно заряженные ионы, соединения с незаполненными электронными оболочками (АlCl3, ВF3, FeCl3), cоединения с карбонильными группами, галогены. Электрофилы – любые атом, молекула или ион, способные присоединить пару электронов в процессе образования новой связи. Движущая сила ионных реакций – взаимодействие противоположно заряженных ионов или фрагментов разных молекул с частичным зарядом ( Примеры ионных реакций разных типов. Нуклеофильное замещение: 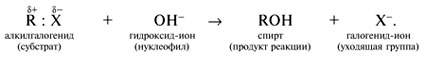 Электрофильное замещение: 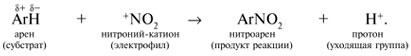 Нуклеофильное присоединение(сначала присоединяется CN–, потом Н+): 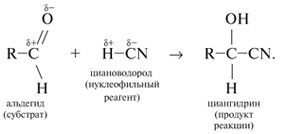 Электрофильное присоединение(сначала присоединяется Н+, потом Х–):  Элиминирование при действии нуклеофилов (оснований):  Элиминирование при действииэлектрофилов (кислот): 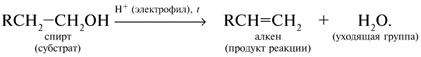 12. Алканы. Изомерия, номенклатура, природные источники и методы получения. Химические свойства алканов. Механизм реакции галогенирования, сульфохлорирования, нитрования. Простейшими органическими соединениями являются углеводороды, состоящие из углерода и водорода. В зависимости от характера химических связей в углеводородах и соотношения между углеродом и водородом они подразделяются на предельные и непредельные (алкены, алкины и др.) Предельными углеводородами (алканами, углеводородами метанового ряда) называются соединения углерода с водородом, в молекулах которых каждый атом углерода затрачивает на соединение с любым другим соседним атомом не более одной валентности, причем, все не затраченные на соединение с углеродом валентности насыщены водородом. Все атомы углерода в алканах находятся в sp3 - состоянии. Предельные углеводороды образуют гомологический ряд, характеризующийся общей формулой СnН2n+2. Родоначальником этого ряда является метан. Изомерия. Номенклатура. Алканы с n=1,2,3 могут существовать только в виде одного изомера 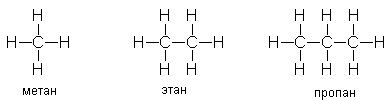 Начиная с n=4, появляется явление структурной изомерии. 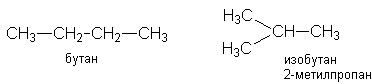 Число структурных изомеров алканов быстро растет с увеличением числа углеродных атомов, например, пентан имеет 3 изомера, гептан - 9 и т.д. Число изомеров алканов увеличивается и за счет возможных стереоизомеров. Начиная с C7Н16 возможно существование хиральных молекул, которые образуют два энантиомера. Номенклатура алканов. Доминирующей номенклатурой является номенклатура IUPAC. В тоже время в ней присутствуют элементы тривиальных названий. Так, первые четыре члена гомологического ряда алканов имеют тривиальные названия. СН4 - метан С2Н6 - этан С3Н8 - пропан С4Н10 - бутан. Названия остальных гомологов образованы от греческих латинских числительных. Так, для следующих членов ряда нормального (неразветвленного) строения используются названия: С5Н12 - пентан, С6Н14 - гексан, С7Н18 - гептан, С8Н18 - октан, С9Н20 - нонан, С10Н22 - декан, С11Н24 - ундекан, С12Н26 - додекан, С13Н28 - тридекан, С14Н30 - тетрадекан, С15Н32 - пентадекан и т.д. Основные правила IUPAC для разветвленных алканов а) выбирают наиболее длинную неразветвленную цепь, название которой составляет основу (корень). К этой основе прибавляют суффикс “ан” б) нумеруют эту цепь по принципу наименьших локантов, в) заместитель указывают в виде префиксов в алфавитном порядке с указанием места нахождения. Если при родоначальной структуре находятся несколько одинаковых заместителей, то их количество указывают греческими числительными. В зависимости от числа других углеродных атомов, с которыми непосредственно связан рассматриваемый углеродный атом, различают: первичные, вторичные, третичные и четвертичные углеродные атомы. 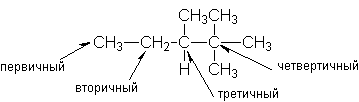 Пример: 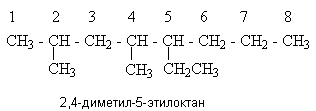 В качестве заместителей в разветвленных алканах фигурируют алкильные группы или алкильные радикалы, которые рассматриваются как результат отщепления от молекулы алкана одного водородного атома. Название алкильных групп образуют от названия соответствующих алканов путем замены последних суффикса “ан” на суффикс “ил”. СН3 - метил СН3СН2 - этил СН3СН2СН2 - пропил 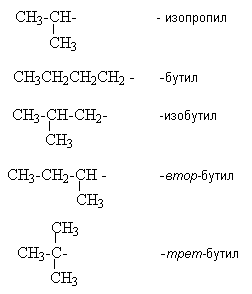 Для названия разветвленных алкильных групп используют также нумерацию цепи: 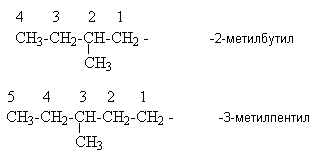 Начиная с этана, алканы способны образовывать конформеры, которым соответствует заторможенная конформация. Возможность перехода одной заторможенной конформации в другую через заслоненную определяется барьером вращения. Определение структуры, состава конформеров и барьеров вращения являются задачами конформационного анализа. Методы получения алканов. 1. Фракционная перегонка природного газа или бензиновой фракции нефти. Таким способом можно выделять индивидуальные алканы до 11 углеродных атомов. 2. Гидрирование угля. Процесс проводят в присутствии катализаторов (оксиды и сульфиды молибдена, вольфрама, никеля) при 450-470оС и давлениях до 30 Мпа. Уголь и катализатор растирают в порошок и в суспензированном виде гидрируют, борботируя водород через суспензию. Получающиеся смеси алканов и циклоалканов используют в качестве моторного топлива. 3. Гидрирование СО и СО2. СО + Н2 алканы СО2 + Н2 алканы В качестве катализаторов этих реакций используют Со, Fe, и др. d - элементы. 4. Гидрирование алкенов и алкинов. 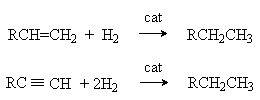 В качестве катализаторов используют Ni, Pt, Pd. 5. Металлоорганический синтез. а). Синтез Вюрца. 2RHal + 2Na R R + 2NaHal Этот синтез малопригоден, если в качестве органических реагентов используют два разных галогеналкана. б). Протолиз реактивов Гриньяра. R Hal + Mg RMgHal RMgHal + HOH RH + Mg(OH)Hal в). Взаимодействие диалкилкупратов лития (LiR2Cu) с алкилгалогенидами LiR2Cu + R X R R + RCu + LiX Сами диалкилкупраты лития получают двухстадийным способом 2R Li + CuI LiR2Cu + LiI 6. Электролиз солей карбоновых кислот (синтез Кольбе). 2RCOONa + 2H2O R R + 2CO2 + 2NaOH + H2 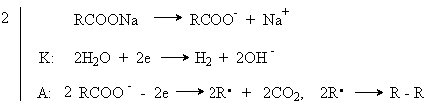 7. Сплавление солей карбоновых кислот со щелочами. 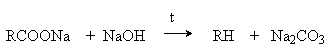 Реакция используется для синтеза низших алканов. 8. Гидрогенолиз карбонильных соединений и галогеналканов. а). Карбонильные соединения. Синтез Клемменса. 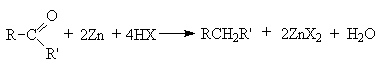 б). Галогеналканы. Каталитический гидрогенолиз. В качестве катализаторов используют Ni, Pt, Pd. в) Галогеналканы. Реагентное восстановление. RHal + 2HI RH + HHal + I2 Химические свойства алканов. Все связи в алканах малополярные, по этому для них характерны радикальные реакции. Отсутствие пи-связей делает невозможными реакции присоединения. Для алканов характерны реакции замещения , отщепления, горения.
|