1-12органика. Электронное сторение атома с в основном, в возбужденным состоянии, карбоанионная, карбокатионная. Тетраэдическая можель атома С
 Скачать 378.33 Kb. Скачать 378.33 Kb.
|
|
Механиз реакции галогенирования: Галогенирование Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования. Галогенирование — это одна из реакций замещения. Галогенирование алканов подчиняется правилу Марковника (Правила Марковникова) — в первую очередь галогенируется наименее гидрированый атом углерода. Галогенирование алканов проходит поэтапно — за один этап галогенируется не более одного атома водорода. CH4 + Cl2 → CH3Cl + HCl (хлорметан) CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан) CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан) CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан). Под действием света молекула хлора распадается на атомы, затем они атакуют молекулы метана, отрывая у них атом водорода, в результате этого образуются метильные радикалы СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы. Нитрование (Реакция Коновалова) Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова. RH + HNO3 = RNO2 + H2O т. е. один из атомов водорода заменяется на остаток NO2 (ни-трогруппа) и выделяется вода. Особенности строения изомеров сильно отражаются на течении этой реакции, так как легче всего она ведет к замещению на нитрогруппу атома водорода в остатке СИ (имеющемся лишь в некоторых изомерах), менее легко замещается водород в группе СН2 и еще труднее — в остатке СН3. Парафины довольно легко нитруются в газовой фазе при 150—475° С двуокисью азота или парами азотной кислоты; при этом происходит частично и. окисление. Нитрованием метана получается почти исключительно нитрометан: Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов. Азотная кислота при обыкновенной температуре почти не действует на парафиновые углеводороды. При нагревании же действует главным образом как окислитель. Однако, как нашел М. И. Коновалов (1889), при нагревании азотная кислота действует отчасти и «нитрующим» образом; особенно хорошо идет реакция нитрования со слабой азотной кислотой при нагревании и повышенном давлении. Реакция нитрования выражается уравнением. Последующие за метаном гомологи дают смесь различных нитропарафинов вследствие попутно идущего расщепления. При нитровании этана получаются нитроэтан СН3—СН2—NO2 и нитрометан СН3—NO2. Из пропана образуется смесь нитропарафинов: Нитрование парафинов в газовой фазе теперь осуществляется в промышленном масштабе. Сульфахлорирование : Важной в практическом отношении реакцией является сульфохлорирование алканов. При взаимодействии алкана с хлором и сернистым ангидридом при облучении происходит замещение водорода на хлорсульфонильную группу: 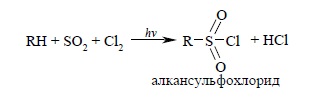 Стадии этой реакции: Cl:Cl→2Cl• Cl•+R:H→R•+HCl R•+SO2→RSO2• RSO2•+ Cl:Cl→RSO2Cl+Cl• Алкансульфохлориды легко гидролизуются до алкансульфоксилост (RSO2OH),натриевые соли которых (RSO3¯ Na+ - алкансульфонат натрия) проявляют свойства ,подобные мылам, и применяются в качестве детерагентов. |
