1-12органика. Электронное сторение атома с в основном, в возбужденным состоянии, карбоанионная, карбокатионная. Тетраэдическая можель атома С
 Скачать 378.33 Kb. Скачать 378.33 Kb.
|
|
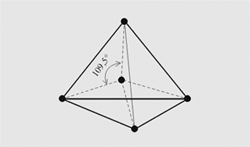
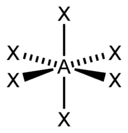
1.Электронное сторение атома С в основном, в возбужденным состоянии, карбоанионная, карбокатионная. Тетраэдическая можель атома С Электронное состояние атома, в котором соблюдается порядок заполнения электронных орбиталей: 1s2, 2s2, 2p2, 3s2, 3p2, 4s2, 3d2, 4p2 и т.д., называют основным состоянием. В возбужденном состоянии один из валентных электронов атома занимает свободную орбиталь с более высокой энергией, такой переход сопровождается разъединением спаренных электронов. Схематически это записывают так: 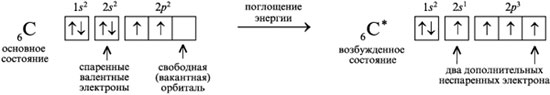 Тогда как в основном состоянии было только два валентных неспаренных электрона, то в возбужденном состоянии таких электронов становится четыре. Карбокатионы, или карбениевые ионы представляют собой интермедиаты, у которых атом углерода имеет три ковалентные связи и положительный заряд R3C+ Ковалентные связи, образованные за счет sp2 орбиталей расположены в одной плоскости под углом 1200 , т.е. карбокатионы являются плоскими частицами. Химические свойства: 1.Взаимодействие с нуклеофилами. 2.Способность к β-элиминированию — отщеплению протона с образованием кратной связи. 3.Перегруппировка в более стабильный карбкатион — изомеризация первичного в более стабильный вторичный или третичный карбкатион. Карбанионами называют интермедиаты, в которых атом углерода трехковалентен и несет отрицательный заряд за счет наличия неподеленной электронной пары. Карбанион имеет пирамидальное строение с углами между связями и p-орбиталью близкими к 1090. Карбанионные центры могут находится в состоянии sp3-гибридизации (например, Cl3C-), промежуточном состоянии между sp3 и sp2-гибридизациями (например, венолят-анионах) и sp1-гибридизации (в ацетиленидах R-С≡C-). Химические свойства 1.Взаимодействие с электрофилами. 2.Окисление до радикалов. Тетраэдрическую модель атома углерода иногда называют моделью Вант-Гоффа - Ле Беля. Тетраэдрическую модель атома углерода 4, где одинаковые четыре Связи направлены к углам тетраэдра, центр которого занят самим углеродным атомом. То есть в молекуле метана СН4 все углы между связями С–Н равны 109°28'. Этот угол носит очень распространенное название – тетраэдрический угол. Такой угол получается, если соединить центр тяжести тетраэдра (правильная треугольная пирамида с основанием и тремя гранями из равносторонних одинаковых треугольников) с его вершинами.
Геометрическая изомерия (цис- и транс-изомерия). Этот вид изомерии требует пространственного распределения частиц. Подобно тому как для объяснения изомерии в органической химии Вант-Гофф построил тетраэдрическую модель молекулы, где в центре тетраэдра располагаетсяатом углерода, а в вершинах — связанные с ним группы. 2.Основные положения теории химического строения А.М. Бутлерова и ее значение для развития органической химии Теория хим. строения объясняет многообразие органических соединений. Оно обусловлено способностью четырехвалентного углерода образовывать углеродные цепи и кольца, соединятся с атомами других элементов и наличием изомерии химического строения органических соединений. Основное положение теории строения: 1) в молекулах атомы соединены друг с другом в определенной последоватльности в соответсвии их валентностью. Порядок связи атомов называется химическим строением . 2)Свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т.е от хим.строения. 3)Атомы или группы атомов, образующие молекулу взаимно влияют друг на друга Химические формулы, в которым изображены порядок соединения атомов в молекулах называется структурными формулами. Значение теории химического строения А.М. Бутлерова:1) Является важнейшей частью теоретического фундамента органической химии. 2)По значимости можно сопоставить с таб. Менделеева . 3) Дала возможность систематизировать молекул. 3. Типы гибридизации орбиталей атомов углерода (sp3-, sp2-, sp- гибритизация). Гибридизация – выравнивание (смешивание) атомных орбиталей (s и р) с образованием новых атомных орбиталей, называемых гибридными орбиталями. Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако – это область пространства, в которой с высокой вероятностью может быть обнаружен электрон sp-гибридизация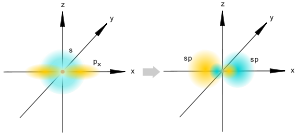 Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов. sp2-гибридизация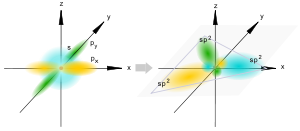 Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей sp2-гибридизация Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)
4. Электровалентная, ковалентная, донорно-акцепторная, водородная связи. Электронное строение σ и π связи. Основные характеристики ковалентной связи: энергия связи, длина, валентный угол, полярность, поляризуемость. Если между двумя атомами или двумя группами атомов имеет место электростатическое взаимодействие приводящее к сильному притяжению и образованию химической связи, то такая связь называется электровалентной или гетерополярной. Ковалентная связь-химическая связь, образованная перекрытием пары валентных электронных облаков. Обепечивающие связь электронные облака называется общей электронной парой. Донорно-акцепторная связь –это химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Это связь отличается от ковалентной связи происхождением связи электронов. Водородная связь-это вид химического взаимодейсвия атомов в молекуле отличающийся тем, что существенное участие в нем принимает атом водорода, уже связанный ковалентной связью с другими атомами σ связь-это первая и более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющий центры атомов. σ связь-это обычные ковалентные связи атомов углерода с атомами водорода. Молекулы предельных углеродов содержат только σ связи. π связь это менее прочная связь, которая образуется при перекрывании электронных плоскости атомов ядер Электроны π и σ связи теряют свою принадлежность к определенному атому. Особенности σ и π связи: 1)вращение атомов углерода в молекуле возможна в случае, если они соединены σ связью 2)появление π связи лишает атома углерода в молекуле в свободного вращения. Длина связи-это расстояние между центрами связанных атомов. Валентный угол-это угол между двумя связями, имеющий общий атом. Энергия связи-энергия, выделяющаяся при образовании хим. связи и характеризующаяся ее прочность Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам. 5. Ионная связь (электровалентная)— очень прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Ковалентная связь – возникает за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону. Донорно акцепторная связь (координационная связь) химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).пример NH4 Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную. При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или p-типу. σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т. е. при осевом перекрывании АО) . π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов. 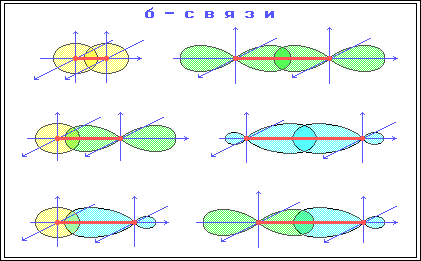 π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО. 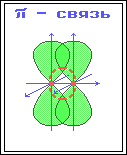 Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. 1.σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. 2.По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)) . Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! 3.Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи. Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными. Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей. Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождаядипольный момент молекулы). Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам. Электроны тем подвижнее, чем дальше они находятся от ядер. 6.Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. Для медицины знание общих правил номенклатуры имеет особенно большое значение, так как в соответствии с ними строятся названия многочисленных лекарственных средств. В настоящее время общепринята систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии)*. Однако до сих пор сохраняются и широко применяются (особенно в медицине) тривиальные (обыденные) и полутривиальные названия, использовавшиеся еще до того, как становилось известным строение вещества. В этих названиях могут отражаться природные источники и способы получения, особо заметные свойства и области применения. Например, лактоза (молочный сахар) выделена из молока (от лат. lactum - молоко), пальмитиновая кислота - из пальмового масла, пировиноградная кислота получена при пиролизе виноградной кислоты, в названии глицерина отражен его сладкий вкус (от греч. glykys - сладкий).
|