Эмульсия. Эмульсии. Классификация эмульсий. Методы определения типа эмульсий. Устойчивость и обращение фаз в эмульсиях
 Скачать 282.9 Kb. Скачать 282.9 Kb.
|
|
Эмульсии. Классификация эмульсий. Методы определения типа эмульсий. Устойчивость и обращение фаз в эмульсиях. Эмульсия — дисперсная система, состоящая из микроскопических капель жидкости (дисперсной фазы), распределенных в другой жидкости (дисперсионной среде). Эмульсия – микрогетерогенная система, состоящая из взаимно нерастворимых жидкостей, распределенных одна в другой в виде капель. Эмульсиями называют микрогетерогенные системы, у которых дисперсная фаза и дисперсионная среда представляют собой несмешивающиеся жидкости. Поэтому вещества, образующие различные фазы, должны сильно различаться по своей полярности. Практический интерес и наибольшее распространение получили эмульсии, в которых одна из фаз – вода. В этих случаях вторую фазу представляет неполярная или малополярная жидкость, называемая в общем случае маслом (пример: бензол, толуол, хлороформ, керосин, растительные масла и т.п.). Различают два основных типа эмульсий: если вода дисперсионная среда, то это дисперсии масла в воде (м/в) и дисперсии воды в масле (в/м). Эмульсии первого типа называют прямыми, а второго типа – обратными. Эмульсии — это дисперсные системы, состоящие из двух (или нескольких) жидких фаз. Условие образования эмульсий — практически полная или частичная нерастворимость дисперсной фазы в среде. Практический интерес и наибольшее распространение получили эмульсии, в которых одна из фаз — вода. В этих случаях другую фазу представляет органическая жидкость (например: бензол, хлороформ, растительные, минеральные масла), называемая в общем случае маслом. В зависимости от того, какая жидкость диспергирована, а какая является непрерывной фазой (дисперсионной средой), различают два вида эмульсий: I-го типа или прямые — "масло в воде" (м/в) и II-го типа или обратные — "вода в масле" (в/м). Тип эмульсии можно определить по свойствам дисперсионной среды. Например, прямые эмульсии смешиваются с водой или другими полярными жидкостями; при добавлении в них водорастворимого красителя окрашивается только дисперсионная среда; они имеют высокую электропроводность и плохо смачивают гидрофобные поверхности. Обратные эмульсии обладают противоположными свойствами. Также эмульсии разделяются на лиофильные и лиофобные: Лиофильные эмульсии образуются самопроизвольно и термодинамически устойчивы. К ним относятся т. н. критические эмульсии, образующиеся вблизи критической температуры смешения двух жидких фаз, а также некоторые смазочно-охлаждающие жидкости. Лиофобные эмульсии возникают при механическом, акустическом или электрическом эмульгировании (диспергировании), а также вследствие конденсационного образования капель дисперсной фазы в перенасыщенных растворах или расплавах. Они термодинамически неустойчивы и длительно существуют лишь в присутствии эмульгаторов — веществ, облегчающих диспергирование и препятствующих коалесценции (слиянию). Классификация эмульсий В зависимости от концентрации дисперсной фазы Сd, эмульсии подразделяют на три класса: разбавленные (Сd не превышает 0.1 %); концентрированные (Сd < 74 %) и высококонцентрированные (Сd > 74 %). Граница между двумя последними классами определяется тем, что частицы дисперсной фазы могут сохранять сферическую форму вплоть до объемной доли, соответствующей плотнейшей упаковке шаров (74 %). Поэтому увеличение Сd характерное для высококонцентрированных эмульсий, неизбежно связано с деформацией фазы, приводящей к появлению новых свойств. Граница между последними классами определяется тем, что при массовой доле дисперсной фазы до 74% частицы эмульсий сохраняют сферическую форму. В высококонцентрированных эмульсиях частицы деформируются, что приводит к появлению новых свойств эмульсий. Получают эмульсии главным образом путем механического диспергирования (встряхиванием, энергичным перемешиванием, воздействием ультразвука), а также выдавливания вещества дисперсной фазы через тонкие отверстия в дисперсионную среду под большим давлением. Условия, необходимые для образования эмульсий: 1. Обе жидкости, образующие эмульсию, должны быть нерастворимы или мало растворимы друг в друге. 2. В системе должен присутствовать стабилизатор, который в этом случае называют эмульгатором. Вещества, стабилизирующие эмульсию, называются эмульгаторами. Определение типа эмульсии Для всех практических целей весьма важно знать – какой тип эмульсии (м/в) или (в/м) образуется при совместном диспергировании масла и воды. На практике тип эмульсии определяют следующими методами: 1. Метод окрашивания. К системе добавляется небольшое количество красителя, избирательно растворимого в одной фазе (например, жирорастворимый краситель Судан-3 красного цвета). Тогда под микроскопом можно видеть либо красные капли на белом фоне (м/в), либо наоборот, красный фон (в/м). 2. Метод электропроводности. Высокие значения электропроводности указывают на то, что дисперсионной средой является полярная жидкость (вода), а эмульсия относится к типу м/в. Малые значения электропроводности показывают на образование обратной эмульсии (типа в/м). 3. По методу разбавления каплю эмульсии вносят в пробирку с водой. Если капля равномерно распределяется в воде, – это эмульсия м/в. Капля эмульсии в/м диспергироваться в воде не будет. 4. О типе эмульсии можно судить также по смачиванию пластинки гидрофобного вещества (парафина). Прямые эмульсии не смачивают подложку, а обратные смачивают. 5. Метод слияния капель. Каплю эмульсии и каплю воды помещают на предметное стекло и стекло наклоняют так, чтобы капли пришли в соприкосновение. Если капли сольются, то дисперсной фазой является вода, если не сольются – масло. 6. На фильтровальную бумагу наносят каплю эмульсии. Если средой является вода, то капля сразу всасывается бумагой, на которой остается жирное пятно. Капля эмульсии в/м не всасывается. В заключение следует сказать несколько слов о разрушении эмульсий. К расслоению системы приводит часто механическое воздействие. Используют методы вытеснения эмульгатора веществом, обладающим большей поверхностной активностью, но меньшей способностью к образованию структурированных слоев, а также все способы, применяемые для коагуляции – увеличение концентрации электролита, дегидратации, вымораживание, электрофоретическое выделение дисперсной фазы. Задача разрушения эмульсий приобретает в настоящее время особую важность в связи с проблемой очистки сточных вод. Агрегативная устойчивость эмульсии и природа эмульгатора Эмульсии, как и все коллоидные системы, агрегативно неустойчивы из-за избытка свободной энергии на межфазной поверхности. Агрегативная неустойчивость эмульсий проявляется в самопроизвольном образовании агрегатов капелек с последующим слиянием (коалесценцией) отдельных капелек друг с другом. В пределе это может приводить к полному разрушению эмульсии и разделению ее на два слоя. Агрегативную устойчивость эмульсий характеризуют либо скоростью расслаивания эмульсии, либо продолжительностью существования (временем жизни) остальных капелек в контакте друг с другом или с межфазной поверхностью. На агрегативную устойчивость эмульсий сильнее всего влияют природа и концентрация эмульгатора. С термодинамической точки зрения эмульгатор, адсорбируясь на межфазной границе, понижает межфазное поверхностное натяжение. Другое объяснение заключается в том, что при наличии стабилизатора на границе раздела фаз между капельками возникают силы отталкивания (энергетический барьер). Повышение в известных пределах концентрации эмульгатора в системе способствует устойчивости эмульсии. Природа эмульгатора определяет не только устойчивость, но и тип эмульсии. Опыт показывает, что гидрофильные эмульгаторы, лучше растворимые в воде, чем в углеводородах, способствуют образованию эмульсии типа м/в, а гидрофобные эмульгаторы, лучше растворимые углеводородах, – эмульсий типа в/м (правило Банкрофта). Это вполне понятно, так как эмульгатор препятствует слипанию, или коалесценции, капелек только тогда, когда он находится у поверхности с наружной стороны капельки, т.е. лучше растворяется в дисперсионной среде. Таким образом, для объяснения влияния эмульгатора на тип эмульсии, несомненным и вполне однозначным является факт стабилизации прямых эмульсий гидрофильными веществами, обратных – гидрофобными. Итак, дисперсионной средой эмульсии становится жидкость, лучше взаимодействующая с эмульгатором. В качестве эмульгаторов могут применяться самые различные по природе вещества: поверхностно-активные вещества, молекулы которых содержат ионогенные полярные группы (мыла в широком смысле слова), неионогенные поверхностно-активные вещества, высокомолекулярные соединения. Эмульгирующей способностью обладают даже порошки. Наиболее распространенными поверхностно-активными эмульгаторами являются мыла – соли жирных кислот, содержащие 12-18 углеродных атомов в молекуле (олеаты, стеараты и др.). Адсорбируясь на границе между маслом и водой, они снижают поверхностное натяжение между фазами и несколько увеличивают устойчивость системы. Однако это обстоятельство играет в стабилизации лишь подсобную роль. Гидрофильная часть дифильной молекулы эмульгатора связывается с водой, а гидрофобная – с маслом. На рис. 6.1 молекула эмульгатора изображена в виде черточки (гидрофобная часть) с кружком на одном конце (гидрофильная часть). Щелочные мыла (соли одновалентных металлов), растворимые в воде, стабилизируют прямые эмульсии (м/в); соли двух- и трехвалентных металлов являются эмульгаторами обратных эмульсий (в/м). Молекулы щелочного мыла лучше взаимодействуют с водой и, адсорбируясь на капельках масла, создают на их наружной поверхности достаточно толстый адсорбционно-сольватный слой, препятствующий соприкосновению и слиянию капелек масла. Кроме того, за счет диссоциации полярных групп эмульгатора возникает ДЭС, также являющийся фактором стабилизации (рис. 6.1-а). Щелочноземельные мыла, растворимые в масле, образуют толстый адсорбционно-сольватный слой на наружной поверхности капелек воды, защищая их от слияния (рис. 6.1-б). 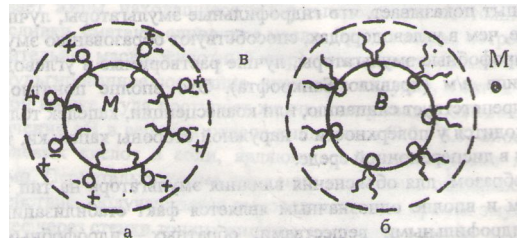 Рис.6.1 Стабилизация эмульсий ПАВ: а) схема стабилизации капельки масла щелочным мылом RCOONa; б) схема стабилизации капельки воды щелочноземельным мылом (RCOO)2Mg Таким образом, стабилизирующие действия эмульгатора заключаются не только и не столько в снижении поверхностного натяжения на межфазной границе, сколько в образовании структурно-механического барьера, обеспечивающего устойчивость эмульсии. Это общее положение хорошо подтверждается при рассмотрении действия так называемых твердых эмульгаторов. Твердыми эмульгаторами могут служить достаточно высокодисперсные порошки, способные смачиваться как полярной (вода), так и неполярной (масло) жидкостями. При встряхивании полярной жидкости с неполярной в присутствии твердого эмульгатора его частицы собираются на межфазной границе, образуя прочную, пространственную коагуляционную структуру, препятствующую коалесценции. При этом порошки лучше стабилизируют ту фазу, которая хуже смачивается. Если порошок гидрофильный, то есть лучше смачивается водой (оксиды и гидроксиды металлов, силикаты, карбонаты, сульфаты, глина, мел), то они закрепляются со стороны воды. Защитный слой у прямой эмульсии образуется со стороны дисперсной фазы. Такая броня лучше стабилизирует эмульсию м/в. Устойчивое положение частиц на границе между водой и маслом экранирует дисперсную фазу и противостоит процессу коалесценции, что обеспечивает устойчивость эмульсии. Гидрофобные порошки, которые не смачиваются водой (сажа, металлы и их сульфиды, парафины, стеарины, фторопласты), лучше смачиваются неполярными растворителями (маслом). Поэтому расположение таких частиц будет обратным: в прямых эмульсиях частицы порошка находятся в дисперсной фазе, а в обратных – в дисперсионной среде. Следовательно, гидрофобные порошки лучше стабилизируют эмульсию в/м. Явление – обращение фаз эмульсии При определенных условиях можно превратить прямую эмульсию в обратную и наоборот, т.е. произвести обращение фаз эмульсии. Достаточно прибавить к прямой эмульсии, стабилизированной стеаратом натрия, раствор CaCl2 и сильно встряхнуть, чтобы получить обратную эмульсию. Причина обращения – изменение природы эмульгатора в результате реакции ионного обмена. Образующийся стеарат кальция нерастворим в воде, слабо гидратирован и не образует за защитного барьера в водной среде. Кальциевое мыло значительно больше растворимо в масле, чем в воде. Эмульсии седиментационно неустойчивы. Если фаза и среда отличаются по плотности, то возможны или оседание, или всплывание капелек дисперсной фазы, т. е. нарушение равномерности распределения дисперсной фазы в дисперсионной среде. Агрегативная неустойчивость эмульсий проявляется в самопроизвольном слиянии капель дисперсной фазы — коалесценции. Этот процесс приводит к разрушению эмульсии и разделению ее на два жидких слоя. Для оценки относительной устойчивости эмульсий выбирают либо время жизни отдельной капли в контакте с другими каплями, либо скорость расслоения эмульсий на фазы. Чаще пользуются второй характеристикой. Ее определяют, измеряя высоту (объем) отслоившейся фазы через определенный промежуток времени. Например, через 5 секунд высота столба отслоившейся фазы была 2.5 см, тогда скорость разделения фаз U = 0.5 см/с. Используя эту характеристику, можно определить "время жизни" (τ) эмульсии, τ = h / U, где h — высота столба эмульсии. Допустим, высота столба эмульсии (h) была 20 см. При скорости расслоения фаз U = 0.5 см/с, "время жизни" эмульсии τ = 20 / 0.5 = 40 с. Достаточно высокой агрегативной устойчивостью обладают только разбавленные эмульсии, поскольку в них невелика вероятность столкновения капель дисперсной фазы. Также мала и поверхность раздела фаз, а следовательно, и поверхностная энергия. Увеличение содержания дисперсной фазы приводит к увеличению поверхности раздела фаз и к резкому возрастанию поверхностной энергии, которую система стремится уменьшить за счет коалесценции капель. Особенно быстро коалесценция протекает в концентрированных и высококонцентрированных эмульсиях. Такие эмульсии могут быть агрегативно устойчивами только в присутствии стабилизаторов: ПАВ, ВМС, порошков, которые или снижают поверхностное натяжение на межфазной границе, или создают препятствие слиянию капель. По отношению к эмульсиям стабилизаторы называются эмульгаторами. Стабилизация эмульсий поверхностно-активными ве ществами При введении в эмульсии поверхностно-активных веществ возникают следующие факторы устойчивости: электростатический, адсорбционносольватный и структурно-механический. Рассмотрим, например, что происходит при добавлении в прямую эмульсию некоторого количества ионогенного ПАВ — олеата натрия. Олеат натрия диссоциирует на олеат-анион и катион Na+. Олеат-анион имеет дифильную структуру: его гидрофильная ионизированная карбоксильная группа хорошо взаимодействует с водой, а гидрофобный углеводородный радикал — с маслом. Олеат-ионы адсорбируются на поверхности капель масла таким образом, что отрицательно заряженные карбоксильные группы ориентированы в сторону полярной среды, а углеводородные радикалы — в сторону неполярной фазы — внутрь капель масла (рис. 6.1, а). За счет адсорбции поверхностно-активных анионов снижается межфазное поверхностное натяжение, полярные группы вместе с гидратирующими их молекулами воды создают на поверхности капель масла адсорбционно-сольватные слои — возникает адсорбционно-сольватный фактор. Отрицательно заряженные карбоксильные группы эмульгатора и катионы натрия образуют на поверхности капель масла двойной электрический слой с определенным -потенциалом — возникает электростатический фактор. В данном случае основным стабилизирующим фактором является именно электростатический. Олеат-ионы создают еще и структурномеханический фактор, так как за счет боковых гидрофобных взаимодействий они образуют на границе раздела фаз структурированные слои из углеводородных радикалов, обладающие прочностью и упругостью. Растворимые в воде эмульгаторы, подобные олеату натрия, стабилизируют эмульсии масла в воде, т. е. прямые. Если же эмульгаторы лучше растворимы в масле, например, соли высших жирных кислот и щелочноземельных металлов, то они будут стабилизировать обратные эмульсии. В этом случае недиссоциирующие молекулы стабилизаторов адсорбируются на поверхности капелек воды. Их полярные группы обращены в сторону воды, а гидрофобные неполярные углеводородные радикалы — в масло (рис. 6.1, б). На наружной поверхности капель образуются адсорбционно-сольватные слои, снижающие поверхностное натяжение (адсорбционно-сольватный фактор), и обладающие прочностью и упругостью (структурномеханический фактор). Однако, в этом случае основным является энтропийный фактор, так как сближение капель вызывает уменьшение числа свободных конформаций углеводородных радикалов, направленных в дисперсионную среду и участвующих в молекулярно-кинетическом движении. Это должно приводить к уменьшению энтропии, что невыгодно для системы. В результате действия энтропийного фактора капли эмульсии стремятся равномерно распределиться по всему объему дисперсной системы и вероятность коалесценции их уменьшается. Таким образом, олеат натрия стабилизирует эмульсии М/В, а олеат кальция — эмульсии В/М. Оказывается, что вообще тип образующейся эмульсии определяется природой эмульгатора. Эмульгаторы, лучше растворяющиеся, в воде (гидрофильные) дают прямые эмульсии, а лучше растворимые в масле (гидрофобные или липофильные, от греческого "липос" — жир) - обратные. Такая характеристика стабилизирующей способности ПАВ весьма приблизительна. Оценить ее более точно можно, используя в качестве характеристики стабилизирующей способности числа гидрофильно-липофильного баланса (ГЛБ). ГЛБ — это величина, характеризующая соотношение гидрофильных и липофильных свойств полярной и неполярной частей молекулы ПАВ. Обращение фаз эмульсий При определенных условиях можно превратить прямую эмульсию в обратную. Это явление называется обращением фаз эмульсии. Обращение фаз может происходить при изменении характера эмульгатора, например, при химическом превращении. Так, если в эмульсию, стабилизированную олеатом калия, добавить хлорид кальция, то в результате обменной реакции 2C17H33COOK + CaCl2 (C17H33COO)2Ca + 2KCl гидрофильный эмульгатор с ГЛБ = 20 превратится в гидрофобный с ГЛБ = 4.3. Вследствие этого произойдет обращение фаз — масло станет дисперсионной средой, а вода дисперсной фазой. Идею обращения фаз используют в некоторых современных представлениях о биологических мембранах, как о твердофазных эмульсиях, изменяющих в процессе обмена веществ свой тип и проницаемых либо для водорастворимых веществ, либо для веществ, растворимых в липидах. |
