Эпигенетика при ожирении и СД 2 типа. Эпигенетика при ожирении и сд2т. Эпигенетика при ожирении человека и диабете ii типа
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
|
Министерство образования и науки РФ «Пятигорский медико-фармацевтический институт»- филиал ФГБОУ ВО ВолгГМУ РЕФЕРАТ на тему: «Эпигенетика при ожирении человека и диабете II типа» Выполнила работу: студентка 401 группы лечебного факультета Петрова В.И Пятигорск, 2021-2022 учебный год Эпигенетика- область генетики, изучающая механизмы наследственности и изменчивости, в основе которых НЕ лежит изменение первичной последовательности ДНК и РНК. (С.Г. Инге-Вечтомов 2004 г.). Примерами эпигенетических изменений являются: • метилирование ДНК, • деацетилирование гистонов • геномный импринтинг, • инактивация X-хромосомы, • эффект положения, а также другие механизмы регуляции экспрессии генов Эпигенетические изменения ДНК Метилирование ДНК(по цитозину) производит фермент ДНК-метил-трансфераза. Метилирование ДНК и гистонов подавляет транскрипцию генов. Ацетилирование гистонов, осуществляемое ацетилтрансферазами, наоборот, облегчает начало транскрипцию, т.к. уменьшает степень упаковки нуклеосом. Эпигенетические механизмы контролируют активность генов и развитие организма. Эпигеном включает метилирование ДНК, модификации гистонов и РНК-опосредованные процессы, и нарушение этого баланса может вызвать несколько патологий и способствовать ожирению и диабету 2 типа (T2D). В этом обзоре обобщены эпигенетические сигнатуры, полученные из тканей человека, имеющих отношение к метаболизму, т. Е. жировой ткани, скелетных мышц, островков поджелудочной железы, печени и крови, в отношении ожирения и СД2. Хотя эта область исследований еще молода, эти исчерпывающие данные подтверждают не только роль эпигенетики в развитии болезни, но и эпигенетические изменения в ответ на болезнь. Генетическая предрасположенность, а также старение способствуют эпигенетической изменчивости и нескольким факторам окружающей среды, включая упражнения и диету, далее взаимодействуют с эпигеномом человека. Обратимый характер эпигенетических модификаций открывает перспективы для будущих терапевтических стратегий при ожирении и СД2. 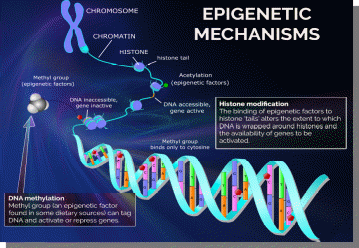 Эпигенитические механизмы Метилирование ДНК- метильная группа (эпигенетический фактор, встречающийся в некоторых диетических источниках) может помечать ДНК и активировать или подавлять гены. Модификация гистонов Связывание эпигенетических факторов с “хвостами” гистонов изменяет степень, в которой ДНК обернута вокруг гистонов, и доступность генов для активации. 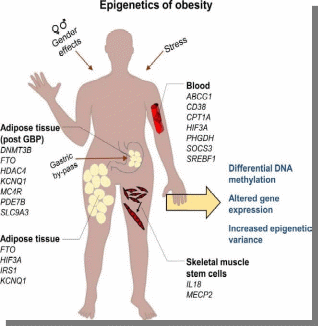 Ожирение связано с дифференциальным метилированием ДНК и повышенной эпигенетической изменчивостью На рисунке показаны ткани и гены с наблюдаемыми изменениями метилирования ДНК из-за ожирения и связанных с ним фенотипов (ИМТ, окружность талии), некоторые из которых также связаны с экспрессией генов. Изменения в метилировании ДНК чаще являются результатом ожирения, чем наоборот желудочным шунтированием. Жировая ткань (пост) Метилтрансферазы, т.е. DNMT1, DNMT3A и DNMT3B, отвечают за прикрепление метиловых групп к ДНК во время репликации и метилирования de novo. Они используют S-аденозил-L-метионин (SAM) в качестве донора метила. Ген FTO (fat mass and obesity associated) кодирует белок FTO, вовлеченный в энергетический обмен и влияющий на метаболизм (обмен веществ) в целом HDCAC4 оказывает влияние на ход клеточного цикла и участвует в регуляции развития KCNQ1- кодирует потенциал-зависимые каналы калия. Эти каналы транспортируют ионы K+ через мембрану и играют ключевую роль в генерации и передаче электрических сигналов клеткой, что необходимо для нормальной работы сердца, внутреннего уха, почек, легких, желудка и толстой кишки Пациенты с дефицитом MC4R характеризуются повышенным аппетитом, ожирением в сочетании с высокими темпами роста. Наряду с избытком жировой массы при мутациях гена MC4R характерно увеличение количества тощей массы и минеральной плотности костей, поэтому такие люди часто кажутся «ширококостными». У больных с дефицитом MC4R отмечаются более высокие концентрации инсулина натощак по сравнению с детьми аналогичного возраста, пола и ИМТ. PDE7B продемонстрировал прямое негативное влияние промоторного метилирования на транскрипционную активность этих генов. Чтобы имитировать ситуацию с T2D были чрезмерно экспрессированы в клональных β-клетках, что привело к снижению секреции инсулина, стимулируемой глюкозой. SLC9A3 участвует в регулировании pH для устранения кислот, образующихся при активном метаболизме, или для противодействия неблагоприятным условиям окружающей среды. Жировая ткань Ген FTO (fat mass and obesity associated) кодирует белок FTO, вовлеченный в энергетический обмен и влияющий на метаболизм (обмен веществ) в целом HIF3A кодирует гипоксиально-индуцируемый фактор 3 субъединица альфа, которая входит в группу гетеродимерных факторов транскрипции, регулирующих реакцию на низкий уровень кислорода (гипоксию). В другом крупномасштабном исследовании, исследующем метилирование ДНК в CD4+ T-клетках, восемь сайтов CpG были связаны с ИМТ и пять с окружностью талии (таблица 1) (Aslibekyan et al., 2015). К ним относятся четыре сайта CpG, например, аннотированные к CPT1A, CD38 и PHGDH, которые были связаны с обоими фенотипами (рисунок 1). IRS1 может опосредванно контролировать различные клеточные процессы с помощью инсулина. При фосфорилировании рецептором инсулина специфически связывается с различными клеточными белками, содержащими домены SH2, такими как субъединица фосфатидилинозитол-3-киназы p85 или GRB2 KCNQ1- кодирует потенциал-зависимые каналы калия. Эти каналы транспортируют ионы K+ через мембрану и играют ключевую роль в генерации и передаче электрических сигналов клеткой, что необходимо для нормальной работы сердца, внутреннего уха, почек, легких, желудка и толстой кишки Кровь Представляющий интерес для ожирения белок, кодируемый ABCG1, участвует в переносе макрофагового холестерина и фосфолипидов. CPT1A кодирует фермент карнитинпальмитоилтрансферазу , который принимает участие в карнитинзависимом транспорте через митохондриальную мембрану при инициировании окисления длинноцепочечных жирных кислот и важно для нескольких метаболических процессов. CD38 также имеет несколько связей с метаболическими чертами, например, было показано, что мыши с дефицитом CD38 имеют более высокую скорость обмена веществ и были устойчивы к ожирению, вызванному диетой с высоким содержанием жира (Barbosa et al., 2007). HIF3A кодирует гипоксиально-индуцируемый фактор 3 субъединица альфа, которая входит в группу гетеродимерных факторов транскрипции, регулирующих реакцию на низкий уровень кислорода (гипоксию). PHGDH Этот ген кодирует фермент, который участвует на ранних этапах синтеза L-серина в клетках животных. L-серин необходим для синтеза D-серина и других аминокислот. Экспрессия SOCS3 повышается при ожирении и, как было показано, индуцирует как резистентность к инсулину, так и лептину, что имеет последствия для контроля уровня глюкозы в крови и энергетического гомеостаза SREBF1 кодирует фактор транскрипции, участвующий в метаболизме липидов, и может быть мишенью для профилактики ишемической болезни сердца Скелетная мускулатура, стволовые клетки MECP2, IL18 дают одно объяснение того, как ожирение может нарушить миогенез и тем самым повлиять на регенерацию и функцию мышц 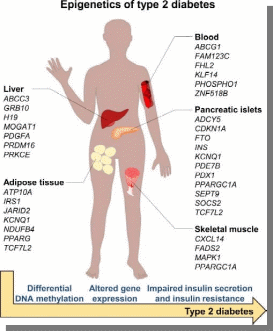 Диабет 2 типа связан с дифференциальным метилированием ДНК в тканях человека На рисунке показаны ткани и гены с наблюдаемыми изменениями метилирования ДНК у пациентов с диабетом 2 типа по сравнению с недиабетическим контролем. Некоторые из этих генов также демонстрируют дифференциальную экспрессию генов и, как было показано, функционально влияют на фенотипы, связанные с диабетом, такие как секреция инсулина. Метилирование ДНК генов, показанных в крови, связано с будущим риском диабета 2 типа в перспективных когортах Кровь Представляющий интерес для ожирения белок, кодируемый ABCG1, участвует в переносе макрофагового холестерина и фосфолипидов Эпигенетические биомаркеры на основе крови отражают возрастные изменения метилирования ДНК на островках поджелудочной железы человека и связаны с будущей секрецией инсулина и T2D (Bacos et al., 2016). Здесь было обнаружено, что старение увеличивает метилирование участков, аннотированных к KLF14, FHL2, ZNF518B и FAM123C как в островках поджелудочной железы человека, так и в крови (рисунок 2). Кроме того, увеличение метилирования в крови тех же участков было связано с более высокой секрецией инсулина и снижением риска T2D ∼10 лет спустя в перспективных когортах. метилирование PHOSPHO1 было уменьшено в скелетной мышце диабетических и контрольных близнецов Печень ABCC3- играет роль в транспорте экскреции органических анионов с желчью и кишечником GRB10- ген кодирует белок, связывающий рецептор фактора роста, который взаимодействует с рецепторами инсулина и рецепторами инсулиноподобного фактора роста H19 играет роль в негативной регуляции (или ограничении) массы тела и пролиферации клеток MOGAT1 катализирует синтез диацилглицеринов, предшественников физиологически важных липидов, таких как триацилглицерин и фосфолипиды PDGFA кодирует член семейства белков, состоящий как из факторов роста тромбоцитов (PDGF), так и из факторов роста эндотелия сосудов (VEGF) PRDM16 Связывает ДНК и действует как регулятор транскрипции. Функции дифференциации коричневой жировой ткани (BAT), которая специализируется на рассеивании химической энергии в форме тепла в ответ на холод или избыточное питание PRKCE участвует во многих различных клеточных функциях, таких как активация нейронных каналов, апоптоз, кардиозащита от ишемии, реакция теплового шока, а также экзоцитоз Жировая ткань ATP10A (АТФаза фосфолипид, транспортирующий 10А )- этот ген экспрессируется по материнской линии. Он отображается в пределах наиболее распространенного интервала делеции, ответственного за синдром Ангельмана, также известный как «синдром счастливой марионетки» IRS1 может опосредванно контролировать различные клеточные процессы с помощью инсулина. При фосфорилировании рецептором инсулина специфически связывается с различными клеточными белками, содержащими домены SH2, такими как субъединица фосфатидилинозитол-3-киназы p85 или GRB2 JARID2 Этот ген кодирует белок, содержащий домен Jumonji и AT-богатый домен взаимодействия (ARID). Кодируемый белок представляет собой ДНК-связывающий белок, который функционирует как репрессор транскрипции. Этот белок взаимодействует с репрессивным комплексом Polycomb 2 (PRC2), который играет важную роль в регуляции экспрессии генов во время эмбрионального развития. KCNQ1 кодирует потенциал-зависимые каналы калия. Эти каналы транспортируют ионы K+ через мембрану и играют ключевую роль в генерации и передаче электрических сигналов клеткой, что необходимо для нормальной работы сердца, внутреннего уха, почек, легких, желудка и толстой кишки NDUFB4 Этот ген кодирует некаталитическую субъединицу мультисубъединицы НАДН: убихинон оксидоредуктазу, первого ферментного комплекса в митохондриальной цепи переноса электронов PPARG Этот ген кодирует член подсемейства рецепторов, активируемых пролифератором пероксисом (PPAR), ядерных рецепторов. PPAR образуют гетеродимеры с рецепторами ретиноидов X (RXR), и эти гетеродимеры регулируют транскрипцию различных генов. TCF7L2 Этот ген кодирует фактор транскрипции, содержащий бокс группы высокой подвижности (HMG), который играет ключевую роль в пути передачи сигналов Wnt. Белок участвует в гомеостазе глюкозы в крови Островки поджелудочной железы ADCY5 Этот ген кодирует член мембраносвязанных ферментов аденилатциклазы. Аденилилциклазы опосредуют передачу сигналов рецептора, связанного с G-белком, посредством синтеза второго мессенджера Цамф Функциональные исследования CDKN1A и PDE7B продемонстрировали прямое негативное влияние промоторного метилирования на транскрипционную активность этих генов. Чтобы имитировать ситуацию с T2D, эти три гена были чрезмерно экспрессированы в клональных β-клетках, что привело к снижению секреции инсулина, стимулируемой глюкозой FTO играет роль в нервной и сердечно-сосудистой системах и тесную связь с индексом массы тела, риском ожирения и диабетом 2 типа. INS Этот ген кодирует инсулин, пептидный гормон, который играет жизненно важную роль в регуляции углеводного и липидного обмена. KCNQ1 кодирует потенциал-зависимые каналы калия. Эти каналы транспортируют ионы K+ через мембрану и играют ключевую роль в генерации и передаче электрических сигналов клеткой, что необходимо для нормальной работы сердца, внутреннего уха, почек, легких, желудка и толстой кишки PDE7B продемонстрировал прямое негативное влияние промоторного метилирования на транскрипционную активность этих генов. Чтобы имитировать ситуацию с T2D были чрезмерно экспрессированы в клональных β-клетках, что привело к снижению секреции инсулина, стимулируемой глюкозой. PDX1 Белок, кодируемый этим геном, является активатором транскрипции нескольких генов, включая инсулин, соматостатин, глюкокиназу, островковый амилоидный полипептид и переносчик глюкозы типа 2. Кодируемый ядерный белок участвует в раннем развитии поджелудочной железы и играет важную роль в его развитии. глюкозозависимая регуляция экспрессии гена инсулина. PRARGC1A Белок, кодируемый этим геном, является коактиватором транскрипции, который регулирует гены, участвующие в энергетическом обмене. Этот белок взаимодействует с PPARgamma, что позволяет этому белку взаимодействовать с множеством факторов транскрипции. Этот белок может взаимодействовать и регулировать активность белка, связывающего элемент ответа цАМФ (CREB) и ядерных респираторных факторов (NRF) SEPT9 Этот ген является членом семейства септинов, участвующих в цитокинезе и контроле клеточного цикла. SOCS2 Этот белок участвует в пути убиквитинирования белка, который является частью модификации белка. TCF7L2 Этот ген кодирует фактор транскрипции, содержащий бокс группы высокой подвижности (HMG), который играет ключевую роль в пути передачи сигналов Wnt. Белок участвует в гомеостазе глюкозы в крови Скелетные мышцы CXCL14 Этот антимикробный ген принадлежит к семейству генов цитокинов, которые кодируют секретируемые белки, участвующие в иммунорегуляторных и воспалительных процессах. Белок, кодируемый этим геном, структурно связан с подсемейством цитокинов CXC (Cys-X-Cys) FADS2 Компонент липидного метаболического пути, который катализирует биосинтез высоконенасыщенных жирных кислот (HUFA) из предшественников незаменимых полиненасыщенных жирных кислот (PUFA) линолевой кислоты (LA) (18: 2n-6) и альфа-линоленовой кислоты (ALA) MAPK1 Действует как репрессор транскрипции. Связывается с консенсусной последовательностью [GC] AAA [GC]. Подавляют экспрессию генов, индуцированных гамма-интерфероном PRARGC1A Белок, кодируемый этим геном, является коактиватором транскрипции, который регулирует гены, участвующие в энергетическом обмене. Этот белок взаимодействует с PPARgamma, что позволяет этому белку взаимодействовать с множеством факторов транскрипции. Этот белок может взаимодействовать и регулировать активность белка, связывающего элемент ответа цАМФ (CREB) и ядерных респираторных факторов (NRF 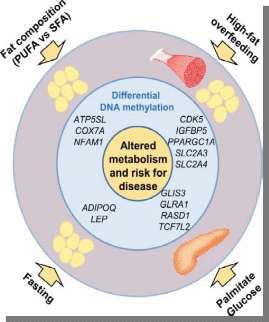 Различные диеты и питательные вещества, связанные с разными метилированием ДНК в человеческих тканях, включая ткань, скелетные мышцы и панкреатические островки. На рисунке показаны ткани и гены с наблюдаемыми изменениями в метилировании ДНК в ответ на вмешательство человека в диету (перекармливание полиненасыщенных жирных кислот [ПНЖК] или насыщенных жирных кислот [НЖК] в течение 7 недель; 5-дневное перекорм с высоким содержанием жиров; или 36 часов натощак), а также островки поджелудочной железы человека, культивированные либо в 1 М пальмитате, либо в 16,7 мМ глюкозы по сравнению с контролем в течение 48 часов. Некоторые из этих генов также демонстрируют дифференциальную экспрессию, а рацион и питательные вещества дополнительно влияют на метаболизм и клинические фенотипы. Состав жира ATP5SL Этот ген кодирует субъединицу митохондриальной АТФ-синтазы. Митохондриальная АТФ-синтаза катализирует синтез АТФ, используя электрохимический градиент протонов через внутреннюю мембрану во время окислительного фосфорилирования. COX7A Компонент цитохром-с-оксидазы, последнего фермента в митохондриальной цепи переноса электронов, который управляет окислительным фосфорилированием. NFAM1 Может функционировать в иммунной системе как рецептор, который активирует через сигнальный путь кальциневрин / NFAT нижележащие промоторы генов цитокинов. Активирует транскрипцию промоторов IL-13 и TNF-alpha. Может участвовать в регуляции развития В-клеток, но не Т-лимфоцитов. Пост ADIPOQ поддерживает баланс жиров и углеводов в организме, участвуя в их метаболизме за счет повышения чувствительности тканей к инсулину и снижения синтеза триглицеридов. LEP обладает способностью кодировать лептин, который относится к гормонам жировой ткани. Мутации гена LEP и гена рецептора лептина LEPR обнаруживаются пациентов с проблемой лишнего веса. Перекармливание с высоким содержанием жира CDK5 необходима для остановки и дифференцировки клеточного цикла нейронов и может участвовать в апоптотической гибели клеток при нейрональных заболеваниях, запуская абортивное повторное вхождение в клеточный цикл. IGFBP5 продлевают период полужизни IGF, и было показано, что они либо ингибируют, либо стимулируют рост стимулирующих эффектов IGF на культуру клеток. Они изменяют взаимодействие IGF с рецепторами на их клеточной поверхности. PPARGC1A кодирует белок, называемый коактиватором PGC-1α. PGC-1α регулирует экспрессию генов, которые помогают производить энергию в клетке. Наряду с UCP3 , PPARGC1A помогает телу оставаться в тепле, преобразовывая энергию в тепло SLC2A3 Облегчающий переносчик глюкозы, который также может опосредовать захват различных других моносахаридов через клеточную мембрану. Опосредует поглощение глюкозы, 2-дезоксиглюкозы, галактозы, маннозы, ксилозы и фукозы, а также, вероятно, дегидроаскорбат SLC2A4 регулируемый инсулином способствующий переносчик глюкозы, который играет ключевую роль в удалении глюкозы из кровообращения. Ответ на инсулин регулируется его внутриклеточной локализацией: в отсутствие инсулина он эффективно удерживается внутриклеточно в отсеках хранения в мышечных и жировых клетках. При стимуляции инсулином он перемещается из этих отсеков на поверхность клетки, где переносит глюкозу из внеклеточной среды в клетку. Пальмитат глюкозы GLIS3 этот ген является членом семейства GLI-подобных белков с цинковыми пальцами и кодирует ядерный белок с пятью доменами с цинковыми пальцами C2H2-типа. Этот белок действует как репрессор и активатор транскрипции и специфически участвует в развитии бета-клеток поджелудочной железы, щитовидной железы, глаз, печени и почек. Мутации в этом гене были связаны с неонатальным диабетом и врожденным гипотиреозом (NDH). Были описаны альтернативно сплайсированные варианты, которые кодируют разные изоформы белка, но была определена полноразмерная природа только двух. GLRA1 рецепторы глицина представляют собой управляемые лигандами хлоридные каналы. Открытие канала запускается внеклеточным глицином. Открытие канала также вызывается таурином и бета-аланином . Характеристики канала зависят от субъединичного состава; Гетеропентамерные каналы активируются более низкими уровнями глицина и демонстрируют более быструю десенсибилизацию . Играет важную роль в подавлении возбудимости нейронов. Способствует генерации тормозных постсинаптических токов RASD1 этот ген может играть роль в индуцированных дексаметазоном изменениях в морфологии, росте и взаимодействии клетки с внеклеточным матриксом. Эпигенетическая инактивация этого гена тесно коррелирует с устойчивостью к дексаметазону в клетках множественной миеломы. Для этого гена были обнаружены альтернативно сплайсированные варианты транскриптов, кодирующие различные изоформы. TCF7L2 этот ген кодирует фактор транскрипции, содержащий бокс группы высокой подвижности (HMG), который играет ключевую роль в пути передачи сигналов Wnt. Белок участвует в гомеостазе глюкозы в крови. Генетические варианты этого гена связаны с повышенным риском диабета 2 типа. Для этого гена было обнаружено несколько вариантов транскрипта, кодирующих несколько различных изоформ. 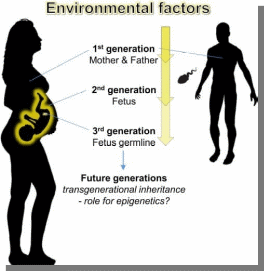 Иллюстрация того, как окружающая среда влияет на три поколения одновременно Во время зачатия окружающая среда влияет на родителей, включая метилом сперматозоидов и внутриутробную среду, и в конечном итоге имеет возможность влиять как на плод, так и на его репродуктивные клетки. Доказательств трансгенерационной эпигенетической наследственности у людей, для которой требуется четыре поколения или более, по-прежнему мало. 1-e поколение(мама& папа) 2-е поколение (зародыш) 3-е поколение (зародышевая линия плода) Трансгенерационное наследование будущих поколений - роль эпигенетики? 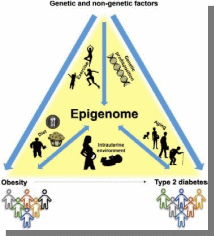 Взаимодействие между окружающей средой, эпигеномом, ожирением и диабетом 2 типа Несколько генетических и негенетических факторов способствуют развитию ожирения и диабета 2 типа. Известно, что те же факторы, например, упражнения, генетическая предрасположенность, диета, внутриутробная среда и старение, влияют на эпигеном человека. Кроме того, эпигеном может как способствовать развитию болезни, так и взаимодействовать с различными физиологическими состояниями гетерогенных заболеваний и реагировать на них. 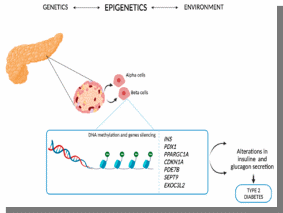 Влияние эпигенетики на регуляцию генов T2D. Гены CDKN1A, PDE7B, SEPT9, EXOC3L2, INS, PDX1 и PPARGC1A регулируют инсулин, экзоцитоз в β-клетках поджелудочной железы и секрецию глюкагона в α-клетках у пациентов с T2D. INS Этот ген кодирует инсулин, пептидный гормон, который играет жизненно важную роль в регуляции углеводного и липидного обмена. PDX1 Белок, кодируемый этим геном, является активатором транскрипции нескольких генов, включая инсулин, соматостатин, глюкокиназу, островковый амилоидный полипептид и переносчик глюкозы типа 2. Кодируемый ядерный белок участвует в раннем развитии поджелудочной железы и играет важную роль в его развитии. глюкозозависимая регуляция экспрессии гена инсулина. PRARGC1A Белок, кодируемый этим геном, является коактиватором транскрипции, который регулирует гены, участвующие в энергетическом обмене. Этот белок взаимодействует с PPARgamma, что позволяет этому белку взаимодействовать с множеством факторов транскрипции. Этот белок может взаимодействовать и регулировать активность белка, связывающего элемент ответа цАМФ (CREB) и ядерных респираторных факторов (NRF) Функциональные исследования CDKN1A и PDE7B продемонстрировали прямое негативное влияние промоторного метилирования на транскрипционную активность этих генов. Чтобы имитировать ситуацию с T2D, эти три гена были чрезмерно экспрессированы в клональных β-клетках, что привело к снижению секреции инсулина, стимулируемой глюкозой SEPT9 Этот ген является членом семейства септинов, участвующих в цитокинезе и контроле клеточного цикла. EXOC3L2 Белок, кодируемый этим геном, активируется фактором роста эндотелия сосудов А и взаимодействует с компонентом 4 комплекса экзоцисты. Кодируемый белок может быть частью комплекса экзоцисты, который играет роль в динамике клеточной мембраны. Мутации в этом гене могут быть связаны с болезнью Альцгеймера. |
