Хлорбензол. Факультет естественных наук
 Скачать 92.61 Kb. Скачать 92.61 Kb.
|
|
МИНОБРАЗОВАНИЕ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Новосибирский национально исследовательский государственный университет» ФАКУЛЬТЕТ ЕСТЕСТВЕННЫХ НАУК Кафедра органической химии Курсовая работа: Синтез хлорбензола. Методы введения галогенов в ароматическое кольцо. Выполнил: ст. гр. 13451 Судобин К.П. Преподаватель: Сколяпова А.Д. Новосибирск – 2014 Содержание 1.Введение……………………………………………………………….с.3 2.Литературный обзор…………………………………………………с.4 Методы введение галогенов в ароматическое кольцо 2.1Реакция электрофильного замещения 2.2 Метод введения галогена в ароматическое кольцо через соли диазония 3.Основная часть……………………………………………………….с.8 4.Экспериментальная часть…………………………………………..с.9 5.Выводы………………………………………………………………...с.11 6.Лит. Источники……………………………………………………….с.12 1.Введение Хлорбензол (фенилхлорид) — ароматическое органическое соединение, имеющее формулу C6H5Cl, бесцветная горючая жидкость с характерным запахом. Хлорбензол был открыт в 1851 году как продукт реакции фенола с хлоридом фосфора(V) и так он обычно получается в лаборатории. В промышленности хлорбензол получают хлорированием бензола при 80-85 °C в реакторах колонного типа, заполненных железными кольцами: 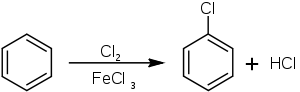 Выделяют его ректификацией после промывки, нейтрализации и азеотропной сушки реакционной массы. Хлорбензол является важным органическим растворителем, кроме того он применяется в органическом синтезе, например он применяется в синтезе пестицидов (например ДДТ может быть получен реакцией его с хлоралем (трихлорацетальдегидом)). Также применяется в производстве фенола: Хлорбензол также является полупродуктом в производстве дихлорбензолов и некоторых красителей. Хлорбензол является веществом малотоксичным, его LD50 равна 2900 мг/кг. 2.Литературный обзор Методы введения галогенов в ароматическое кольцо 2.1Реакция электрофильного замещения: Замещение атома водорода на галоген является одним из методов получения хлор- или бромзамещенных ароматических соединений. 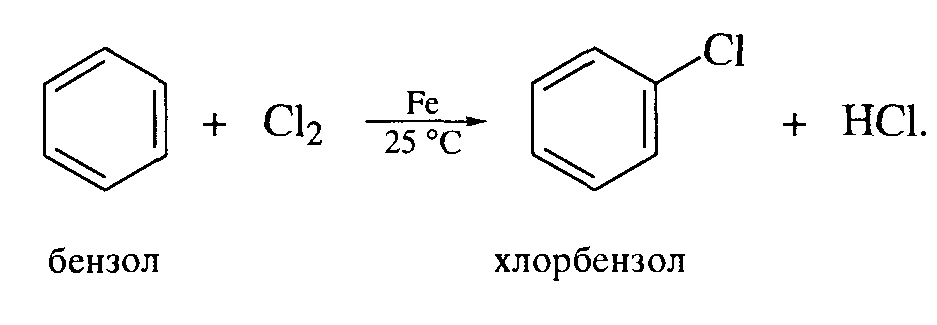 Механизм хлорирования бензола включает следующие стадии: 1. Образование электрофильного агента. Комплексообразование с кислотой Льюиса ведет к появлению частичного или целого положительного заряда на одном из атомов в молекуле хлора. 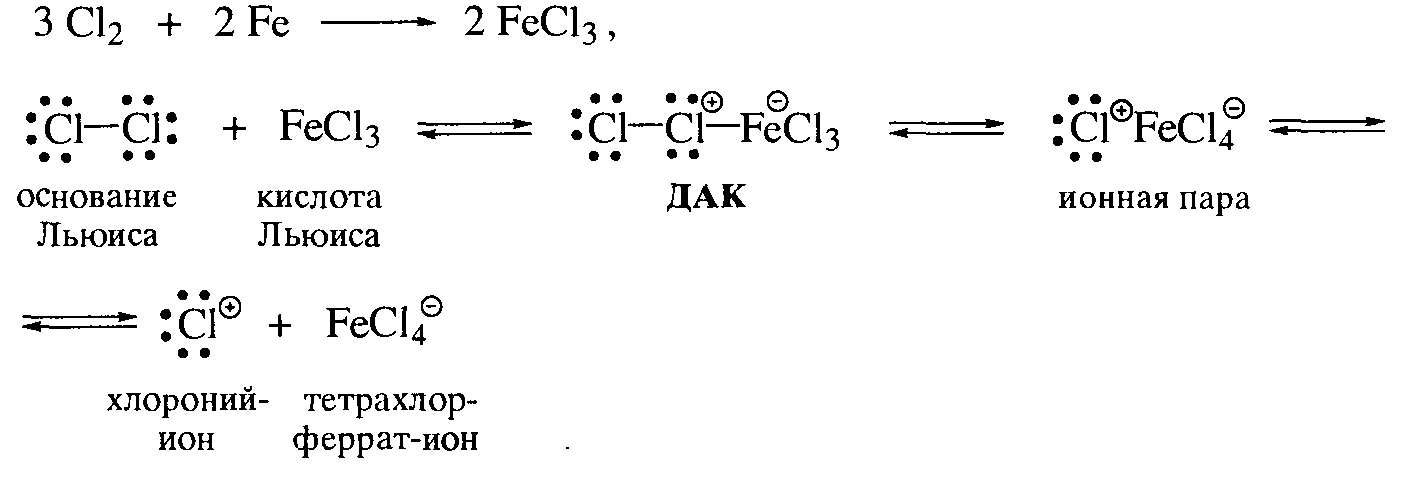 2. Взаимодействие с аренами. И донорно-акцепторный комплекс, и ионная пара, и хлорный ион могут выступать в качестве электрофильного агента при взаимодействии с аренами. 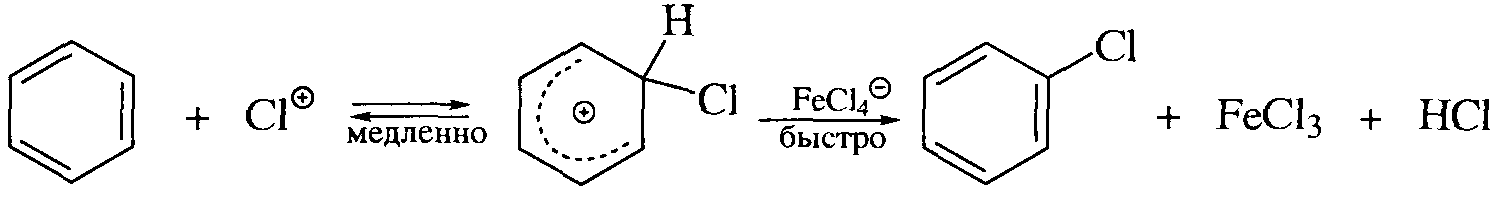 Галогенирование ароматических углеводородов в присутствии кислот Льюиса отличаются тем, что вступающий атом галогена Лишь незначительно дезактивирует ароматическое ядро для последующей электрофильной атаки. В частности при хлорировании бензола в присутствии кислот Льюиса побочно получают о- и п-дихлорбензолы, а так же 1,2,4-трихлорбензол. Продукты полигалогенирования образуются в большей степени, если в качестве катализатора применяют галогениды алюминия. 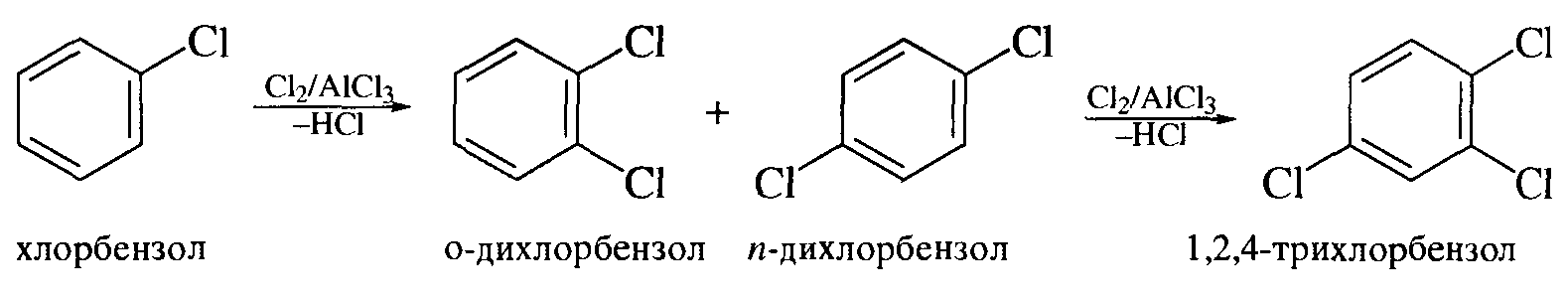 2.2 Метод введения галогена в ароматическое кольцо через соли диазония: Этот метод более универсален чем прямое галогенирование, т.к. с его помощью можно получать не только бром- и хлорбензол, но и фтор- и йодбензол. Рассмотрим на примере нашего соединения. Ароматические соли диазония получают реакцией диазотирования – взаимодействием первичных ароматических аминов с натриевой солью азотистой кислоты в присутствии минеральной кислоты. Общее уравнение реакции диазотирования имеет вид: А протекает наша реакция следующим образом: На первой стадии при взаимодействии нитрита натрия с соляной кислотой образуется азотистая кислота. В солянокислой среде азотистая кислота превращается в нитрозилхлорид, который и является диазотирующим агентом. 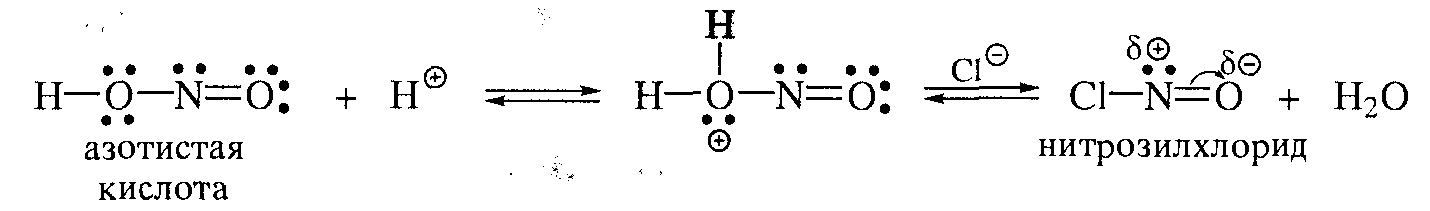 Собственно диазотирование протекает по следующей схеме: 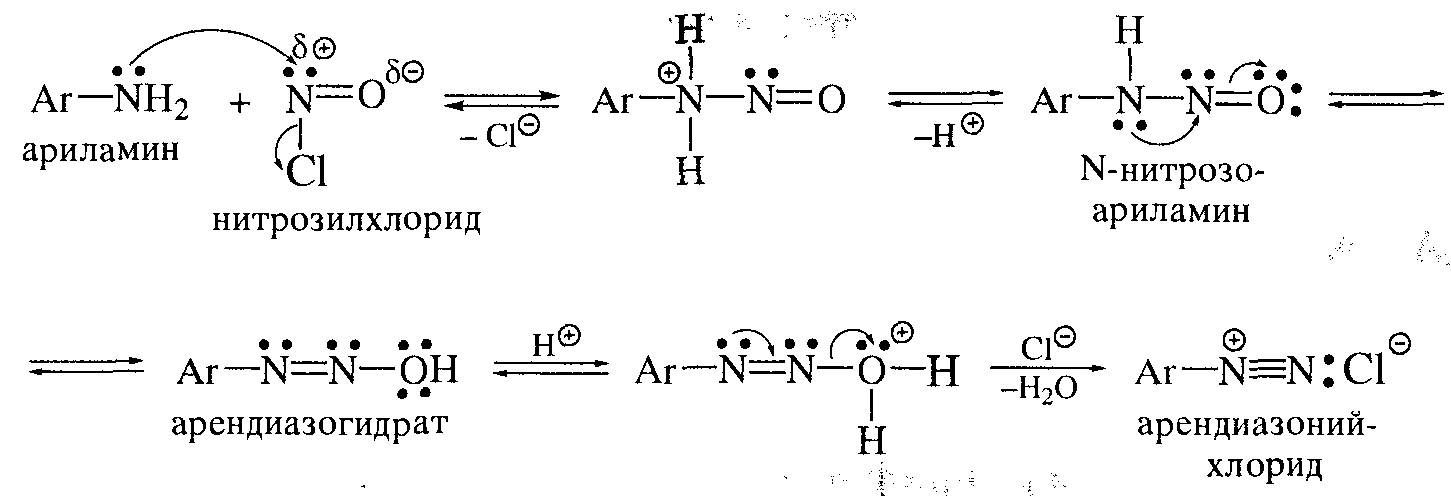 В отличии от алифатических диазоний-ионов ароматические диазоний-ионы стабилизированы сопряжение диазоневой группы с ароматическим ядром. Вследствие этого при 0-5 С они являются вполне устройчивыми соединениями. Как видно из схемы, первичный амин вступает в реакцию диазотирования в свободном состоянии, а не в виде соли, с которой в кислой среде он находится в реакции. На практике при проведения реакции диазонирования мы должны соблюдать следующие условия: 1) Реакцию проводим при 0-5 С, поскольку при более высокой температуре происходит разложение азотистой кислоты и соли диазония. 2) Применяют избыток кислоты (2.5-3 моль на 1 моль амина), при недостатке кислоты наблюдается образование диазоаминосоединений. 3) Окончание диазотирования определяем по наличию избытка HNO2 с помощью йодокрахмальной бумаги. После этого, для замещения группы диазония на галоген, мы используем реакцию Зандмейра, которая проходит по радикальному механизму. 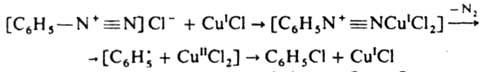 Ион меди является переносчиком электронов и обеспечивает радикальный характер процесса. 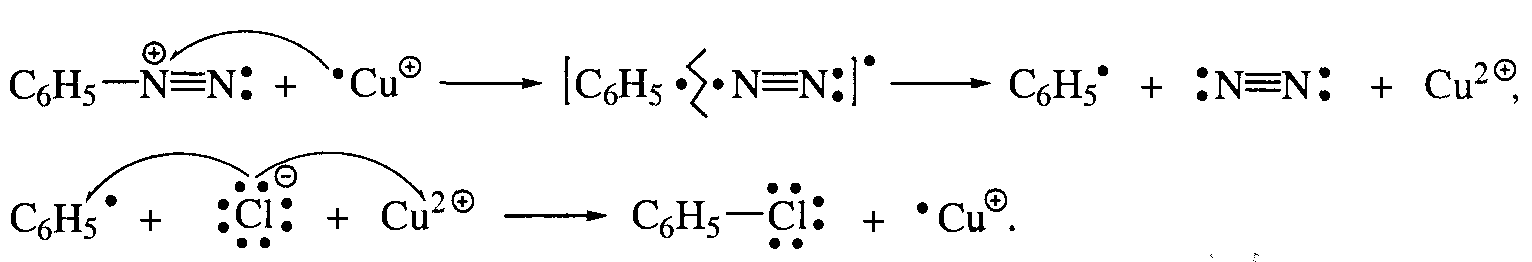 Радикальный механизм подтверждается и тем, что в качестве побочных продуктов в ходе реакции отмечено образование диарилов и азоаренов. 3.Основная часть Начали синтез с того, что в химическом стакане смешали анилин с водой (отметили плавающие жирные капли, свидетельствующие о его нерастворимости). Затем порциями мы аккуратно начали приливать соляную кислоту, следя за температурой после чего поставили на ледяную баню и опустили температуру до -5 С (при охлаждении сразу же начала образоваться кашица). Так же растворили нитрит натрия в воде. Параллельно этому мы готовим медный порошок: для этого мы медный купорос растворили в воде, после чего, мы небольшими порциями присыпали при постоянном перемешивании цинковую пыль, вплоть до обесцвечивания раствора. Далее промыли порошок водой, а затем 5% раствором соляной кислоты на воронке Бюхнера до прекращения выделения водорода. Слили жидкость, перед тем как промыть еще раз водой (чтобы не произошло бурной реакции между водой и кислотой), и после промыли еще и ацетоном (для того чтобы быстрее сохло). Выложили на бумажки и дали пасте высохнуть в порошок. Начали по каплям прикапывать раствор нитрита натрия, не давая температуре подняться выше 5С, дабы не допустить разложения. (Каждая капля бурно реагировала). Окончание реакции проверили йодокрахмальной бумажкой (на избыток HNO2). Далее засыпали в стакан небольшую, заранее отвешенную порцию порошка меди. Сразу началась реакция с образованием газа, пены и изменением цвета в характерные оранжевые тона. После прекращение выделения газа, вынули из воды и добавили оставшуюся медь в 3 подхода и наблюдали схожие картины, но с меньшей силой. После завершения реакции перенесли нашу смесь в установку для паровой перегонке и начали перегонять (жирные капли, бегущие по холодильнику – хлорбензол). Перегонка велась в течении 1.5 часов, т.е. не до конца, так что часть выхода так и осталась не перегнанной. Жирные капли на дне стекшей жидкости – наш хлорбензол, отфильтровали их, а затем дважды эфиром извлекли наше вещ-во из воды и смешали с хлорбензолом. Избавились от воды с помощью осушителя – хлористого кальция. Еще раз описывать причины в этой части не буду, т.к. все подробно изложено в лит, обзоре. 4.Экспериментальная часть. Этапы синтеза:
Выход в теории 5.65 г Выход по методике 3.75 г (66.37%) Выход технического продукта 3.03 (53.62%) Характеристики продуктов реакции
5.Выводы В ходе курсового синтеза было получено 3.03 г вещества. Показана схема синтеза этого вещества. Существенные отклонения в преломления света произошли из-за того, что наше вещ-во не было до конца очищено. А понижение выхода произошло только из-за неполной перегонки паром. 6.Лит. Источники: В.Ф. Травень «Органическая химия» Гинзбург «Практические работы по органической химии» Wikipedia.org xumuk.ru |
