АНАЛИЗ ЭФФЕКТИВНОСТИ ПРОЦЕССА НЕЙТРАЛИЗАЦИОННОГО ДИАЛИЗА ПРИМИНИТЕЛЬНО К ОБЕССОЛИВАНИЮ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ РАЗЛИЧНОЙ. Шарко_курсовая -s. Факультет химии и высоких технологий Кафедра физической химии курсовая работа анализ эффективности процесса нейтрализационного диализа приминительно к обессоливанию растворов сильных электролитов различной природы
 Скачать 454.76 Kb. Скачать 454.76 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» (ФГБОУ ВО «КубГУ») Факультет химии и высоких технологий Кафедра физической химии КУРСОВАЯ РАБОТА АНАЛИЗ ЭФФЕКТИВНОСТИ ПРОЦЕССА НЕЙТРАЛИЗАЦИОННОГО ДИАЛИЗА ПРИМИНИТЕЛЬНО К ОБЕССОЛИВАНИЮ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ РАЗЛИЧНОЙ ПРИРОДЫ Работу выполнил ______________________________________ Н. А. Шарко (подпись, дата) Направление подготовки 20.03.01 техносферная безопасность курс 3 (код, наименование) Научный руководитель доц., канд. хим. наук ____________________________________ А. Э. Козмай (подпись, дата) Нормоконтролер доц., канд. хим. наук _________________________________ С. С. Мельников (подпись, дата) Краснодар 2020 СОДЕРЖАНИЕ Введение 3 1 Литературный обзор 6 1.1 Физико-химические методы очистки 6 1.2 Баромембранные методы водоподготовки 9 1.3 Электромембранные методы 10 2 Теоретическая часть 14 2.1 Постановка задачи 14 2.2 Решение задачи 20 3 Результаты 23 Заключение 26 Список используемой литературы 27 Приложение А 30 ВВЕДЕНИЕ Вода – ценнейший природный ресурс. Она играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в промышленном и сельскохозяйственном производстве. В течение многих лет, она рассматривалась как недорогой ими ресурсами питьевой воды являются подземные воды и поверхностные водоемы. Поверхностные воды - это доступный и возобновляемый ресурс, но эта вода легко загрязняется и содержание соли в ней намного выше, чем в питьевой воде. В свою очередь грунтовые воды менее доступны и не являются возобновляемым ресурсом бесконечный природный ресурс. Однако, исследования показывают тревожное снижение запасов пресной воды в ближайшие годы. Основны[ ]. Таким образом, поверхностные воды могут быть жизнеспособным решением для производства питьевой воды и удовлетворения производственных потребностей в воде []. Увеличение концентрации солей в поверхностных водах обусловлено, в основном, промышленными стоками и сельскохозяйственной деятельностью, а также человеческим фактором []. Высокое содержание, хлорида натрия или хлорида калия в поверхностных водах может оказать негативное влияние на водную экосистему и здоровье человека []. Действительно, употребление соленой воды (0.25 мСм * см-1 OMS) может стать причиной серьезных заболеваний почек, рака шейки матки и высокого кровяного давления []. В этих условиях, обессоливание поверхностных вод, может быть эффективным решением для защиты окружающей среды, сокращения загрязнения вод, влияния на водные экосистемы и обеспечения доступного и возобновляемого ресурса питьевой воды [-]. Отсутствие хорошего качества природных водных ресурсов, а также дисбаланс между запасом и потреблением воды представляет собой два основных ограничения. Фактически, 2,3 миллиарда человек (что соответствует 40% населения мира) живут в состоянии дефицита воды. Это явление наиболее распространено в странах Северной Африки и некоторых странах Средиземноморского бассейна []. Например, Тунис имеет очень ограниченные водные ресурсы, несмотря на постоянный рост спроса на воду (≈1,6% / год) []. Действительно, в 2012 году водные ресурсы Туниса составляли всего 460 м3 / год на человека, что ниже предела дефицита в 500 м3 / год на человека []. В Тунисе Основные водные ресурсы делятся на поверхностные воды (60% от общих водных ресурсов) и подземные вода (40% от общего объема водных ресурсов). 74% поверхностных вод имеют минерализацию менее 1,5 г/л, однако лишь у 20% подземных вод соленость ниже 1,5 г/л. Эти непригодные для питья водные ресурсы (поверхностные и подземные воды) требуется обессоливать до концентрации растворенных веществ 0,5 г/л, значение, установленное Всемирной организацией здравоохранения (ВОЗ) []. Таким образом, обессоливание солоноватой воды может быть лучшей альтернативой для производства питьевой воды, так как это возобновляемый ресурс, реализация получения воды с относительно низкой соленостью из которого отличается сравнительной простотой. Известно, что поверхностные воды с высоким содержанием соли (солоноватые воды), как правило, обрабатываются методами обратного осмоса (ОО) [,,] или электродиализа (ЭД) []. Большая часть потребления воды для орошения растений применяют процесс ОО (около 80%) []. В Тунисе, например, есть только четыре завода ОО, которые были установлены с 1982 по 2007; на островах Керкеннах, Габес, Джерба и Зарзис с общей производительностью 72 300 м3/д []. Таким образом, использование систем ОО и ЭД в развивающихся странах очень ограничены из-за высоких финансовых затрат. Несмотря на то, что стоимость опреснения солоноватой воды относительно низкая (колеблется от 0,10 до 1,00 $ / м3 по методике ОО и от 0,17 до 0,40 $ / м3 по методике ЭД без учета стоимости инвестиций), она тяжела с финансовой точки зрения для населения отдаленных регионов на приобретение опреснительных систем []. Кроме того, процессы ЭД и ОО требуют использования большого количества электричества, которого также не хватает в развивающихся страны []. Замена обычной электрической энергии на фотоэлектрические системы, приводит к значительному увеличению расходов на водоочистку []; то есть для сопряженной ЭД-фотоэлектрической опреснительной системы затраты оцениваются между 4,6 и 6,8 долл. / м3. []. Кроме того, методы ЭД и ОО требуют квалифицированного технического персонала и регулярного технического обслуживания, включая дополнительные расходы. В настоящее время существует несколько способов обессоливания воды, чтобы сделать её пригодной для технических и пищевых целей. 1 Литературный обзор Физико-химические методы очисткиИонообменные аппараты используются для получения высокочистой воды для электронной, химической и других отраслей промышленности, а также для АЭС и ТЭС с паровыми котлами высокого, сверхвысокого и критического давления. Основной их недостаток – большой расход воды на регенерацию ионообменных фильтров (до 60 % от номинальной производительности), а также необходимость предварительной очистки от органических веществ. Адсорберы применяются для адсорбционной очистки воды от токсичных веществ. Адсорбентом может быть, например, активированный уголь. Установка работает в непрерывном режиме. Основная часть установки – реактор кипящего слоя в котором происходит адсорбция токсичных и взвешенных веществ на адсорбенте. В качестве адсорбента можно использовать и твердые восстановители. Производительность реактора 3600 м3/ч, диаметр входной ступени около 2,3 м; диаметр разделительной ступени около 5 м. Очищенная вода поступает на водоснабжение, насыщенный адсорбент – на регенерацию. В процессе можно использовать растворимые в воде восстановители. Коагуляционные установки представляют собой отстойники, в которые подается (дозируется) коагулянт или флокулянт. В качестве коагулянтов используют гидраты солей: сульфаты или хлориды алюминия, железа, магния, а также известь. Флокулянты, как правило, высокомолекулярные органические вещества неионогенного или ионогенного характера. Неионогенные – полимеры, содержащие окси- и/или кетогруппы (крахмал, оксиэтилцеллюлоза, поливиниловый спирт, полиакрилонитрил и др.) Анионные флокулянты содержат кислотные функциональные группы или их натриевые (калиевые) соли, например, активная кремниевая кислота, полиакрилат натрия, альгинат натрия, лигносульфонаты и др. Катионные флокулянты содержат аминогруппы (полиэтиленамин, сополимеры винилпиридина и др.) Амфотерные флокулянты – это полимеры, в молекулах которых одновременно содержатся анионные и катионные группы, например, белки, полиакриламид и др. Широко применяются электрокоагуляторы. Компактность установок, отсутствие реагентного и складского хозяйства, простота обслуживания являются достоинством метода электрохимической коагуляции. Однако энергетические затраты, расход металла электродов, а также нагревание обрабатываемой воды ограничивают применение этого метода очистки сточных вод. Сточная вода, содержащая эмульгированные частицы загрязнений (нефть, жиры, нефтепродукты), поступает в электрокоагулятор и пропускается через систему плоских электродов, установленных на расстоянии 10 мм друг от друга. Концентрация жира и взвешенных веществ на входе составляет 0,3–7,5 и 0,5–8,0 мг/л, соответственно. Напряжение на электролизере 10–18 В, плотность постоянного тока на электродах составляют 0,6 А/дм2. Пропускная способность электрокоагулятора около 3 м3/ч на 1 м2 электродов одного полюса, время обработки стока в межэлектродном пространстве 15–30 с. Флотационные установки могут состоять из одной или двух камер. В однокамерных установках в одном и том же отделении происходит одновременно насыщение стоков пузырьками воздуха и всплывание флотирующихся загрязнений. Двухкамерная установка состоит из приемного и отстойного отделений. В первом происходит образование пузырьков воздуха и агрегатов «пузырек – частица», а во втором – всплывание пены (шлама) и осветление воды. По принципу насыщения жидкости пузырьками воздуха определенной крупности и способу их образования флотационные установки классифицируют: 1 — вакуумные, напорные, эрлифтные, в которых происходит флотация с выделением воздуха из раствора; 2 — импеллерные, безнапорные и пневматические, в которых используют механическое диспергирование воздуха; 3 — с подачей воздуха через пористые материалы; 4 — электрофлотационные; 5 — установки биологической и химической флотации. Экстракция целесообразна при концентрации органических загрязнений не менее 2 г/л. При этом возникает проблема утилизации экстрагента. Термоокислительные методы обезвреживания сточных вод подразделяют на парофазное, жидкофазное и парофазное каталитическое окисление. Печи для сжигания сточных вод требуют больших энергетических затрат для полного окисления органических загрязнений, содержащихся в сточных водах. При неполном окислении возможно образование диоксинов. Магнитная обработка стоков находит применение в системах оборотного водоснабжения для предупреждения образования накипи в теплообменных аппаратах. Озонаторы и хлораторы используют как для окисления органических загрязнений, содержащихся в стоках, так и для их обеззараживания. В присутствии хлоридов натрия иногда целесообразно использовать для этих целей электролизеры различных типов. Баромембранные методы водоподготовки Деминерализация воды ионным обменом и термическая деминерализация (дистилляция)позволяют опреснять воду, почти полностью обессоливать её. Однако применение этих методов выявило наличие недостатков: необходимость регенерации, громоздкое и дорогое оборудование, дорогие иониты и др. В связи с этим быстрое распространение получили баромембранные методы обработки воды. Группа баромембранных методов включает в себя: Обратный осмос (размеры пор 1–15 Å, рабочее давление 0,5–8,0 МПа) применяется для деминерализации воды, задерживает практически все ионы на 92–99%, а при двухступенчатой системе и до 99,9%. Нанофильтрация (размеры пор 10–70 Å, рабочее давление 0,5–8,0 МПа) используется для отделения красителей, пестицидов, гербицидов,сахарозы, некоторых растворенных солей, органических веществ, вирусов и др. Ультрафильтрация (размеры пор 30–1000 Å,рабочее давление 0,2–1,0 МПа) применяется для отделения некоторых коллоидов (кремния, например), вирусов (в том числе полиомиелита), угольной сажи, разделения на фракции молока и др. [1]. Микрофильтрация (размеры пор 500–20000 Å, рабочее давление от 0,01 до 0,2 МПа) используется для отделения некоторых вирусов и бактерий,тонкодисперсных пигментов, пыли активных углей, асбеста, красителей, разделения водо-масляных эмульсий и т.п. Чем более крупные поры образованы в мембране, тем более понятен процесс фильтрации через мембрану, тем более он по физическому смыслу приближается к так называемому механическому фильтрованию. Электромембранные методы Электромембранными в водоподготовке называются процессы разделения, движущей силой которых является разность электрических потенциалов, заставляющая ионы солей двигаться к электродам и разделяться, проникая через специальные мембраны. Обессоленная вода – дилюат (диллюат, диализат), получается на стороне подаваемого потока, а концентрат образуется с той стороны мембраны, куда переходят ионы. Этим электромембранные процессы принципиально отличаются от баромембранных (например, от обратного осмоса), в которых движущей силой процесса разделения является перепад давления, обессоленная вода получается после ее прохождения через мембрану, а концентрат остается на стороне подаваемого потока. Из приведенного сравнения следует, что характер мембран, используемых в этих двух типах процессов, принципиально различается. Мембраны для электромембранных процессов должны быть непроницаемыми для молекул воды и селективно пропускать или катионы, или анионы солей. По этой причине такие мембраны называют ионоселективными, ионитными или ионообменными. Диализ представляет собой мембранный процесс, с помощью которого различные растворенные вещества, имеющие разные молекулярные массы, могут быть разделены за счет диффузии через полупроницаемую мембрану. С одной стороны от мембраны движется исходный раствор, из которого удаляются некоторые компоненты. Раствор, в который переносятся некоторые компоненты исходного раствора, называется диализатом. Движущей силой процесса диализа является градиент концентрации. При наличии градиента концентрации растворенное вещество диффундирует из исходного раствора через мембрану в диализат. Разделение растворенных веществ достигается за счет того, что скорости их переноса через мембрану различаются. Так как процесс диализа протекает под действием градиента концентрации, для получения больших потоков вещества через мембрану необходимо, чтобы толщина мембраны была мала, а разность концентраций переносимого через мембрану компонента по разные стороны от мембраны – наоборот, велика. При проведении процесса диализа используют непористые мембраны. Для того чтобы скорость диффузии вещества в мембране была достаточно велика, необходимо использовать мембраны, которые могут сильно набухать. Известно, что в результате набухания мембраны коэффициент диффузии низкомолекулярного вещества в мембране может увеличиться на несколько порядков величины. Селективность разделения достигается в основном за счет различия молекулярных масс компонентов раствора. Коэффициенты диффузии веществ уменьшаются при увеличении молекулярной массы. Поэтому процесс диализа может использоваться для отделения веществ от коллоидов с малой молекулярной массой [3]. Мембранное равновесие, связанное с различием концентрации солей внутри и вне клеток, известно давно. В 1911 г. Ф. Доннан доказал это явление, которое позже назвали его именем. Мембранное равновесие Доннана связано с переносом некоторого количества вещества низкомолекулярного электролита внутрь пространства, содержащего полимер, и, вследствие этого, неравномерного распределения концентраций этого электролита по обе стороны полупроницаемой мембраны. Условием равновесия является равенство произведений концентраций электролитов (например, KCl) в левой и правой части сосуда, разделенного полупроницаемой мембраной: 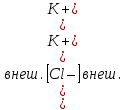 Уравнение равновесия Доннана (1) показывает количество низкомолекулярного вещества, переносимого через полупроницаемую мембрану. Из него следует вывод, что низкомолекулярный электролит распределяется неравномерно по обе стороны мембраны. Перенос вещества всегда существует из внешнего раствора во внутренний, в результате чего во внутреннем растворе наблюдается более высокая концентрация переносимых электролитов по сравнению с внешним раствором. Этим же объясняется некоторый избыток осмотического давления в растворах, содержащих высокомолекулярные соединения и электролиты [3]. Если концентрация низкомолекулярного электролита намного больше концентрации полимера (С2 >> C1), то X = C2/2, т.е. при малых концентрациях макроионов и больших концентрациях малых ионов наблюдается равномерное распределение малых ионов по обе стороны мембраны. Согласно современным представлениям диализ классифицируют по двум типам: обычный (диффузионный процесс разделения растворенных веществ, различающихся молекулярными массами, через полупроницаемые мембраны под действием градиента химических потенциалов компонентов) и доннановский (диализ растворов электролитов на электрически заряженных мембранах). В условиях, когда движущей силой является только градиент концентрации, электролит при его низкой концентрации в растворе через ионообменную мембрану практически не переносится вследствие явления доннановского исключения. Доннановский обменный диализ, основанный на взаимодиффузии через мембраны электролитов с общим ионом, позволяет преодолеть электростатический барьер, который создают фиксированные ионы ионообменных мембран для одноименных с ними зарядов (коионов). На принципе обменного диализа основан непрерывный процесс деионизации растворов, использующий одновременно катионо и анионообменную мембраны и сопровождающийся реакцией нейтрализации – нейтрализационный диализ, который применяется при опреснении воды, обессоливании растворов, содержащих полисахариды и полиэлектролиты,и т.д. Процесс нейтрализационного диализа (НД) как метод обессоливания воды был впервые предложен Igawa и др. Он основан на одновременном использовании двух процессов доннановского диализа, когда катионообменная (КОМ) и анионообменная (АОМ) мембраны отделяют камеру обессоливания от кислотной и щелочной камер, соответственно. В ходе ионного обмена через мембраны, ионы соли удаляются из камеры обессоливания и заменяются на ионы H+ и OH–. В камере обессоливания происходит рекомбинация ионов H+ и OH– с образованием молекул воды. Данная химическая реакция является главной движущей силой процесса. Анализ литературы показывает, что в основном, применение процесса НД к обессоливанию растворов электролитов изучалось экспериментальным путем. Было изучено влияние различных физико-химических параметров системы НД на скорость и степень обессоливания растворов сильных бинарных электролитов. Выяснено, что десятикратное увеличение концентрации кислоты и щелочи приводит к трехкратному увеличению потока соли из камеры обессоливания установки НД. Были предложены простые математические выражения, позволяющие оценить величину потока через мембрану в зависимости от концентрации кислоты (щелочи) и соли в стационарном состоянии. Показано, что эффективность обессоливания возрастает при уменьшении ширины камеры обессоливания. Так же установлено, что в зависимости от начальных концентраций кислоты и щелочи, скорости прокачки растворов через камеры установки НД, момент смены кинетики ионного обмена с внутри диффузионной (перенос лимитируется мембраной) на внешне диффузионную (перенос лимитируется диффузионными пограничными слоями) варьируется по времени. Путем проведения серии экспериментов была предпринята попытка оптимизации процесса НД как функции трех параметров: начальной концентрации и скорости прокачки кислоты и щелочи, а также объема обессоливаемого раствора. Статистическая обработка результатов показала, что наиболее существенное влияние на длительность процесса НД оказывают начальная концентрация щелочи и объем обессоливаемого раствора [3]. Среди всех этих методов очень мало, тех, которые подходят для водоочистки природных вод в тех районах где она необходима. У каждого метода есть свои недостатки: цена на энергию, установку сооружений водоочистки, качество получаемой воды или метод недостаточно изучен, как нейтрализационный диализ, т.к. необходимо учитывать перенос большого количества частиц через мембраны и диффузионные слои, при этом система очень чувствительна к изменению рН обессоливаемого раствора. Одним из важных факторов, влияющих на перенос ионов, является природа электролита в камере обессоливания. Из-за этого коэффициент взаимодиффузии Na+/H+ меньше на 20%, чем Cl-/OH- в диффузионных слоях около КОМ и АОМ, соответственно. Это может повлиять на переход от внутредиффузионной кинетики к внешнедиффузионной и, соответственно, на ход процесса НД, применяя электролиты различной природы для уменьшения разницы коэффициентов взаимодиффузии. 2 Теоретическая часть 2.1 Постановка задачи Нестационарная математическая модель переноса ионов для описания процесса НД в циркуляционном режиме построена аналогично тому, как в работе []. Модель позволяет рассчитывать изменение концентрации, рН и удельной электропроводности раствора электролита при его циркуляции через камеру обессоливания. Модель включает описание переноса через две мембраны, образующие камеру обессоливания, и диффузионные слои со сторон кислотной, щелочной камер и камеры обессоливания. Схематическое изображение изучаемой системы показано на рисунке 1, концентрационные профили схематически представлены для ионов H+ (сплошная линия), Na+ (пунктир), OH– (штрих-пунктир) и Cl– (точки). Здесь DBL – диффузионный пограничный слой; VA,B,D – объемы растворов кислоты, щелочи и соли, соответственно; dc,a – толщина катионообменной и анионообменной мембран, соответственно Рисунок 1 – Схема изучаемой системы 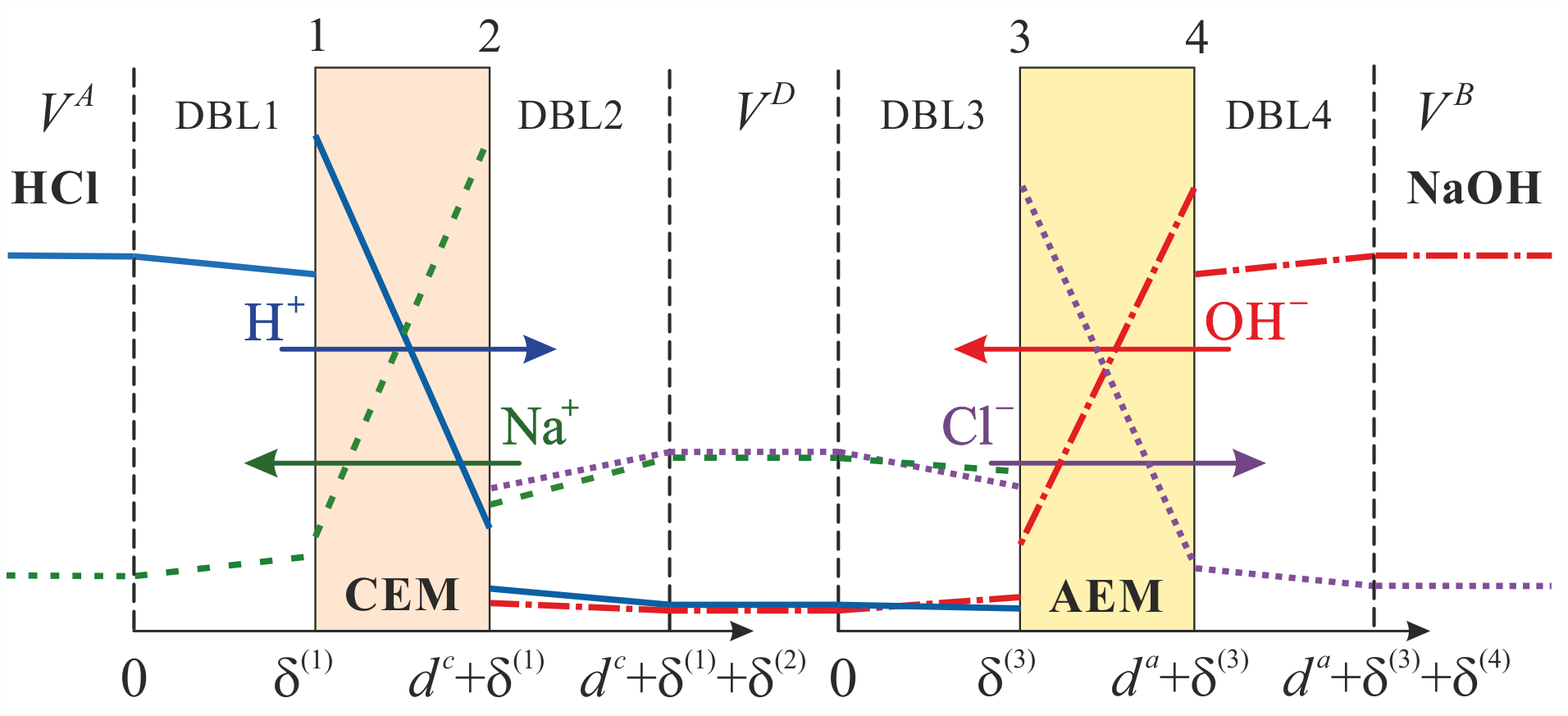  Для описания одномерного электродиффузионного переноса ионов в мембранах и диффузионных слоях использована система уравнений, включающая: уравнение Нернста-Планка, условие электронейтральности, условие протекания тока (нулевого тока в данном случае), уравнение сохранения материи. Уравнения материального баланса связывают изменение концентрации ионов соли в камерах системы с потоками через границы КОМ/кислотная камера и АОМ/щелочная камера, соответственно. Изменение концентрации ионов H+ и OH– в камере обессоливания (КО) зависит одновременно от потоков через границы КОМ/КО и АОМ/КО. На границах мембрана/раствор локальное равновесие описывается уравнениями Никольского; используется условие непрерывности потока. На внешних границах диффузионных слоев (ДПС/объем раствора) применяется условие непрерывности концентрации. Из исходных уравнений модели получены уравнения, связывающие потоки ионов в мембранах и диффузионных слоях системы с концентрациями растворов в камерах. Рассматривается нестационарная модель переноса ионов через катионо- и анионообменную мембраны. Система уравнений, описывающая одномерный диффузионный перенос ионов через мембраны, включает в себя: уравнения Нернста–Планка: 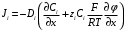 , (1) , (1)условие электронейтральности: 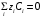 , (2) , (2)условие протекания тока: 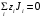 (3) (3)и уравнение сохранения вещества: 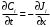 , (4) , (4)где, Сi - концентрацияиона сорта i; Ji, – плотность потока; zi – заряд иона сорта i; Di–коэффициент диффузии ионов сорта i, соответственно; t – время; R, T и F – общепринятые обозначения. Так как количество молей кислоты и щелочи в соответствующих камерах высока (1.5 л * 0.1 моль/л = 0.15 моль) по сравнению с количеством молей соли в камере обессоливания (0.5 л * 0.02 моль/л = 0.01 моль), то можно допустить, что изменяться во времени будет только концентрация соли, в то время как концентрации кислоты и щелочи предполагаются постоянными. Изменение концентрации в камере обессоливания связаны с потоками через мембраны следующими уравнениями: 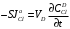 , (5) , (5)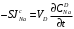 , (6) , (6)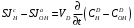 . (7) . (7)где 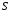 – площадь поверхности мембраны; – площадь поверхности мембраны;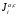 – плотности потоков ионов через анионообменную (индекс а) и катионообменную (индекс с) мембраны; – плотности потоков ионов через анионообменную (индекс а) и катионообменную (индекс с) мембраны; 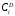 – концентрации ионов в камере обессоливания. – концентрации ионов в камере обессоливания.Из исходных уравнений для потоков ионов через КОМ: 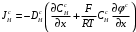 , (8) , (8)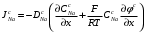 (9) (9)и АОМ: 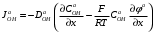 (10) (10)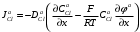 (11) (11)с использованием условия протекания тока 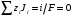 , выразим , выразим 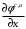 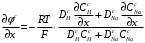 (12) (12)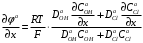 (13) (13)где 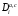 – коэффициенты диффузии ионов через мембраны. – коэффициенты диффузии ионов через мембраны.Таким образом результирующие уравнения для потоков примут вид: 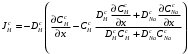 (14) (14)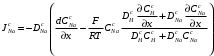 (15) (15)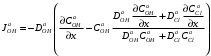 (16) (16)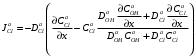 (17) (17)Условие электронейтральности в камере обессоливания и мембранах имеет вид: где 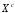 и и 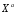 – концентрации ионогенных групп в анионообменной и катионообменной мембранах. – концентрации ионогенных групп в анионообменной и катионообменной мембранах.Баланс концентраций на границе раздела фаз между раствором и мембраной выражаются через константу Никольского как: 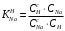 , (21) , (21)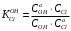 , (22) , (22) 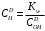 , (23) , (23)где 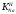 , , 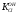 – константы Никольского; – константы Никольского; – константа воды. – константа воды.2.2 Решение задачи Обе мембраны и диффузионные пограничные слои были разбиты на элементарные сегменты с использованием равномерной сетки. Для каждого сегмента системы в каждый момент времени был применен алгоритм численного решения, в котором используется явный метода конечных разностей Эйлера для аппроксимации производных. Шаг по времени определен из условия Куранта-Фридрихса-Леви (его величина составила меньше 10-5 секунд). Численное решение реализовано в программной среде Matlab. Считается, что в начальный момент времени концентрации ионов в диффузионных слоях распределены равномерно. Подгоночными параметрами модели являются толщины диффузионных слоев около поверхностей мембран со стороны кислотной, щелочной камер и камеры обессоливания. Входными параметрами модели являются концентрации и объемы растворов кислоты, щелочи и соли. Выходные параметры: значения концентраций ионов в камерах системы и в мембранах в каждый момент времени. По этим данным рассчитываются электропроводность и рН раствора в камере обессоливания. Коэффициенты диффузии ионов в мембранах рассчитаны по уравнению Нернста-Эйнштейна с использованием экспериментально определенных значений электропроводности и обменной емкости. Так, коэффициенты диффузии для Na+, K+ и Li+ представлены в таблице 1: Таблица 1 - Значения коэффициентов диффузии ионов Na+, K+ и Li+ в растворе (взяты из справочника) и в мембране при 25 oC, а также, значения коэффициентов взаимодиффузии.
Толщина диффузионного слоя (предполагается, что толщины всех ДПС равны между собой, т.к. гидродинамические условия во всех трех камерах одинаковые) оценена из следующих соображений. В основном, толщина ДПС определяется гидродинамическими условиями и типом сепаратора. В канале (в нашем случае длиной 8 см), образованном двумя мембранами без сепаратора, согласно конвективно-диффузионной модели, толщина ДПС составляет примерно 1/3 от межмембранного расстояния (в нашем случае межмембранное расстояние равно толщине сепаратора и составляет 450 микрометров), т.е. 150 микрометров. Роль сепаратора учитывается следующим образом. Известно, что предельная плотность тока в камере обессоливания электродиализатора с сепаратором (аналогичным тому, что использовался в нашем исследовании) примерно в 1.8 раз выше, чем предельная плотность тока в канале без сепаратора при такой же скорости протока раствора. В результате толщина ДПС приблизительно равна 80 микрометров (150 мкм/1.8). Коэффициенты диффузии ионов в растворе заданы как функции локальной ионной силы раствора через уравнение Нернста-Хартли, в котором используется “фактор активности”. Фактор активности определяется из экспериментальных данных по средним коэффициентам активности и молярным концентрациям растворов NaCl, KCl, LiCl. Для разбавленных растворов (вплоть до 0.02 М) можно считать, что фактор активности не зависит от природы электролита. Активная площадь мембран составила 8х8 см2. Межмембранное расстояние равно 0.045 см (равно толщине сепаратора). Объемная скорость течения раствора равна 35 мл/мин; соответствующая ей линейная скорость 1.45 см/с. Начальная концентрация раствора соли (NaCl, KCl, LiCl), циркулирующих через камеру обессоливания и промежуточную емкость равна 0.02 М. Концентрация растворов кислоты (HCl) и щелочи (NaOH) равна 0.1 М. Объем раствора соли равен 0.5 л, а растворов кислоты и щелочи 1.5 л. Температура держалась равной 25о С. 3 Результаты Как видно из рисунка 2, природа электролита оказывает значительное влияние как на рН, так и на электропроводность раствора в камере обессоливания диализатора. Так, в системе с хлоридом лития рН раствора переходит от кислого к щелочному уже на 10 минуте и остается щелочным в течение всего времени процесса НД. В системе с хлоридом калия, напротив, рН раствора резко снижается до 3 и остается кислотным. Что касается раствора хлорида натрия, ход кривой рН меняется с разбавлением раствора. Такое поведение изученных систем можно объяснить следующим образом. Как видно из Таблицы 1, коэффициент диффузии лития имеет наименьшее значение как в растворе, так и в мембране. Скорость обмена ионов лития с протонами через КОМ с самого начала процесса резко снижается и становится меньше, чем скорость обмена ионов хлора с гидроксид ионами. Коэффициент взаимодиффузии Li+ и H+ в КОМ (DLi,H) примерно на 10% превышает коэффициент взаимодиффузии Сl– и ОН– в АОМ (DCl,OH), однако, в растворе DLi,H меньше DCl,OH уже примерно на 30%. С разбавлением раствора, когда кинетика переноса контролируется диффузионными слоями около мембран, связка АОМ+диффузионный слой доминирует в переносе ионов и раствор в камере обессоливания подщелачивается. Электропроводность раствора снижается медленно из-за наличия в растворе большого количества гидроксид ионов, пришедших на замену ионам хлора, имеющим меньшую подвижность. 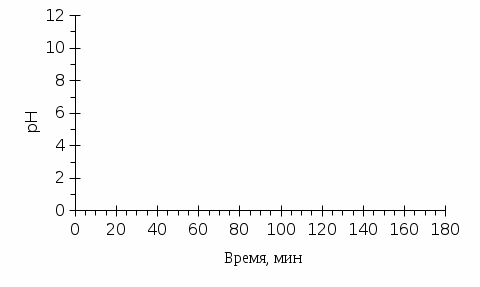 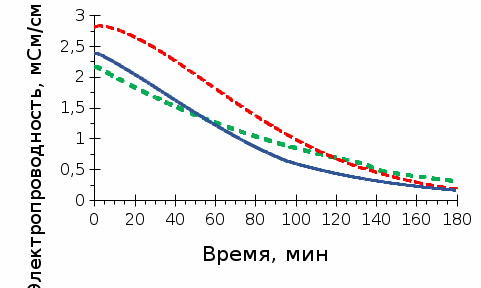 Рисунок 2 - Кинетические зависимости рН и электропроводности обессоливаемого раствора в процессе НД. Растворы, для которых построены временные зависимости, указаны около соответствующих кривых. В случае системы, содержащей раствор хлорида калия, наблюдается обратная ситуация. Из-за больших значений коэффициентов взаимодиффузии DK,H по сравнению с DCl,OH как в мембране, так и в растворе, связка КОМ+диффузионный слой доминирует в ходе всего процесса НД, вызывая подкисление обессоливаемого раствора и гораздо более высокое значение его электропроводности. Это высокое значение определяется большой концентрацией высоко подвижных ионов H+. Что касается системы, содержащей раствор NaCl, то здесь наблюдается переход «лидерства» от КОМ+диффузионный слой к АОМ+диффузионный слой с разбавлением раствора. Такое поведение обусловлено тем, что коэффициент взаимодиффузии DNa,H в КОМ примерно на 35% больше, чем DCl,OH в АОМ (Таблица 1). С разбавлением раствора (примерно до 80 минуты процесса) кинетика переноса контролируется мембранами, что приводит к снижению рН раствора. Однако, после 80 минуты начинает доминировать внешнедиффузионный перенос. Так как в растворе DCl,OH примерно на 20% больше, чем DNa,H, рН раствора меняется в противоположную сторону (становится щелочным). Реакция нейтрализации обеспечивает достаточно низкое значение концентрации ионов H+ и ОН– в обессоливаемом растворе, что определяет быстрое снижение его электропроводности. ЗАКЛЮЧЕНИЕ С целью выяснения влияния природы сильного бинарного электролита на рН и электропроводность обессоливаемого в процессе нейтрализационного диализа раствора, проведена модификация известной из литературы математической модели переноса ионов в системе, состоящей из двух мембран (катионообменной и анионообменной), разделяющих растворы кислоты, щелочи и соли, и образующих три камеры, соответственно, кислотную, щелочную и камеру обессоливания. Результаты моделирования показали, что для достижения нейтрального значения рН обессоливаемого раствора при оптимальном снижении солесодержания, необходимо, чтобы скорость переноса ионов через связки КОМ+ДПС и АОМ+ДПС имела близкие значения. Показано, что в результате смены кинетики переноса от внутредиффузионной к внешнедиффузионной, может произойти переход «лидерства» от КОМ+ДПС к АОМ+ДПС (или наоборот). Этот переход определяется различием в коэффициентах взаимодиффузии противоионов через соответствующие мембраны и диффузионные слои. СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ | |||||||||||||||||||||||||||||||
