Антонец А А 407 гр реферат. Федеральное государственное бюджетное образовательное учреждение высшего образования воронежский государственный университет
 Скачать 143 Kb. Скачать 143 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ И ФАРМАЦЕВТИЧЕСКОЙ ТЕХНОЛОГИИ Реферат Биофармация Выполнила студентка 4 курса фармацевтического факультета Антонец Алина Анатольевна Воронеж — 2020 г. Содержание: 1. Дайте определение биофармации как науки, сформулируйте ее основные положения и задачи..........................................................................................................................3 2. Перечислите группы факторов, которые в настоящее время относят к «фармацевтическим». Дайте подробную характеристику каждой группы, приведите примеры. Поясните биологическое значение фармацевтических факторов. ...................................................................................................................3 3. Дайте понятие «Биоэквивалентность лекарственных препаратов»...............................................................................................................15 4. Поясните понятие «Биологическая доступность». Приведите методы ее определения». ...........................................................................................................15 5. Охарактеризуйте фармацевтические тесты, используемые для определения биодоступности. ............................................................................... 16 1. Дайте определение биофармации как науки, сформулируйте ее основные положения и задачи Биофармация - это научная дисциплина фармации, занимающаяся исследованием влияния физических и физико-химических свойств действующих и вспомогательных веществ в лекарственных препаратах, производимых в различных лекарственных формах, но в одинаковых дозах, на их терапевтический эффект. Биофармацию можно определить как науку, изучающую биологическое действие лекарственных препаратов в зависимости от их физико-химических свойств, лекарственные формы, технологии приготовления. Впервые основные положения биофармации были сформулированы в работах Вагнера. Биофармация призвана создавать лекарственный препарат в определенной лекарственной форме, удобной для приема, хранения, транспортировки. Основная задача биофармации в технологии лекарств заключается в максимальном повышении терапевтической эффективности лекарственных веществ и снижении до минимума возможного побочного их действия на организм. 2. Перечислите группы факторов, которые в настоящее время относят к «фармацевтическим». Дайте подробную характеристику каждой группы, приведите примеры. Поясните биологическое значение фармацевтических факторов. Предметом специального исследования биофармации являются фармацевтические факторы. Условным термином "фармацевтические факторы" определяют наиболее существенные процессы, имеющие место при изготовлении лекарств, и компоненты лекарств, характеризующиеся теми или иными физико-химическими свойствами. К фармацевтическим факторам относят: 1) простую химическую модификацию лекарственных и вспомогательных веществ; 2) физическое состояние лекарственных и вспомогатель-ных веществ; 3) технологические процессы получения лекарств; 4) природа, свойства вспомогательных веществ; 5) вид лекарственной формы. В основу биофармацевтических представлений положено признание биологической (медицинской) значимости всех фармацевтических факторов и рассмотрение лекарства как сложной физико-химической системы, диалектического единства лекарственных веществ и фармацевтических факторов. Достоверно установлено, что если химическая природа и доза лекарственного вещества обуславливает биологическое действие лекарства, то уровень этого действия в значительной мере зависит от фармацевтических факторов. Поэтому лекарства, содержащие равные дозы одних и тех же веществ, но различающиеся примененными при их изготовлении фармацевтическими факторами (видом вспомогательных веществ, способом приготовления, физическим состоянием или простой химической модификацией и др.) могут оказывать разный (неадекватный) терапевтический эффект. Под термином "терапевтически неадекватные лекарства" подразумевают лекарства (лекарственные формы), содержащие одни и те же дозы одних и тех же действующих веществ, часто даже в одинаковой лекарственной форме, но оказывающие различный по силе, уровню терапевтический эффект. Объяснить появление терапевтически неадекватных лекарств и найти пути устранения этого явления смогла биофармация, потребовавшая научно-обоснованного изучения и выбора фармацевтических факторов в процессе создания лекарств, тщательного учета влияния каждого из них не только на стабильность лекарств, но главным образом, прежде всего на процессы поступления (всасывания) лекарств в организм, их распределения и выделения. Рассмотрим отдельные примеры значимости фармацевтических факторов для качества и эффективности лекарств. Под "простой химической модификацией" лекарственных веществ понимают использование последних в виде различных солей, кислот, оснований, в которых полностью сохраняется ответственная за фармакологический эффект часть молекулы вещества. Так, например, в случае антибиотика бензилпеницил-лина рассчитывают, что I мг натриевой соли вещества содержит 1670 ЕД бензилпенициллина; I мг калиевой соли - соответственно эквивалентны 1600 ЕД бензилпенициллина; I мг новокаина бензилпенициллина соответствует 1011 ЕД бензилпенициллина. При получении таблеток, инъекций, капсул, суппозиториев и др. лекарственных форм бензилпенициллина может иметь место замена любого из трех веществ бензилпенициллина эквивалентным по активности в ЕД количеством соответствую-щего вещества. Однако клиническое применение трех названных простых модификаций препарата бензилпенициллина - натриевой соли, калиевой соли и новокаинбензилпенициллина покажет различные результаты, проистекающие из резкой разницы во всасывании каждого вещества. Так, в случае замены натриевой соли эквивалентным по активности количеством калиевой соли бензилпенициллина концентрация антибиотика в плазме крови будет на 40-50% больше; а в случае использования эквивалентных по активности количеств бензилпенициллин-новокаина — в 1,5 раза меньшей, чем при применении калиевой соли антибиотика. Аналогичные результаты имеют место при назначении эквивалентных количеств калиевой, кальциевой соли и антибиотика феноксиметилпенипиллина в кислотной форме.
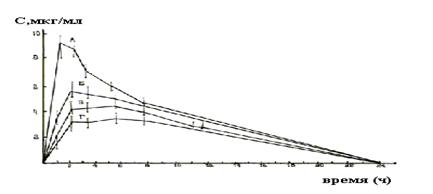
На рис. 2.1 приведены кинетические кривые изменения концентрации хлорамфеникола в плазме крови добровольцев после перорального назначения различных химических модификаций этого антибиотика. Очевидно, что модификация А обеспечивает значительно (почти в 2 раза) более высокий уровень вещества в биологической жидкости и, следовательно, может назначаться для достижения терапевтического эффекта в значительно меньших дозах сравнительно с модификациями Г, В или Б. Рис. 2.1. Концентрация в плазме добровольцев хлорамфеникола после перорального назначения 4 образцов антибиотика (АБВГ) по 0,5 Применение равных (в пересчете на основание) количеств эритромицина и его эфира (пропионат эритромицина) одной и той же группе больных обеспечивает далеко не совпадающие уровни этого антибиотика в плазме крови. Так, если принять условно за 100 концентрацию антибиотика в плазме крови после назначения эритромицина основания, то в крови людей, получавших эритромицина-пропионат его концентрация будет равна 200-400. Данная закономерность (вообще) характерна для лекарственных веществ, являющихся слабыми кислотами и их солями и в равной степени для слабоосновных соединении и их солей (фенобарбитал-натриевая соль фенобарбитала; сульфатиазол - натриевая соль сульфатиазола; ацетилсалициловая кислота - натриевая соль ацетилсалициловой кислоты и т.д.). Различие в скорости и полноте наступления терапевтического эффекта объясняется различным влиянием на всасывание веществ атомных группировок, рН в месте введения, различной растворимостью в липидах клеточных оболочек или физиологических жидкостях, секретах желудка и кишечника, различным значением их рКа, различным коэффициентом межфазного распределения и т.д. Биофармация уделяет изучению фактора ("Простой химической модификации") самое серьезное внимание, ибо учет его влияния на фармакокинетику препаратов позволяет значительно повысить эффективность лекарственного вмешательства, уменьшить расход препаратов, резко повысить стабильность многих лекарственных веществ и их смесей. 2. Под физическим состоянием лекарственного вещества как фармацевтического фактора подразумевают степень измельчения вещества, аморфность или кристалличность его, огранку кристаллов, характер кристаллов и кристаллогидратов, растворимость в воде и липидах, электропроводность, температуру плавления и т.д., иными словами, поверхностные свойст-ва лекарственного вещества. При всей кажущейся простоте слагаемых данного фармацевтического фактора влияние его на фармакотерапевтическую эффективность препаратов, стабильность их в процессе хранения и многие другие показатели являются весьма ощутимыми, а для многих препаратов решающим. Так, степень измельчения лекарственного вещества обеспечивает не только однородность смешения ингредиентов, но во многом определяет стабильность вещества, его реакционную способность и интенсивность всасывания. Особенно существенно значение степени измельчения в процессах всасывания трудно растворимых соединений, всасывание которых возрастает по мере уменьшения размера частиц (сульфаниламидные препараты, тетрациклин и др. антибиотики этого ряда, производные кумарина, бутадион, ацетилсалициловая кислота и др.). Растворимость любого из этих веществ зависит от размера его частиц и его поверхности: чем меньше размер частицы и чем больше суммарная поверхность частиц, тем скорее вещество перейдет в раствор и будет доступным для всасывания. Так, если измельчить такое вещество, как ацетилсалициловую кислоту в 5-10 раз по сравнению с фармакопейным веществом, то резко увеличивается растворимость этого соединения и его всасывание, и в 2 раза повышается его терапевтическая эффективность. Уменьшение частиц гризеофульвина с размера 10 мкм до 2,6 мкм позволяет уменьшить общую дозу вещества, в 2 раза: с 0,5 г до 0,25г, обеспечивая равное содержание его в крови. В настоящее время для большой группы веществ установлено, что как скорость всасывания, так и терапевтическая активность их варьируют в значительной степени в зависимости от степени измельчения. Так, при назначении одинаковых доз сульфадимезина микронизированного и обычной степени измельчения найдено, что в крови людей максимальное содержание вещества в случае применения микронизата, с размерами частиц < 5 мкм, на 40% выше, чем в случае обычной. При этом и максимум концентрации сдвинулся по времени на 2 часа раньше. Антикоагуляционное действие фениндиона в значительной степени также определяется размерами частиц: оптимальным считается размер частиц вещества от 10 до 30 мкм. Если таблетированию подвергнуть частицы размером более 30 мкм, то для достижения такого же лечебного эффекта приходится применять большие (двойные) дозы этого антикоагулянта. Для кальциферола установлено, что всасывание его в организм и лечебное действие наступает только в случае измельчения веществ до частиц менее 10 мкм. Однако, способствуя растворению и всасыванию лекарственных веществ, микронизирование может ускорить процессы их выведения из организма (эритромицин, левомицетин) или усиливать побочные нежелательные эффекты препаратов (дифенилгидантоин). Так, резорцин в мазях для накожного нанесения вводится в виде суспензии, а не раствора (молекулярного состояния), т.к. иначе проявятся его токсические свойства. С увеличением дисперсности резко снижается активность, пенициллина и эритромицина. А при назначении нитрофурантиона, в виде микронизата вещество быстро всасывается, создавая высокие концентрации в крови, при этом наблюдаются общие и местные токсические реакции, в т.ч. значительное раздражение слизистых пищеварительного тракта; назначением той же дозы нитрофурантиона в виде крупных кристаллов удается предотвратить указанные побочные реакции. Поэтому, выбор степени измельчения лекарственных веществ должен осуществляться в обязательном порядке с учетом влияния данного фактора на их фармакокинетику. Из других поверхностных свойств лекарственных веществ особого внимания с точки зрения влияния на фармакотерапевтическую эффективность заслуживает полиморфизм. Как известно, многие вещества обладают способностью образовывать несколько кристаллических модификаций, различающихся показателями кристаллической структуры и, как следствие этого, характеризующиеся различными физическими свойствами. Это явление носит название полиморфизм. Более 1/3 всех органических веществ существует в 2-х и более кристаллических модификациях. Распространенность явлений полиморфизма среди лекарственных веществ несомненна и весьма значительна. К ним следует отнести в первую очередь салицилаты, сульфаниламиды, препараты барбитуратов, антибиотиков, стероидов и многих других. Способность вещества, склонного к полиморфизму, образовывать различные кристаллические модификации зависит от многих условий: способов получения, характера очистки и перекристаллизации, методов сушки и измельчения, наличия тех или иных сопутствующих веществ; хорошими условиями для аналогичных полиморфных превращений являются также: влажная грануляция и прессование при таблетировании, дражирование, получение пилюльной массы, расплавление основ и их охлаждение, суспендирование или растворение лекарственных веществ в гидрофильных или эмульсионных основах и т.д. Обычно менее стабильные кристаллические модификации веществ характеризуются большей растворимостью и лучшей всасываемостью, а поэтому всегда являются наиболее эффективными в терапевтическом отношении. Так, b-форма преднизолона растворяется в 14 раз быстрее a (стабильной)-формы этого вещества и обеспечивает в 1,7 раза более быстрое поступление в кровь стероидов. Взвесь микрокристаллической модификации инсулина действует почти в 2 раза дольше, чем аморфная его модификация. Хлорамфеникол (левомицетин) существует в 3-х кристаллических (А,В,С) и одном аморфном состояниях, из которых только форма В отличается высокой активностью. Метастабильная форма рибофлавина растворяется в концентрации 1200 мг/л (0,12%), а стабильная - только 60 мг/л (0,006 %). С биофармацевтической точки зрения изучение явления полиморфизма лекарственных и вспомогательных веществ, начатое сравнительно недавно в фармацевтическом аспекте, является обязательным и представляет собой исключительно плодотворную область современного лекарствоведения. Исследование полиморфизма лекарственных веществ и использование его с целью повышения эффективности лекарственной терапии является важнейшим разделом биофармации. Вспомогательные вещества. Биофармация впервые дала научное обоснование применению вспомогательных веществ в производстве лекарств. В биофармацевтическом эксперименте установлено многообразное взаимодействие лекарственных и вспомогательных веществ. Обычно все типы связей между активными субстанциями и вспомогательными веществами классифицируют на следующие: водородные связи, соединения включения, cилы Ван-дер-Ваальса, ковалентные связи. В лекарственных формах, в каждом конкретном случае наличия тех или иных лекарственных и вспомогательных веществ, обычно наблюдается или доминируют различные типы связей, характеризующие тот или иной вид взаимодействий В зависимости от характера взаимодействия вспомогательных и лекарственных веществ можно ожидать следующих явлений: а) взаимодействие вспомогательных и лекарственных веществ практически не влияют на скорость и полноту всасывания лекарственных веществ; б) изменяется качество всосавшегося вещества: одновременно образующиеся продукты деструкции лекарственных веществ могут обусловить, особенно при систематическом назначении, возникновение не характерных для основного вещества эффектов. Уровень лечебного действия пpeпарата будет соответствовать ожидаемому; в) образующиеся комплексы, нестехиометрические соединения и так далее, как результат взаимодействия лекарственных и вспомогательных веществ могут облегчить высвобождение вещества из лекарственной формы, повысить его растворимость, способствовать всасыванию или наоборот - вызовут ингибиро-вание вышеназванных процессов: замедлят высвобождение и всасывание лекарственных веществ. Поэтому недопустимо применение какого бы то ни было вспомогательного вещества вместе с лекарственным веществом в виде определенной лекарственной формы без специального исследования возможных видов их взаимодействия и влияния взаимодействия лекарственного и вспомогательного вещества на фармакокинетику вещества в конкретной лекарственной форме. Это одна из главных задач биофармации, важность и масштабность которой позволяет иногда называть биофармацию учением о фармакокинетической функции вспомогательных веществ. И действительно, доказано, что в присутствии вспомогательных веществ очень часто меняется скорость и полнота всасывания многих лекарственных веществ. Примеры: Так, фенобарбитал (в форме суппозиториев, таблеток) в присутствии ПЭГ-400 образует прочный нерастворимый комплекс и поэтому не всасывается и не оказывает терапевтического действия (другие барбитураты не взаимодействуют с ПЭО). В присутствии поливинилпирролидона (ПВП) резко уменьшается антимикробная активность левомицетина. В то же время ПВП повышает скорость всасывания и эффективность салициламида, преднизолона, гризеофульвина. Таблица 2.1
В таблице 2.1 приведены результаты определения природы основы на высвобождение пироксикама из суппозиториев. Гидрофильная (полиэтиленоксидная) основа обеспечивает более чем в 2 раза интенсивное высвобождение вещества сравнительно с традиционной промышленной (заводской) основой. Гидрофильная основа оказалась преимущественней масла какао (в 1,5 раза) и основы витепсол (в 1,9 раза). Вообще, необоснованное использование вспомогательных веществ является весьма частой причиной инактивации вещества в процессе получения лекарственной формы. Так, стабильность препаратов стероидов легко нарушается в присутствии магния оксида в таблетках; стабильность витаминов В1 - в присутствии обычных антиоксидантов - сульфита, метабисульфита натрия; стабильность витамина Д легко нарушается при сочетании его с тальком, фосфатом кальция, лимонной кислотой (в драже), а ацетилсалициловая кислота даже в присутствии следов стеариновой кислоты, карбоната кальция, воды разлагается с образованием салициловой кислоты. Скорость всасывания теофиллина из желудочно-кишечного тракта удается повысить добавлением этанола; скорость всасывания преднизолона, гидрохлортиазона, окситетрациклина замедлить, если назначить их совместно с карбонатом кальция, каолином, двузамещенным фосфатом кальция, стеариновой кислотой. При замене двуводного сульфата кальция в таблетках с дифенилгидантоином натрия (противосудорожное вещество) на лактозу, концентрация вещества в крови пациентов, принимаю-щих это противосудорожное средство, возрастает в несколько раз, что послужило в свое время причиной отравления этим препаратом, имевшее место в CШA и в Австралии. В присутствии лактозы растет скорость всасывания тестостерона, снижается пентобарбитала, инактивируется изониазид.  Соли магния, используемые в качестве вспомогательных веществ в таблетках и капсулах бисгидроксикумарина, способствуют более быстрому и полному всасыванию вещества из ЖКТ. Рис. 2.2 Динамика высвобождения мефенамина натриевой соли (МФНС) и мебетизола (МБТ) из суппозиториев на ПЭО-основе (I) и заводской жировой основе (II) На рис.2.2 приведены результаты, иллюстрирующие влияние природы основы на высвобождение мефенамина натриевой соли и мебетизола из суппозиториев в зависимости от вида основы. Установлено, что гидрофильная ПЭО основа обеспечивает интенсивное высвобождение МФНС, значительно (в 1,8-2 раза) превосходящее результаты для гидрофобной основы. Из суппозиториев на ПЭО основе через 60-70 минут высвобождается 50% включенной МФНС, из липофильной основы только 23-25% этого вещества. Динамика высвобождения мебетизола из суппозиториев не характеризуется столь резким расхождением. Однако ПЭО основа обеспечивает в 1,8-2,1 раза более интенсивное высвобождение мебетизола в сравнении с липофильной основой. Вспомогательные вещества, способны вступать в различные взаимоотношения с действующими веществами, влияют, прежде всего на скорость высвобождения вещества из лекарственной формы. А замедление или ускорение растворения лекарственного вещества, несомненно, влияет на его дальнейшее всасывание. К сожалению, существующие спецификации (ГФ, ФС,ТУ и др.), носящие для изготовителей лекарств (предприятий) законодательный характер, до сих пор придерживаются практики групповой рекомендации вспомогательных веществ в пределах изготовления идентичных лекарственных форм. В качестве иллюстрации можно привести общие и частные статьи фармакопей, относящиеся к известным лекарственным формам: мазям, суппозиториям, инъекциям, таблеткам, драже и т.д. Рациональное (научное обоснование) применения вспомогательных веществ является одной из базисных задач биофармации, лежит в основе создания лекарств заданного типа действия. Везде роль вспомогательных веществ как активных компонентов лекарств несомненна и весьма существенна. Таким образом, только при нayчно-обоснованном применении вспомогательных веществ удается обеспечить ожидаемое, необходимое лечебное действие лекарств. Технологические (производственные) процессы. Под этим фактором понимают специальные методы изготовления лекарственных форм и связанные с ними разнообразные технологические операции и стадии. При изготовлении лекарств обычными технологическими операциями и процессами является нагревание, плавление, сушка, измельчение, смешивание, извлечение, просеивание, грануляция, процеживание, фильтрация, испарение, прессование, покрытие оболочками и т.д. Осуществление любого из этих процессов может быть выполнено самыми различными методами, с применением разнообразной аппаратуры, с использованием, в зависимости от условий и возможностей предприятия, отличного по стандартным показателям друг от друга сырья и т.д., что может вызвать значительные различия в свойствах лекарственных форм. В самом деле, например, в зависимости от способа сушки, времени и характера контакта высушиваемого материала с сушильным агентом, температуры, процесса и т.д. мoгут меняться самым существенным образом поверхностные свойства высушиваемого материала, что в конечном итоге сказывается на растворимости вещества, его стабильности, способности к всасыванию. Так, широко применяемый при изготовлении таблеток метод влажной грануляции, как правило, для ряда лекарствен-ных веществ снижает не только их стабильность, но и скорость, поступления в организм (ацетилсалициловая кислотата, парацетамол, некоторые антибиотики, витамины и др.). Рибофлавин в форме драже, изготовленный по различающейся технологии, вызвал у больных, после приема лекарственной формы, различный уровень концентрации вещества в плазме крови - от 100% до 88% и даже 52%. Колебания вещества в моче после приема больными 28 видов различных драже (различные для драже способы приготовления) с одинаковой дозировкой рибофлавина колебались от 14%до 81%. Установлена также терапевтическая неадекватность одинаковых лекарственных форм эритромицина, преднизолона, тетрациклина, спиронолактона, выпускаемых различными предприятиями. В табл.2.2 приведены результаты изучения (В.А. Головкин) влияния технологических процессов производства суппозиториев мефенамовой кислоты на уровень концентрации этого нестероидного противовоспалительного средства в плазме крови кроликов. Метод прессования суппозиториев обеспечивает некоторое преимущество на первоначальном периоде всасывания - через 30 и 45 мин. уровень концентрации вещества в крови после применения "прессованных" суппозиториев выше, чем после назначения "литых" суппозиториев этого же вещества. Таблица 2.2 Изменение уровня концентрации мефенамовой кислоты в плазме крови лабораторных животных (кролики) в зависимости от способа изготовления суппозиториев и вида лекарственной формы (Головкин В.А.,1980)
Биофармация подтверждает необходимость строго научного обоснования технологического процесса приготовления лекарства (будь то в аптеке или промышленном производстве) с целью обеспечения его максимального терапевтического эффекта при минимальном побочном действии. лекарственная форма и пути введения. Само определение лекарственной формы в биофармации отражает новейшие достижения современного лекарствоведения в общей и фармацевтической технологии в частности. Согласно биофармацевтическим представлениям, лекарственная форма - это рациональная, с совместимыми компонентами, стабильная, удобная для приема и хранения форма, придаваемая лекарственным веществам или лекарственному сырью, обеспечивающая максимальный терапевтический эффект, при минимуме побочного действия. Накоплен значительный экспериментальный материал, подтверждающй зависимость действия лекарственного вещества от вида лекарственной формы и путей ее введения. Большую научную ценность имеют исследования эффективности стероидных гормонов, антибиотиков, сульфаниламидных препаратов, гликозидов, алкалоидов к др. в различных лекарственных формах. Новая трактовка лекарственной формы не допускает эмпирического выбора ее, произвольной замены лекарственных форм, требует новых, адекватных современному научному уровню технологий способов ее приготовления и оценки. В настоящее время не подлежит никакому сомнению, что оптимальная активность лекарственного вещества достигается только при назначении его в рациональной лекарственной форме. Многих побочных реакций в ответ на введение лекарственных веществ в организм можно избежать, если применять более рациональные лекарственные формы. Таблица 2.3 Фармакокинетика аскорбиновой кислоты в организме человека в зависимости от вида лекарственной формы и пути введения
В условиях клиники получены данные подтверждающие, например, роль лекарственной формы на всасывание трифтазина. При назначении вещества в суппозиториях восьми больным препарат уже через 15 мин обнаружен в крови, через 30 мин достиг максимальной концентрации. При назначении той же дозы вещества в форме таблеток вещество обнаруживается в крови через 30 мин и затем концентрация его практически не возрастает. Исследовано влияние лекарственной формы аскорбиновой кислоты на уровень концентрации вещества в крови: ИНЪЕКЦИИ. Парентеральное введение аскорбиновой кислоты в дозе 100 мг/кг здоровым добровольцам способствует эффекту пролонгации действия этого вещества на протяжении 45-50 мин. ПОРОШОК. При назначении аскорбиновой кислоты в виде кристаллического порошка per os, вещество всасывается очень медленно и уровень концентрации его в крови почти в 2,5 раза ниже, чем после парентерального введения раствора. МИКРОКАПСУЛЫ. Пероральное введение аскорбиновой кислоты в форме микрокапсул практически не дает эффекта в связи с тем, что пленка этилцеллюлозы, нерастворимая в жидкостях желудка и кишечника, препятствует высвобождению витамина С из микрокапсул. СУППОЗИТОРИИ. При введении аскорбиновой кислоты в форме суппозиториев, концентрация вещества в крови приближается к значениям, полученным при введении инъекционного раствора. Однако при ректальном введении концентрация аскорбиновой кислоты в крови нарастает и снижается медленнее, чем при парентеральном введении. В табл.2.4 представлены данные, иллюстрирующие существенное влияние вида лекарственной формы (желатиновые ректальные капсулы - ЖРК, суппозитории, таблетки) мефенамовой кислоты на фармакокинетику этого вещества в крови лабораторных животных (Головкин В.А. 1981).Как следует из результатов исследования ЖРК обеспечивают через 2 часа наиболее высокий уровень концентрации мефенамовой кислоты в биологической жидкости, в 2,6 раза превышающий уровень после перорального назначения таблеток. После назначения ЖРК высокий уровень противовоспалительного средства поддерживается в крови на протяжении 6 часов. Таблица 2.4 Влияние вида лекарственной формы и природы вспомагательного вещества на фармакокинетику мефенамовой кислоты (Головкин В.А.,1981)
Иногда вид лекарственной формы предопределяет только скорость всасывания, не влияя существенно на концентрацию в биожидкостях и динамику выведения из организма. Так, в случае назначения эфедрина гидрохлорида в виде суппозиториев (доза 15 мг) веществo обнаруживается в моче у больных уже с 5-й минуты, а после назначения в порошке - на 20-й минуте после введения. Бутадион (доза100мг) после ректального введения в форме суппозиториев обнаруживается в моче на 5-й минуте, и только в интервале между 20 и 30 мин после назначения его в форме порошка. Полученные результаты биофармацевтических исследований имеют большое практическое значение: при необходимости быстрого воздействия эффедрина гидрохлорида или бутадиона эти вещества следует назначать в виде суппозиториев, а не в форме порошка, таблеток или драже. Изучение роли лекарственной формы в фармакотерапии хронического алкоголизма в условиях клиники позволило уточнить тактику врачей. Так, для иллюстрации представляем результаты исследований, описанного в книге Ажгихина-Тенцовой (М., 1984): под наблюдением находились три группы больных хроническим алкоголизмом - по 10 человек в каждой группе. Больным 1 группы тетурам назначали в виде порошка, второй - в виде суппозиториев, третьей - в виде инъекций. После однократного приема тетурама в виде порошка вещество обнаруживается в крови через 2-4 часа, при введении его в виде суппозиториев - через 1-3 часа, в виде инъекций через 1/2- 2 часа. При этом в указанные интервалы времени концентрация тетурама в крови различалась незначительно. Таким образом, наиболее интенсивное всасывание тетурама имеет место в случае в/м инъекции, затем следуют суппозитории и затем порошки. Интерес представляют результаты исследований влияния видов лекарственной формы тетурама в условиях курсового лечения хронического алкоголизма в клинике. При введении тетурама в форме суппозиториев обычно наступала более резко выраженная (по сравнению с группой больных, получавших тетурам в форме порошка) вегетативная реакция, с затруднением дыхания, гиперемией кожных покровов, чувством давления в области лба, учащением пульса, снижением кровяного давления. Отмечается полное отсутствие в группе больных, получавших тетурам в форме суппозиториев, каких-либо симптомов непереносимости. При введении тетурама в виде инъекций, спустя 10-16 часов у больных наступала вегетативная реакция, сердцебиение, длившееся 3-5 часов. Таким образом, результаты экспериментальных биофармацевтических исследований подтверждают определенное влияние вида лекарственной формы не только на быстроту, но и на уровень наступления эффекта лекарственного вещества. 3. Дайте понятие «Биоэквивалентность лекарственных препаратов». биоэквивалентность лекарственных препаратов - достижение сопоставимых показателей скорости всасывания, степени поступления к месту действия и скорости выведения одного или нескольких обладающих фармакологической активностью действующих веществ при применении лекарственных препаратов для медицинского применения, имеющих одно международное непатентованное (или химическое, или группировочное) наименование, в эквивалентных дозировках и при одинаковом способе введения 4. Поясните понятие «Биологическая доступность». Приведите методы ее определения». Для того чтобы оказать терапевтический эффект, лекарственное вещество должно быть доставлено в те органы или ткани, в которых осуществляется его специфическое действие. При внутрисосудистом введении лекарственное вещество сразу и полностью попадает в кровеносное русло. При других путях введения (перорально, внутримышечно, подкожно и т. д.), прежде чем попасть в кровоток, лекарственное вещество должно пройти ряд биологических мембран клеток (слизистой желудка, клеток печени, мышц и т. д.) и только какая-то часть его попадает в системный кровоток. Эффект препарата во многом зависит от того, какая часть введенного лекарственного средства попадает в системный кровоток. Этот показатель характеризует биологическую доступность лекарственного средства. Методы in vitro позволяют судить о биологической доступности лекарственного вещества по его конкретному количеству, высвободившемуся из той или иной лекарственной формы. В связи с установлением в большинстве случаев корреляции между скоростью растворения и скоростью всасывания лекарственных веществ метод определения скорости растворения может рассматриваться как основной метод определения эффективности высвобождения растворимых лекарственных веществ из лекарственных форм. Высвобождение лекарственного вещества базируется также на процессе диффузии. Методы определения эффективности высвобождения лекарственных веществ применимы для всех пероральных и формированных ректальных лекарственных форм. С целью использования этого метода в настоящее время предложено много приборов различной конструкции. В основе всех методов растворения лежат принцип дезинтеграции лекарственной формы (механическое разрушение) и диффузия включенного в нее лекарственного вещества в растворяющую среду. Растворяющей средой может быть вода или жидкость, имитирующая ту или иную биологическую жидкую среду (желудочный сок, кишечный сок и т. д.). В ряде конструкций приборов растворяющая среда не удаляется из емкости прибора на протяжении всего времени определения; в других конструкциях по мере высвобождения (растворения) вещество периодически удаляется из емкости прибора. В приборах первого типа необходимый для 'Процесса растворения и диффузии переход концентрации достигается путем естественной или принудительной (большей частью перемешиванием) конвекции растворяющей среды. В настоящее время в научных и практических (контрольно-аналитическая служба) биофармацевтических исследованиях наибольшее распространение нашли методы и приборы, позволяющие осуществить периодическое удаление высвободившегося лекарственного вещества. биофармация лекарственный препарат всасывание. 5. Охарактеризуйте фармацевтические тесты, используемые для определения биодоступности. Основным видом контроля ЛС, не отличающихся лекарственной формой (ЛФ) и содержанием действующих веществ от соответствующих оригинальных препаратов, является оценка их биоэквивалентности. Она основана на сравнении биодоступности генерического и эталонного (оригинального) лекарственного препарата (ЛП). Два ЛП считаются эквивалентными, если они обеспечивают одинаковую биодоступность ЛС. Исследования биоэквивалентности позволяют сравнить различные серии ЛП одного и того же производителя, а также проанализировать однородность ЛФ по биодоступности внутри одной и той же серии, особенно для плохо всасывающихся, труднорастворимых и сильнодействующих веществ . Наряду с клинической оценкой биоэквивалентности in vivo, которая является достоверным и весьма информативным методом оценки качества ЛП, существуют альтернативные подходы к изучению биодоступности ЛП, как например исследования in vitro. Данные исследования проводятся с использованием фармацевтических тестов для определения биодоступности ЛС. На основании результатов исследования можно сделать обоснованные заключения о качестве сравниваемых препаратов по относительно меньшему объему первичной информации и в более сжатые сроки, чем при проведении клинических исследований . |