Домашняя работа по Аналитической химии. Домашняя работа. Фгаоу во Уральский федеральный университет имени первого Президента России Б. Н. Ельцина Институт химикотехнологический
 Скачать 176.68 Kb. Скачать 176.68 Kb.
|
|
ФГАОУ ВО «Уральский федеральный университет имени первого Президента России Б.Н.Ельцина» Институт химико-технологический Кафедра аналитической химии Дисциплина: АХ и ФХМА Домашнее задание 1-2 Способы комплексонометрического титрования. Расчетные уравнения, используемые для вычисления результатов титрования. Начнем с того, что дадим основные определения для коплексонометрического титрования и определим необходимые условия для титрования: Комплексонометрическое титрование (КМТ) основано на взаимодействии ионов металлов с комплексонами (комплексоны-это группа полиаминокарбоновых кислот, содержащие полидентатные фрагменты, например, N(CH2COOH)2) с образованием прочных, растворимых в воде комплексных соединений — комплексонатов. Реакцию комплексообразования между ионом металла и лигандом можно представить в виде: 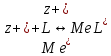 Ионы многих металлов образуют координационные соединения или комплексные ионы с ионами или молекулами, способными быть донорами электронов. Доноры электронов (лиганды — L) должны иметь, по меньшей мере, одну неподеленную пару электронов для образования ковалентной связи с ионом металла. Полидентатные лиганды способны образовывать хелатные (клешневидные) циклы, отличающиеся повышенной прочностью. Комплексы в этом случае называют хелатными или просто хелатами. В титриметрическом методе можно использовать только поли-дентатные лиганды, которые занимали бы все места во внутренней координационной сфере металла, и комплексообразование протекало бы тогда по единственному механизму со строгим соблюдением стехиометрии (должен реагировать в соотношении 1:1): 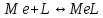 Полидентатные лиганды, пригодные для анализа, должны представлять собой большие молекулы с несколькими функциональными группами и достаточно гибкой структурой (типа «осьминог»). Каждая функциональная группа обеспечивает одну связь лиганда с центральным ионом-комплексообразователем и занимает одно место в его внутренней координационной сфере. Для проведения таких реакций титрант должен гарантировать такие условия: а) реакция титрования должна проходить быстро; б) в ТЭ должно происходить резкое изменение концентрации ионов металла, то есть константа образования (устойчивости) комплекса должна быть достаточно большой (β'>108); в) комплекс должен быть лабильным, т. е. подвижным — быстро образовываться и быстро распадаться. Под эти критерии лучше всего подходит Комплексон-II, III. Комплексон II — этилендиаминтетрауксусная кислота (ЭДТУ, Н4Y), гексадентатная. Четыре координационные связи с металлом образуются за счет карбоксильных групп и две — за счет аминогрупп. Сама кислота и ее мононатриевая соль плохо растворимы в воде, поэтому при титровании используют ее растворимую двунатриевую соль — этилендиаминтетраацетат натрия (ЭДТА, Na2H2Y) — комплексон III. Теперь рассмотрим способы КМТ: Прямое титрование — это метод анализа, при котором к анализируемому раствору, содержащему ион определяемого металла, прибавляют рабочий раствор комплексона до тех пор, пока не будет достигнута точка эквивалентности, которую устанавливают с помощью индикатора. Прямое титрование удобно применять если есть возможность подобрать соответствующий индикатор и взаимодействие иона металла с комплексоном протекает достаточно быстро. По результатам титрования рассчитывают содержание определяемого элемента. Расчеты в комплексонометрии можно проводить по закону эквивалентов, как это делается в других методах титрования. При этом следует учитывать, что при взаимодействии иона металла в любой степени окисления с комплексоном (ЭДТА) выделяется два иона водорода: 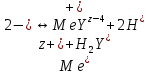 Поэтому факторы эквивалентности ЭДТА и иона металла, независимо от его заряда, всегда равны 1, потому что ЭДТА — это гександентатный комплексон, который реагируют с ион металла в соотношении 1:1. Уравнение материального баланса в этом случае в соответствии с законом эквивалентов выглядит следующим образом: 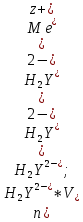  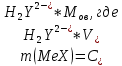 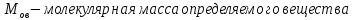 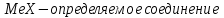 Обычно к анализируемому раствору прибавляют аммиачный буферный раствор, металлоиндикатор и титруют стандартным раствором комплексона III. Способом прямого титрования определяют катионы Cu2+, Со2+, Pb2+, Ni2+, Zn2+, Fе3+, Ва2+, Сг3+,Ca2+, Mg2+ и т. д., потому что  быстро реагируют с ЭДТА, образуют прочные комплексы, к которым легко найти индикатор. быстро реагируют с ЭДТА, образуют прочные комплексы, к которым легко найти индикатор. 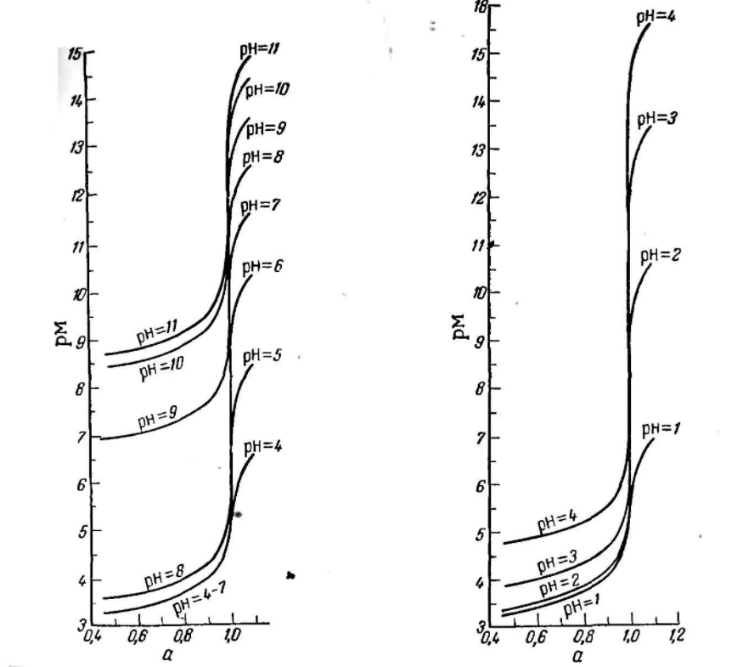  Рисунок 1. Кривые титрования Zn и Fe(III) раствором ЭДТА при различных pH Прибавление буферного раствора для создания pH=8-10, потому что при таком значении pH скачок на кривой титрования наиболее большой, но нужно учитывать, что при таком pH могут протекать и побочные реакции — образование гидроксидов. Обратное титрование — для определения образующихся очень устойчивых комплексов, но их образование идет очень медленно, или для этого комплекса сложно подобрать индикатор, или когда при благоприятных значениях рН определяемый ион металла осаждается в виде гидроксидов. Во всех этих случаях к титруемому раствору прибавляют точно известный избыток комплексона, раствор выдерживают некоторое время для завершения реакции или ускоряют процесс нагреванием. Затем избыток комплексона титруют рабочим раствором соли другого металла (Mе'=Zn, Mg — именно они, потому что быстрее всего реагируют с ЭДТА), для которого реакция с комплексоном соответствует всем требованиям, предъявляемым к реакциям комплексонометрического титрования. При обратном титровании комплексонат определяемого металла на определение точки эквивалентности практически не влияет, так как он образуется медленно и также медленно разрушается. При обратном титровании уравнение материального баланса имеет вид: 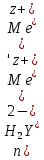 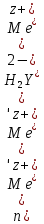 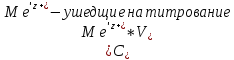  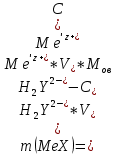 Титрование по способу вытеснения (замещения) — в анализируемый раствор вводят избыток ЭДТА в виде комплексов с Mg или Zn. Если определяемый 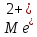 образует с ЭДТА более устойчивый комплекс, чем Mg или Zn, то протекает реакция: образует с ЭДТА более устойчивый комплекс, чем Mg или Zn, то протекает реакция: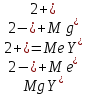 А образовавшиеся ионы 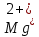 титруют стандартным раствором ЭДТА. титруют стандартным раствором ЭДТА.Чем больше разница в константах устойчивости MеYn-4 и MgY2-, тем полнее идет реакция замещения. Если вытеснение магния происходит медленно, необходимо анализируемый раствор выдержать некоторое время до окончания реакции или ускорить её нагреванием. Таким способом нельзя определить ионы бария, так как β'(BaY2-) < β'(MgY2-). Однако, если к раствору, содержащему ионы бария, добавить достаточное количество аммиака и комплексонат цинка, то произойдет реакция: 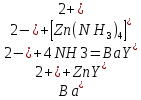 После чего аммиакат цинка при рН=9 титруют комплексоном в присутствии металлохромного индикатора эриохрома черного Т. Такое течение реакции замещения становится возможным, так как в данных условиях β' ( 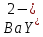 )> β' ( )> β' (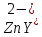 ). ).Уравнение материального баланса, связывающее количество определяемого вещества и титранта, в заместительном титровании аналогично прямому титрованию. А теперь выведем необходимые уравнения для расчета кривой титрования для КМТ (титрант-ЭДТА). В зависимости от pH могут существовать такие формы: H4Y, H3Y-, H2Y2-, HY3-, Y4-, в особых кислых средах: H5Y+, H6Y2+. Влияние концентрации H+ на равновесии ЭДТА и ионов металла можно количественно оценить через условную константу устойчивости по реакции: 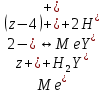 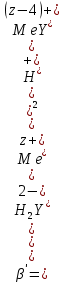 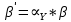 , где , гдеβ-термодинамическая константа образования комплекса (из справочника) ∝Y-молярная доля свободной формы аниона 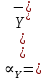 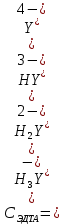 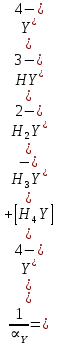 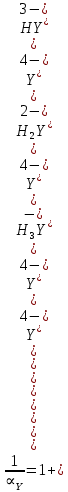 Если рассмотреть каждую ступень диссоциации ЭДТА, то мы сможем выразить каждую из 4 дробей через константы диссоциации каждой ступени. Рассмотрим это на примере 4 степени диссоциации: 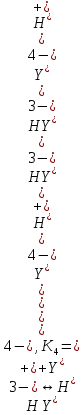 И если провести детальный вывод, то есть рассмотреть каждую ступень, то в итоге мы получим: 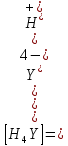 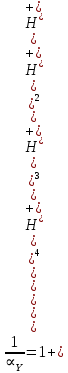 Значит ∝Y — зависит от рН. Но теперь, если рассмотреть реакцию образования комплекса и уравнения констант образования: 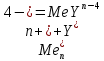 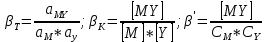 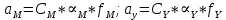 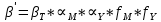 Коэффициент активности f можно не учитывать, потому что он не сильно влияет на конечный расчет: 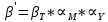 Стоит также учесть, что титрование с ЭДТА лучше всего проводить при pH > 12, значит, для этого требуется буферные растворы, которые могут реагировать с исследуемым металлом: 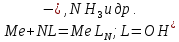 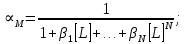 где 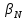 — соответствующая константа образования соединения (комплекса). — соответствующая константа образования соединения (комплекса).Теперь же рассмотрим формулы, которые необходимы для обработки результатов титрования. В КМТ в отличие от кислотно-основного титрования главную роль играет равновесная концентрация ион определяемого метала, а не ионов водорода. Поэтому в начале титрования, когда титрант еще не добавили, то pMe определяется так: 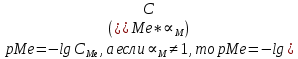 До точки эквивалентности (ТЭ) концентрация ионов определяемого металла вычисляется так: 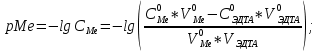 где 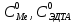 — изначальные молярные концентрации ионов определяемого металла и ЭДТА — изначальные молярные концентрации ионов определяемого металла и ЭДТА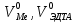 — изначальные объемы ионов определяемого металла и ЭДТА — изначальные объемы ионов определяемого металла и ЭДТА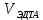 — добавленный объем титранта (ЭДТА) — добавленный объем титранта (ЭДТА)А уже в ТЭ в соответствии с уравнением (допустим, что ион определяемого металла двухзарядный): 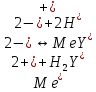 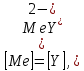 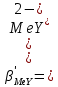 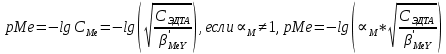 А уже после ТЭ, содержание ионов определяемого металлов будет определяться добавленной ЭДТА: 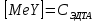 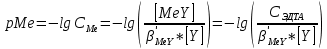 2. Сульфат, содержащийся в 1,151 г пробы, осадили методом гомогенного осаждения, добавив 50,0 мл 0,0264 М раствора BaЭДТА, притом взяли от этого раствора 25,0 мл, и медленно подкислив для освобождения ионов бария. По окончании осаждения, раствор забуферировали до рН = 10 и разбавили точно до 250,0 мл. На титрование 25,0 мл прозрачного раствора потребовалось 28,7 мл стандартного раствора 0,0154 М раствора Mg2+. Рассчитайте %-ное содержание Na2SO4×10H2O в пробе. Дано: 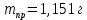 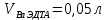 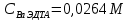 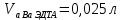 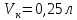 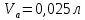 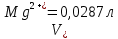 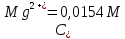 Найти: 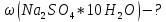 Решение: 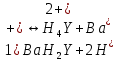 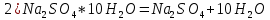 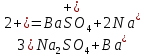 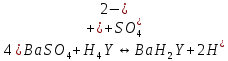 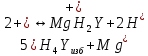 Это обратное титрование, потому что добавляют избыток BaЭДТА, который, в свою очередь реагирует 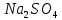 и позже с ЭДТА, образуя комплекс, а избыток ЭДТА оттитровывают и позже с ЭДТА, образуя комплекс, а избыток ЭДТА оттитровывают 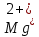 . .Определив 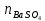 , можно найти , можно найти 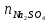 Воспользуемся формулой для определения 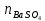 при обратном титровании: при обратном титровании: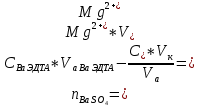 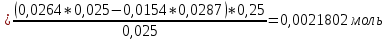 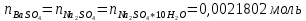 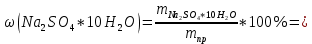 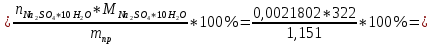 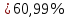 Ответ:  3. Смешаны два раствора бихромата калия 300 мл 0,225 н раствора и 350 мл 0,025 н раствора. Смесь разбавлена до литра. Какова молярная и массовая концентрация дихромата калия в полученном растворе? Дано: 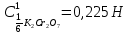 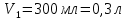 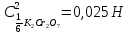 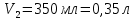 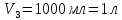 Найти: 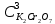 , , 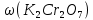 -? -?Решение: 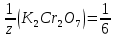 По закону эквивалентов: 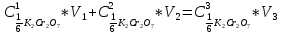 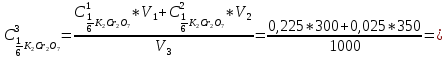 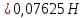 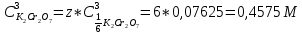 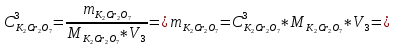 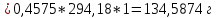 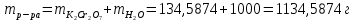 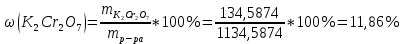 Ответ: 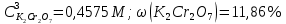 |
