Физическая кристаллография. Дефекты кристаллической решетки. Структура кристаллов. Плотнейшие упаковки в структурах. Структурные типы соединений. Полиморфизм. Изоморфизм и морфотропия. Точечные дефекты. Дислокации.
Решетка и структура кристаллов
Все вещества могут находиться в трёх агрегатных состояниях: твердом, жидком и газообразном, переходы между которыми (так называемые фазовые переходы) сопровождаются скачкообразными изменениями свободной энергии, энтропии, плотности и других физических свойств. Реализация того или иного агрегатного состояния вещества зависит главным образом от температуры и давления, при которых оно находится. Твёрдые тела относят к конденсированному состоянию вещества. В отличие от газообразного состояния у вещества в конденсированном состоянии атомы расположены ближе друг к другу, что приводит к их более сильному взаимодействию, поэтому твёрдые тела имеют собственный объём.
Атомы в твёрдом теле, для которого характерна стабильная, постоянная собственная форма, совершают только малые колебания около своих равновесных положений. Это приводит к правильному чередованию атомов на одинаковых расстояниях для сколько угодно далеко удалённых атомов, т.е. существования так называемого дальнего порядка в расположении атомов. Такое правильное, регулярное расположение атомов в твёрдом теле, характеризующееся периодической повторяемостью в трёх измерениях, образует кристаллическую решетку, а тела, имеющие кристаллическую решетку, называют твердыми телами.
Кристаллическую решётку можно построить, выбрав для этого определенную элементарную ячейку, и многократно повторяя ее по трем непараллельным направлениям. Все элементарные ячейки, составляющие кристаллическую решетку, имеют одинаковую форму и объёмы. Атомы могут располагаться как в вершинах элементарной ячейки, так и в других её точках (узлах кристаллической решётки). В первом случае элементарные ячейки называют примитивными, во втором – сложными.
В кристаллографии рассматривают 14 типов элементарных ячеек. Их называют пространственными решетками Бравэ. Для характеристики элементарной ячейки задают 6 параметров: три ребра ячейки a, b, c и три угла между ними α, β, γ. Эти величины называются параметрами элементарной ячейки (кристаллической решетки). Все 14 решеток Бравэ распределены по 7 кристаллическим системам (сингониям) в соответствии с ориентацией и относительными величинами параметров решётки.
Каждая кристаллическая система включает одну или несколько типов пространственных кристаллических решёток. В простой решётке атомы располагаются только по вершинам решётки, в объёмноцентрированной еще один атом в центре решётки, и в базоцентрированной еще по одному атому в центрах пары параллельных граней.
Свыше ¾ всех элементов, входящих в периодическую систему Менделеева, представляют собой металлы. Из более чем сотни металлических модификаций элементов (считая и полиморфные) опять же более ¾ кристаллизуется в трёх почти одинаково часто встречающихся вышеназванных типах решёток: ГЦК, ГПУ и ОЦК.
В I группе периодической системы все щелочные металлы при нормальных температуре и давлении имеют ОЦК решётку, а все три металла подгруппы меди (Cu, Ag, Au) кристаллизуются в ГЦК решетке.
Металлы II группы с достроенными внутренними электронными оболочками (Be, Mg, Zn и Cd) имеют ГПУ решетку. На примере этих металлов можно заметить, что обычные правильные решетки могут в отдельных случаях значительно искажаться. В то время, как в кристаллической решетке Mg отношение осей c/a = 1,624 близко к 1,633 отвечающему плотной упаковке шаров, у Be оно заметно уменьшено (c/a = 1,568, что соответствует еще большему сжатию вдоль гексагональной оси). У Zn и Cd, наоборот, это отношение равно 1,85 и 1,89 соответственно, т.е. их элементарные ячейки вытянуты вдоль гексагональной оси.
Щёлочно-земельные металлы Ca и Sr, у которых полностью незаполненные d-состояния, имеют ГЦК решетку, в Ba и Ra – ОЦК решетку, как у щелочных металлов I группы. Последнее можно объяснить слабой связью наружных s-электронов (как у щелочных металлов).
Какую-либо закономерность в структурах металлов III и последующих групп с достроенными внутренними электронными оболочками наметить невозможно. Галлий имеет сложную ромбическую решетку, индий – искажённую ГЦК, таллий – ГПУ.
В IV группе олово имеет две модификации: ниже 13,2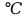 - серое олово с решеткой алмаза, выше 13,2 - серое олово с решеткой алмаза, выше 13,2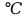 - белое олово с тетрагональной решеткой, являющейся искаженной решеткой алмаза с отношением осей c/a = 0,55. Свинец, относящийся к той же группе, имеет типичную металлическую ГЦК решётку. Интересно отметить, что α-полоний, находящийся в IV группе периодической системы, обладает простой кубической решеткой. - белое олово с тетрагональной решеткой, являющейся искаженной решеткой алмаза с отношением осей c/a = 0,55. Свинец, относящийся к той же группе, имеет типичную металлическую ГЦК решётку. Интересно отметить, что α-полоний, находящийся в IV группе периодической системы, обладает простой кубической решеткой.
Переходные металлы как истинные металлы кристаллизуются за очень небольшим исключением в типичные ГЦК, ГПУ и ОЦК структуры.
При описании кристаллической структуры вещества указывают координаты частиц (атомов, ионов, молекул) в элементарной ячейке, а также координационные числа и координационные многогранники. Координационное число (к. ч.) определяют как число ионов или атомов одного сорта, находящихся на одинаковом расстоянии от атома или иона, принятого за центральный. Координационный многогранник − геометрическая фигура, ограниченная плоскими гранями, все вершины которой заняты атомами или ионами одного сорта и находятся на одинаковом или близком расстоянии от атома или иона, занимающего центр многогранника. Число вершин координационного многогранника равно координационному числу.
Поскольку многие структуры сходны, можно иногда указать лишь относительное расположение частиц в кристалле, а не абсолютные расстояния между ними. Так определяется структурный тип. У кристаллов, принадлежащих одному структурному типу, структуры одинаковы с точностью до подобия.
Международный символ структурного типа состоит из прописной латинской буквы, большой курсивной цифры и может иметь верхний или нижний индексы. Буквы указывают на стехиометрию структурного типа (А − элементы, В − типы со стехиометрией АВ, С − типы АВ2, Е − типы АmВnСo, L − сверхструктуры).
1.4.1. Плотнейшие упаковки в структурах
Рассмотрим модель структуры, построенной из равновеликих несжимаемых шаров. Сначала рассмотрим плоский слой шаров, плотнейшим образом прилегающих друг к другу (рис. 1.47). Каж-дый шар соприкасается с шестью шарами и окружен шестью лун-ками (пустотами), а каждая из лунок − тремя шарами. Элементарная ячейка слоя − ромб со стороной, равной диа-метру шара.
Число лунок (пустот) в слое вдвое больше числа шаров. Обозначим шары буквами A, лунки − буквами B и C: лунки B − треугольники, обращенные вершинами вниз, C − вверх. На этот плоский слой можно наложить второй такой же плотно упакованный так, чтобы шары A второго слоя попали в лунки B или C.
Число пустот O равно числу шаров, а число пустот T вдвое больше. Размеры пустот между шарами характеризуются радиусом шара, который можно в них разместить. Если радиус основного шара равен R, то радиус шара, который можно разместить в окта-эдрической пустоте равен 0,414R, а в тетраэдрической пустоте − 0,225R.
Поскольку во втором слое имеются два типа пустот, шары третьего слоя можно укладывать двояким путем: либо в лунки T, либо в лунки O.
Если шары третьего слоя уложены в лунки T, т.е. каждый шар слоя III находится над шаром слоя I, то третий слой повторяет ук-ладку первого. Соответственно получаем упаковку
… ABABAB …
Если шары третьего слоя уложены в лунки O, т.е. слой III не по-вторяет слоя I, то получаем упаковку
… ABCABC…
Дальнейшие слои можно укладывать по тем же правилам, полу-чая любое чередование (кроме повторения двух букв). Однако плотнейшими упаковками оказываются только две:
двухслойная … ABABAB…
и
трехслойная … ABCABC …
В обеих упаковках коэффициент компактности K = 74,05%, т.е. шары занимают около 3/4 объема.
В двухслойной, или гексагональной, плотнейшей упаковке (ГПУ) …АВАВАВ… шары четного слоя находятся над шарами четного слоя, а шары нечетного слоя − над нечетными. Каждый шар окружен 12 шарами: шестью в той же плоскости, тремя снизу и тремя сверху, т.е. к.ч. = 12. Сквозные пустоты типа O продолжаются из ряда в ряд как сплошные каналы. По этим каналам может происходить диффузия примесей в кристалле. В гексагональной плотнейшей упаковке отношение
c/a = 2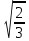 = 1,633. = 1,633.
В трехслойной, или кубической плотнейшей упаковке над пустотой O размещается пустота T и наоборот; сплошных колонок из пустот нет. Четвертый слой повторяет расположение первого. В результате шары размещаются по узлам ГЦК решетки. Координационное число здесь также равно 12. Двухслойная и трехслойная упаковки − плотнейшие. У всех остальных структур коэффициент компактности K < 74,05%. Так, для ОЦК структуры K = 68%.
Структурные типы кристаллов химических элементов
Структурный тип меди (А1). К структурному типу меди относятся многие металлы: Al, Ni, Pb, γ-Fe, Au, Ag, Ir и др.
Пространственная группа Fm3m. Решетка Бравэ − гранецентрированная, сингония − кубическая. Элементарная ячейка меди − ГЦК.
Структурный тип α-вольфрама (А2). В структурном типе вольфрама кристаллизуются многие металлы: Cr, V, Mo, Nb, Ta, α-Fe, β-Zr, β-Hf, β-Ti и др.
Решетка Бравэ − объемно-центрированная, сингония − кубическая. Элементарная ячейка вольфрама − ОЦК.
Структурный тип магния (А3). К структурному типу магния относятся многие металлы: Be, Re, α-Zr, α-Hf, α-Ti, Zn, Cd, Os и др.
Решетка Бравэ − примитивная, сингония − гексагональная. Элементарная ячейка магния − гексагональная плотноупакованная (ГПУ). Большинство металлов с гексагональной плотно упакованной (ГПУ) структурой имеют отношение осей c/a, лежащее в интервале 1,57−1,63. Исключение составляют цинк и кадмий, для которых отношение осей соответственно равно 1,86 и 1,89.
Структурный тип алмаза (А4).
Решетка Бравэ − гранецентрированная, сингония − кубическая. Элементарная ячейка алмаза − ГЦК. Структуру алмаза можно предста-вить в виде двух структур ГЦК, сме-щенных друг относительно друга на ¼ вдоль телесной диагонали <111>.
Структурный тип графита (А9).
Пространственная группа P63/mmc. Решетка Бравэ − примитивная, сингония − гексагональная. Степень заполнения пространства 16,9 %. Графит имеет слоистую структуру. Каждый слой смещен по отношению к двум соседним, точно повторяющим друг друга, на половину большой диагонали гексагона. Структура двухслойная с чередованием слоев,….АВАВАВ…
Расстояние между атомами в слое 0,142 нм, что значительно меньше расстояния между слоями (0,339 нм). Внутри слоя действуют прочные ковалентные связи, между слоями − слабые ван-дер-ваальсовы связи.
В кристаллах со слоистой структурой очень сильно различие физических свойств вдоль и поперек главой оси симметрии. Так, в графите электропроводность вдоль оси с в 105 раз больше, чем в поперечных направлениях. Вследствие слоистости структуры кристаллы графита легко деформируются путем смещения вдоль плоскости (0001), что позволяет применять графит в качестве смазки.
Структурный тип β-вольфрама (А15).
Решетка Бравэ − примитивная, сингония − кубическая. Название структурного типа связано с ошибочным принятием оксида вольфрама WO3 за β-фазу вольфрама.
В настоящее время интерес к этому структурному типу связан с тем, что ряд низкотемпературных сверхпроводников обладает структурой А15, например, Nb3Sn (Tc = 18,0 K), Nb3Ge (Tc = 23 K).
Структурный тип каменной соли NaCl (В1). Решетка Бравэ − гранецентрированная, сингония − кубическая. Элементарная ячейка NaCl − ГЦК. Анионы хлора занимают вершины и центры граней. Катионы натрия находятся на серединах ребер и в центре элементарной ячейки, заполняя все октаэдрические пустоты, а тетраэдрические остаются свободными.
Структурный тип хлорида цезия CsCl (В2). Решетка Бравэ − примитивная, сингония − кубическая.
Структурный тип цинковой обманки (сфалерита) ZnS (В3). Бравэ − гранецентриро-ванная, сингония − кубическая. Структуру можно рассматривать как плотнейшую кубическую упаковку атомов серы. В половине тетраэдрических пустот находятся атомы Zn. У сфалерита нет центра симметрии, структура полярна.
Структурный тип вюрцита ZnS (В4). Решетка Бравэ − примитивная, сингония − гексагональная. Структуру можно рассматривать как плотнейшую гексагональную упаковку атомов серы, где в половине тетраэдрических пустот находятся атомы Zn. Из-за своих свойств симметрии, анизотропия физических свойств в кристаллах со структурой вюрцита еще сильнее, чем в сфалерите.
Структурный тип арсенида никеля NiAs (B8). Решетка Бравэ − примитивная, сингония − гексагональная.
Структурный тип флюорита CaF2 (C1). Решетка Бравэ − гранецентрированная, сингония − кубическая. Ионы Ca2+ занимают вершины и центры граней кубической ячейки. Ионы F− находятся в аналогичных позициях, занимая все тетраэдрические пустоты в решетке, образованной Ca2+. Существуют кристаллические структуры, которые формально соответствуют структурам флюорита с той лишь разницей, что плотнейшую упаковку образуют анионы, а катионы заполняют все тетраэдрические пустоты. Структура типа флюорита, в которой позиции катионов заняты анионами, а позиции анионов катионами, называется антифлюоритовой.
Структурный тип перовскита CaTiO3 (E21). Решетка Бравэ − примитивная, сингония − кубическая. Рентгеноструктурные исследования последних лет показали, что реальная кристаллическая структура CaTiO3 имеет отклонения от кубической сингонии и поэтому называется «псевдокубической». Строго говоря она всего лишь ромбическая с пространственной группой Pсmn. Структуру перовскита имеют недавно открытые высокотемпе-ратурные сверхпроводники:
YBa2Cu3O7−δ (TC = 93 K),
Bi2Sr2CaCu2O8+x (TC = 94 K),
Tl2Ba2Ca2Cu3O10+x (TC = 125 K),
HgBa2Ca2Cu3O8+δ (TC = 133 K).
Полиморфизм
Металлический уран до плавления (1132,4º) имеет три кристаллографические модификации. При комнатной температуре устойчива ромбическая α-фаза, которая состоит из «гофрированных» атомных слоёв, параллельных плоскости abc. В пределах слоёв, атомы тесно связаны, в то время, как прочность связей между атомами смежных слоёв намного слабее. В интервале 668-775º существует β-уран. Тетрагонального типа решётка имеет слоистую структуру со слоями, параллельными плоскости ab в позициях 1/4с, 1/2с и 3/4с элементарной ячейки. При температуре выше 775º образуется γ-уран с объёмноцентрированной кубической решёткой.
На примере лантаноидов, урана видно, что ряду металлов свойственна не одна, а две и более кристаллические структуры, устойчивые при различных температурах и давлениях. Этими свойствами кристаллы обязаны полиморфизму. Полиморфизмом называется изменение типа кристаллической структуры при изменении температуры или давления. Такие структуры называют полиморфными формами или модификациями вещества, а переход от одной модификации к другой – полиморфными превращениями. Например, цирконий имеет две модификации. Низкотемпературная модификация α-Zr имеет ГПУ решетку с отношением c/a = 1,589 и существует до 863 °C; высокотемпературная модификация β-Zr имеет ОЦК решетку и существует в интервале температур 863–1845 °C, т.е. до температуры плавления.
У щелочных металлов долгое время была известна лишь ОЦК решетка. Однако при очень низкой температуре у натрия (при 35 К) и лития (при 78 К) обнаружена также плотнейшая ГПУ структура.
При повышении давления также наблюдаются полиморфные превращения. Кремний и германий, которые при обычных условиях представляют собой полупроводники, при высоких давлениях переходят в металлическую модификацию с решеткой белого олова.
Полиморфизм сильнее всего распространен среди металлов переходных групп, лантаноидов и актиноидов. Эта склонность металлов переходных групп к полиморфизму обусловлена близостью энергетических уровней ns- и (n–1)d-электронов, например 4s и 3d, 5s и 4d, и легкостью перехода s-электронов в d-состояние и, наобо-рот, d-электронов в s-состояние при изменении температуры.
Изоморфизм и морфотропия. Рассмотрим несколько ионных соединений щелочных металлов с галоидом бромом: LiBr, NaBr, KBr, RbBr и CsBr. Первые четыре соединения имеют решетку типа NaCl, а пятое соединение CsBr кристаллизуется в решетке типа CsCl.
В первых четырех случаях наблюдается явление изоморфизма – сохранение типа структуры при замене одних структурных частиц на другие, химически родственные. Но при переходе от Rb к Cs отмечается изменение типа структуры, наблюдается явление морфотропии.
Геометрическую основу явления морфотропии можно легко увидеть из данных табицы. Мы видим, что у соединений LiBr, Nabr, KBr и RbBr отношение rк/ rа находится в пределах 0,41–0,73, т.е. в тех пределах, когда энергетически и геометрически наиболее выгодно заполнение октаэдрических пустот. Только для одного, из этих соединений, а именно для CsBr отношение rк/ rа = 0,84, т.е. значительно выше 0,73, поэтому для него наиболее выгодным является заполнение кубических пустот катионами.
ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ
Реальный кристалл отличается от идеального наличием различ-ного рода дефектов.
Дефекты кристаллического строения подразделяются по геометрическим признакам на четыре класса.
Точечные. Имеют атомные размеры во всех трех измерениях. Их размеры во всех направлениях не больше нескольких атомных диаметров. К точечным дефектам относятся: вакансии, межузельные атомы и всевозможные их сочетания, их комплексы, атомы примеси.
Линейные. Имеют атомные размеры в двух измерениях, а в третьем они значительно большего размера, который может быть соизмерим с длиной кристалла. К линейным дефектам относятся дислокации, дисклинации, цепочки вакансий и междоузельных атомов.
Поверхностные. Имеют атомные размеры только в одном измерении. К ним относятся поверхность, границы зерен, фаз, двой-ников; дефекты упаковки; границы доменов в сверхструктуре и т.п.
Объемные. В отличие от перечисленных выше дефектов, имеют во всех измерениях относительно большие размеры, несоизмери-мые с атомными. К ним относятся поры, трещины, выделения и т.д.
Дислокации являются особым типом несовершенств в решетке, резко отличным по своей природе от других, в том числе и линейных, несовершенств. В настоящее время с использованием теории дислокаций рассматриваются многие процессы, протекающие в кристаллах, такие, как пластическая деформация, кристаллизация из расплава, фазовые и структурные превращения в твердом состоянии и многие другие.
Точечные дефекты
Вакансии и межузельные атомы
В совершенном кристалле атомы расположены строго периодически. В реальном кристалле эта периодичность нарушена несовершенствами. Наиболее простыми структурными дефектами в чистом кристалле являются вакансии и межузельные атомы. Точечные дефекты весьма локализованы и характеризуются тем, что искажения решетки сосредоточены в районе одного узла.
Вакансия, как это следует из ее названия, представляет собой пустой узел кристаллической решетки, а межузельный атом – это атом, расположенный в междоузлии. В то время как вакансии всегда расположены в узлах решетки, для межузельных атомов рассматривают более чем одну возможную конфигурацию, что связано с изменением энергии кристалла при образовании дефекта в зависимости от его расположения.
Энергия образования точечных дефектов
Одним из основных параметров, характеризующих точечный дефект, является энергия его образования ЕF. Как мы увидим, величина энергии образования точечного дефекта определяет их концентрацию в кристалле, находящемся в равновесном состоянии.
Существует ряд способов расчета энергии образования вакансий. Кратко остановимся на качественном описании некоторых из них.
С учетом энергии за счёт перераспределения электронов и атомов вокруг вакансии, энергию образования вакансии можно записать как EFv = (Ес – W), где W – суммарная энергия релаксации, а Ес - энергия связи на атом, где 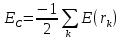 . E(r) – потенциальная энергия взаимодействия атома с другим атомом решетки, находящимся от него на расстоянии r, k – индекс суммирования по всем атомам решетки, а коэффициент 1/2 необходим для того, чтобы избежать двукратного учета парных взаимодействий. . E(r) – потенциальная энергия взаимодействия атома с другим атомом решетки, находящимся от него на расстоянии r, k – индекс суммирования по всем атомам решетки, а коэффициент 1/2 необходим для того, чтобы избежать двукратного учета парных взаимодействий.
Главной трудностью при расчете энергии образования дефектов является оценка W. В теоретической физике твердого тела усилиями Хантингтона, Зейтца, Фуми, Зегера, Бросса и др. разработано несколько моделей оценки энергии решетки и суммарной энергии релаксации. В целом считают, что эти результаты согласуются удовлетворительно. После удаления атома из решетки смежные атомы для сохранения равновесия должны сместиться, очевидно, к центру вакансии, что вызывает некоторое смещения всех остальных атомов. Эту трансформацию решетки и образование вакансии можно описать с помощью поля смещения U(r), в котором r – вектор, соединяющий центр вакансии с узлами решетки.
Энергия образования межузельного атома зависит от того, какую позицию он занимает в кристаллической решетке. Различные конфигурации межузельных атомов рассчитывались с помощью компьютеров. Для ГЦК решетки рассматривались три конфигурации: объемно-центрированная, расщепленная и конфигурация краудиона. Объемно-центрированная и расщепленная (гантельная) конфигурации.
Гантельная конфигурация образуется при подходе межузельного атома к центру одной из граней, в результате чего атом из центра грани смещается и образует с межузельным атомом пару – гантель. Краудион представляет собой межузельный атом, локализованный вдоль направления плотной упаковки так, что смещение ато-мов из равновесных положений линейно падают по мере удаления от центра искажения, а движение всего краудиона может происходить только вдоль направления атомного ряда.
При компьютерном моделировании взаимодействия атомов прослежено движение смещенных атомов по отношению к равновесному положению. Установлено, что объемно-центрированная конфигурация межузельного атома является нестабильной: атом, помещенный в эту позицию, быстро передвигается из центра куба в направлении к одному из ближайших узлов и образует расщепленную конфигурацию, сместив соседа с занимаемой им первоначально позиции. В случае меди расчет дал для расстояния между атомами в расщепленной конфигурации величину 0,6 постоянной решетки. Устойчивость расщепленной конфигурации в гранецентрированных металлах была подтверждена рядом других теоретических расчетов. Расчеты показали также, что разница энергий между расщепленной и объемно-центрированной конфигурациями невелика, т.е. порядка 0,2 эВ.
В дальнейшем предполагается, что межузельные атомы имеют расщепленную конфигурацию, однако надо иметь в виду, что вследствие малого различия энергий двух конфигураций результаты теоретических расчетов нельзя считать окончательными. Точная величина энергии образования межузельного атома неизвестна. Наиболее достоверное значение для меди равно 3 эВ.
Искажение кристаллической решетки, вызываемое точечными дефектами. Когда в решетке кристалла возникает дефект, атомы, расположенные в непосредственной близости от него, перестраиваются в конфигурацию с минимальной энергией. Это смещение атомов представляет собой искажение решетки, связанное с наличием дефекта, и является важным свойством последнего. Как говорилось выше, это искажение, называемое атомной релаксацией, существенно снижает энергии образования и миграции дефектов.
Для того чтобы провести точный расчет релаксации атомов вокруг дефекта, нужно рассмотреть не только смещение атомов, являющихся его ближайшими соседями, но и ближайших соседей последних и т.д. Также необходимо учесть влияние новых положений атомов во второй координационной сфере на конфигурацию атомов, ближайших к дефекту, и т.д. Таким образом, расчет релаксации сводится к определению расположения атомов, соответствующего минимуму энергии, во всех координационных сферах, которые дают существенный вклад в полную энергию. Первые расчеты такого рода были проведены для меди с учетом релаксации только ближайших к дефекту соседей. Полученные результаты показывают, что ближайшие к вакансии соседи релаксируют в сторону вакансии приблизительно на 2 % (на рис.), в то время как релаксация ближайших соседей межузельного атома, для которого принимается объемно-центрированная конфигурация, составляет около 10 % (в направлении от дефекта).
Искажения решетки при удалении от дефекта убывают немонотонно. Так, хотя искажения во второй координационной сфере, окружающей вакансию, по абсолютной величине малы по сравнению с искажением в первой, они имеют противоположный знак, т.е. атомы смещены не по направлению к вакансии, что означает, что искажения вокруг точечного дефекта анизотропны.
Область вокруг дефекта, где создаются заметные смещения (порядка нескольких атомных параметров), называется ядром дефекта. в ОЦК металлах эти релаксационные сдвиги значительно больше, чем в ГЦК металлах, так как ОЦК решетка не является плотноупакованной.
Равновесная концентрация точечных дефектов сильно зависит от величины энергии образования и повышается с увеличением температуры. Концентрация вакансий при температуре плавления примерно постоянна для всех металлов и составляет 10–4, т.е. при повышенных температурах концентрация вакансии достигает достаточно высоких значений, что может оказать достаточно сильное влияние, а в ряде случаев (например, в случае диффузии) и определяет протекание физических процессов. Так как энергия образования межузельного атома в несколько раз больше энергии образования вакансии, то равновесная концентрация межузельных атомов даже при температуре, близкой к температуре плавления, очень мала (порядка 10–10 см–3). Поэтому при рассмотрении многих физических процессов равновесную концентрацию межузельных атомов можно не учитывать. Легирование чистых металлов должно привести к изменению равновесной концентрации точечных дефектов.
Кроме того, существуют так же дивакансии (две вакансии, расположенные в соседних узлах решётки) – они уже относятся к комплексам точечных дефектов. Например, если удаляется атом, соседствующий с вакансией так, что образуется вторая вакансия, то число связей, которые при этом надо разорвать, будет на одну меньше, чем число связей, разрываемых при образовании вакансий в изолированном положении. Поэтому для образования дивакансий требуется меньше энергии, чем для образования двух изолированных вакансий
Подвижность точечных дефектов. Точечные дефекты при определенных условиях могут перемещаться по кристаллической решетке. Рассмотрим сначала миграцию вакансии. Любой из атомов первой координатной сферы вакансии может совершить скачок и перейти на ее место. Это эквивалентно переходу вакансии на место одного из атомов первой координационной сферы.
Пусть, например, скачок совершает атом 2 (рис. а). Ему надо разорвать связи со своими ближайшими соседями 5, 6 и 7. Кроме того, атомы 1, 3 и 4 расположены ближе к вакантному узлу, чем в идеальной решетке. Поэтому атому 2 требуется совершить некоторую работу, чтобы раздвинуть эти атомы (рис. б). Соответственно, атомы, окружающие атом 2, будут смещаться к центру нового положения вакансии. Поэтому перемещение атома (и вакансии) требует некоторых обратимых затрат энергии.
Если нарисовать график зависимости энергии вакансии от по-ложения ее центра тяжести, то получится периодическая функция с периодом а (рис. 2.7).
В положениях, соответствующих узлам решетки, эта энергия имеет минимумы. Из соображений симметрии максимуму энергии должно соответствовать положение перескакивающего атома, равноудаленное от обоих узлов решетки, когда искажения максимальны. При дальнейшем движении атома (атом 2, рис. б) энергия снова понижается за счет релаксации (сближения атомов 5 и 6). Разница энергий в точках с x = 0 и x = 1/2a имеет, таким образом, смысл обратимой работы перемещения вакансий. Так как эта работа обычно больше kТ, то для скачка вакансии требуется ожидание тепловой флуктуации, и обратимая работа приобретает смысл энергии активации перемещения вакансии и обозначается Emv.
Экспериментально установлено, что для ГЦК металлов Emv ≈ 8kTпл ≈ EFv. Для ОЦК металлов энергия миграции вакансии несколько меньше, чем для ГЦК. Это объясняется более рыхлой решеткой, большими расстояниями между атомами, вследствие чего, атому при перескоке приходится преодолевать меньшее сопротивление со стороны соседей. Поэтому вакансии в ОЦК металлах более подвижны.
Таким образом, вакансии перемещаются по кристаллической решетке, что приводит, естественно, к перемещению атомов. Каждый атом какое-то время колеблется около определенного узла решетки, затем к нему подходит вакансия, и он перепрыгивает на ее место, меняя своих ближайших соседей. Такое перемещение атомов называется диффузией по вакансионному механизму. Перемещение атомов по собственной кристаллической решетке называется самодиффузией. Вообще для самодиффузии атомов в кристаллической решетке можно предположить несколько механизмов, но наиболее вероятным является вакансионный механизм.
Подвижность межузельных атомов должна быть значительно выше подвижности вакансий. Это следует из того, что объемно-центрированная и гантельная конфигурации близки друг другу по расположению атомов и энергии, и поэтому наиболее легкий путь перемещения межузельного атома есть последовательное изменение конфигурации: объемно-центрированная – гантельная – объемноцентрированная и т.д. (рис. 2.8), т.е. движение межузельного атома носит «эстафетный» характер.
Краудионная конфигурация занимает промежуточное положение между точечными и линейными дефектами. Действительно, ей отвечает лишний атом в цепочке вдоль какого-либо направления, чаще всего направления, вдоль которого расстояния между атомами минимальны. При этом смещения вокруг внедренного атома анизотропны: они велики вдоль направления краудиона и малы перпендикулярно ему. Поэтому размеры краудиона велики (до 10а) вдоль выделенного направления, т.е. похож на линейный дефект. Движение краудиона тоже отличается от обычного для точечных дефектов: его подвижность очень велика вдоль его направления и равна нулю для всех остальных направлений.
В настоящее время считается, что Emi ≈ 0,1Ev ≈ 0,1 эВ. Такой потенциальный барьер краудион может преодолевать за счет кинетической энергии.
Образование и отжиг точечных дефектов
Как было указано, точечные дефекты существуют в металлах при любой температуре выше абсолютного нуля, и их равновесная концентрация зависит от температуры.
Равновесная концентрация достигается и поддерживается за счет того, что дефекты диффундируют к внутренним и внешним стокам и от них. Поэтому в кристалле равновесие дефектов динамическое. Внутри совершенного кристалла, состоящего из атомов одного сорта, вакансии и межузельные атомы могут одновременно образовываться по известному механизму Френкеля – при уходе атома в межузлие из его нормального положения в узле решетки. Таким путем одновременно образуются вакансии и межузельные атомы при облучении металла частицами. Атом может выйти из узла в межузлие и в результате избытка энергии от соседей. Но вероятность этого процесса, как указывалось выше, крайне мала. Более легко происходит образование тепловых вакансий по механизму Шоттки, когда атом поверхностного слоя, приобретая избыток энергии от соседей, легко испаряется из кристалла или переходит в адсорбционный слой. В последнем случае не происходит полного разрыва всех межатомных связей. Через некоторое время на место атома поверхностного слоя переходит соседний атом из более глубокого слоя. Так образуется вакансия, переходящая вглубь кристалла. Кристалл как бы растворяет пустоту.
Источниками тепловых вакансий являются, таким образом, свободные поверхности кристалла, а также пустоты и трещины внутри него. В поликристалле границы зерен являются источниками вакансий с той же эффективностью, как и свободные поверхности. Вакансии могут образовываться и при взаимодействии и движении дислокаций. Если же кристалл пересыщен точечными дефектами, то эти источники могут действовать как стоки, т.е. места, куда мигрируют (стекают) точечные дефекты и где они исчезают. В таких случаях появляется термодинамическая движущая сила, которая стремится уменьшить концентрацию дефектов до равновесной величины, соответствующей данной температуре кристалла.
Отжигом дефектов называется процесс исчезновения дефектов из перенасыщенного ими кристалла. Избыточные дефекты могут удаляться из кристалла двумя различными путями: перемещением к стокам и рекомбинацией. Если в кристалле имеются дефекты одного типа, например, вакансии и их простые комплексы, то они исчезают только в стоках, простейшим из которых является внешняя поверхность. Однако в реальном кристалле всегда присутствуют внутренние поверхности, такие, как границы зерен. В свою очередь, точечные дефекты могут подождать дислокации, на которых сами же затем исчезают. Если имеются дефекты двух типов, которые способны взаимно уничтожать друг друга, то возможно их исчезновение за счет прямой рекомбинации. Наиболее важным примером подобного процесса является совмещение межузельного атома и вакансии, в результате которого оба эти дефекта перестают существовать.
Точечные дефекты существуют в металлах при любой температуре выше абсолютного нуля, однако их число в условиях равновесия при комнатной температуре мало. Для изучения поведения дефектов и влияния их на свойства металла желательно получить их в большом количестве. Существуют три основных метода:
1) закалка;
2) пластическая деформация;
3) облучение частицами высокой энергии.
Дислокации.
Краевая дислокация.
Наиболее простой и наглядный способ введения дислокаций в кристалл – сдвиг. На рис. 2.23 зафиксировано положение, когда сдвиг охватил не всю плоскость скольжения от правой грани до левой, а лишь часть плоскости скольжения. Участок ABCD – уча-сток плоскости скольжения, в котором произошел сдвиг на одно межатомное расстояние АВ – граница участка сдвига, b – вектор сдвига (вектор Бюргерса).
В результате сдвига на одно межатомное расстояние n вертикальных атомных плоскостей, расположенных выше плоскости скольжения, оказываются напротив (n–1) вертикальных атомных плоскостей, расположенных ниже плоскости скольжения.
Одна вертикальная атомная плоскость в верхней половине уже не имеет продолжения в нижней половине кристалла. Такую неполную атомную плоскость называют экстраплоскостью. Наиболее существенно то, что в некоторой области непосредственно вблизи края экстраплоскости внутри кристалла решетка сильно искажена. Выше края экстраплоскости межатомные расстояния меньше нормальных, а ниже края – больше. Атом на самой кромке экстраплоскости имеет меньше соседей, чем внутри совершенного кристалла. Таким образом, вдоль края экстраплоскости тянется область с несовершенной решеткой. Область несовершенства кристалла вокруг края экстраплоскости называется краевой дислокацией.
В одном измерении область несовершенства такая же, как и длина края экстраплоскости. В плоскости, перпендикулярной краю экстраплоскости, область рассматриваемого несовершенства имеет малые размеры: до десяти атомных диаметров. Можно мысленно представить, что рассматриваемая область несовершенства находится внутри трубы, осью которой является край экстраплоскости. Эта область называется ядром дислокации. Истинное положение атомов в ядре дислокации расчетным путем не удалось пока установить, и в металлических кристаллах оно остается неизвестным. Если разрез провести снизу и вставить полуплоскость, то вся картина изменится на обратную. Для обозначения дислокаций общего вида принят символ ┴. «Ножка» этого символа направлена в сторону расположения избыточного материала. Принято, что ┴ – положительная, а ┬ – отрицательная дислокации, хотя это чисто условно. Основное, что надо отметить, это то, что линия краевой дислокации перпендикулярна вектору сдвига. Так как вектор сдвига определяется вектором b, то отсюда следует, что b⊥t, где t – единичный вектор в направлении линии дислокации.
Теперь сделаем в кристалле надрез по ABCD и произведем сдвиг одной части кристалла вниз на один период решетки (рис. 2.25). Образовавшаяся при таком сдвиге ступенька на верхней грани не проходит через всю ширину кристалла, оканчиваясь в точке В. У переднего края кристалла (вблизи точки А) сдвиг произошел ровно на один период решетки так, что верхняя атомная плоскость справа от точки А сливается в единое целое со второй сверху плоскостью слева от точки А. Так как надрез ABCD дошел только до половины кристалла, то правая часть кристалла не может целиком сдвинуться по отношению к левой на один период решетки. Величина смещения правой части по отношению к левой уменьшается по направлению от точки А к В. Верхняя атомная плоскость оказывается изогнутой. Точно также деформируется вторая, третья и т.д. атомные плоскости. Если до деформации (сдвига) кристалл состоял из параллельных горизонтальных атомных слоев, то после несквозного сдвига по плоскости ABCD он превратился в одну атомную плоскость, закрученную в виде геликоида (винтовой лестницы). Ось ВС называется линией винтовой дислокации. При обходе вокруг линии винтовой дислокации мы поднимаемся или опускаемся на один шаг винта, равный межатомному расстоянию. Правовинтовая дислокация – это когда линию дислокации от верхнего горизонта к нижнему следует обходить по спирали по часовой стрелке. Если b↑↑t, то это – правовинтовая дислокация. Левовинтовая дислокация – это когда линию дислокации от верхнего горизонта к нижнему следует обходить по спирали против часовой стрелки. Если b↑↓t, то дислокация левовинтовая. Правую дислокацию нельзя превратить в левую винтовую дислокацию простым переворачиванием кристалла (рисунка), как это можно было сделать для превращения положительной кревой дислокации в отрицательную и наоборот.
Движение дислокаций
Скольжение краевой дислокации.
Рассмотрим механизм скольжения краевой дислокации – перемещение дислокации по направлению вектора b. В этом случае плоскость, определяемая двумя взаимно перпендикулярными векторами b и t, является единственной и называется плоскостью скольжения. В процессе скольжения краевая дислокация плоскость скольжения менять не может. На рис. 2.29, в в исходном состоянии положение атомов обозначено светлыми кружками, а в конечном – черными (рис. 2.29).
Чтобы дислокация из исходного положения 1 переместилась в соседнее положение 14, не нужно сдвигать всю верхнюю половину кристалла на одно межатомное расстояние. Достаточно, чтобы произошли следующие перемещения атомов: атом 1 в положение 2, 3 – в 4, 5 – в 6, 7 – в 8, 9 – в 10, 11 – в 12, 13 – в 14, 15 – в 16, 17 – в 18. Аналогично смещаются атомы во всех плоскостях, параллельных плоскости рисунка. Только одна плоскость 7–17 разрывается на две части. Ее нижняя часть объединяется с экстраплоскостью в целую плоскость 8–6, а верхняя превращается в экстраплоскость 14–18. Под действием касательных напряжений дислокация перемещается в плоскости скольжения путем указанных выше перемещений атомов. Скольжение дислокации не обусловлено диффузионными перемещениями атомов и может происходить, в принципе, при каких угодно низких температурах.
Переползание краевой дислокации. Рассмотрим случай, когда дислокация движется перпендикулярно плоскости скольжения. Если обратиться к рис. 2.24, то это означает «прорастание» или «растворение» экстраплоскости.
Механизм такого перемещения, называемого переползанием, принципиально отличен от механизма скольжения. Для перемещения положительной краевой дислокации из своей плоскости скольжения в вышестоящую соседнюю плоскость необходимо, чтобы цепочка атомов на самой кромке экстраплоскости отделилась и ушла вглубь кристалла. Такое растворение кромки экстраплоскости (положительное переползание) является диффузионным процессом. Возможны два варианта:
1) при подходе вакансий к краевой дислокации атомы с кромки экстраплоскости перемещаются в соседние вакантные места;
2) атомы с кромки переходят в междоузлия и диффундируют от дислокации.
Первый вариант более вероятен, если учесть, что в металле легче появляется избыточная концентрация вакансий, а энергия образования межузельных атомов относительно велика. Перемещение положительной краевой дислокации вниз в соседнюю плоскость скольжения означает, что к краю экстраплоскости присоединился один атомный ряд. Такая достройка атомной экстраплоскости (отрицательное переползание) может осуществляться также двумя путями:
1) присоединением межузельных атомов, диффундирующих к дислокациям;
2) присоединением соседних атомов, находящихся в регулярных положениях, с одновременным образованием вакансий, которые затем мигрируют вглубь кристалла. Этот вариант маловероятен.
Таким образом, перемещение краевой дислокации по нормали к своей плоскости скольжения осуществляется путем диффузионного перемещения атомов, и именно этим оно отличается от скользящего движения дислокации.
В отличие от скольжения (консервативного движения), не связанного с переносом массы, переползание (неконсервативное движение) происходит путем переноса массы. Диффузия является термически активируемым процессом, следовательно, переползание также термически активируемый процесс, скорость которого сильно зависит от температуры. В действительности перенос массы к кромке экстраплоскости или от нее происходит путем миграции отдельных вакансий или межузельных атомов или небольших их комплексов, и дислокация переползает в новую плоскость скольжения не одновременно по всей длине, а по частям с образованием порогов на дислокации
Движение винтовой дислокации. Винтовая дислокация в отличие от краевой перемещается по механизму скольжения по направлению перпендикулярно вектору Бюргерса. Схема механизма перемещения винтовой дислокации на атомном уровне показана на рис. 2.35, где изображено расположение атомов в двух вертикальных плоскостях, проходящих непосредственно по обе стороны от плоскости сдвига ABCD. Если смотреть на них со стороны правой грани кристалла то черные кружки обозначают атомы на вертикальной плоскости слева от плоскости сдвига, а светлые кружки – атомы на вертикальной плоскости справа от плоскости сдвига. Заштрихована образовавшаяся при сдвиге ступенька на верхней грани кристалла.
Плоскость скольжения ABCD совпадает с плоскостью чертежа; атомы, обозначенные черными кружками, находятся под плоскостью чертежа, а обозначенные светлыми кружками – над ней. Стрелка, направленная сверху вниз, обозначает сдвигающие напряжения, приложенные к той части кристалла, которая находится над плоскостью чертежа, т.е. правее плоскости ABCD (см. рис. 2.25). Стрелка, направленная снизу вверх, обозначает сдвигающие напряжения, приложенные к той части кристалла, которая находится под плоскостью чертежа на рис. 2.35, т.е. левее плоскости ABCD на рис. 2.25.
Правее линии ВС (см. рис. 2.35), между атомными рядами 7 и 14, положения белых, и черных кружков совпадают, т.е. соответствующие атомы находятся на одном горизонте. Та же картина наблюдается на некотором расстоянии слева от линии ВС, между атомными рядами 1 и 5. Вокруг же линии ВС, между атомными рядами 5 и 7, атомы, обозначенные черными и белыми кружками, т.е. находящиеся под плоскостью чертежа и над ней, образуют винтовую поверхность.
Следует подчеркнуть, что это только схематическая модель расположения атомов в ядре дислокации, позволяющая рассматривать некоторые процессы, протекающие в кристаллах. Точное расположение атомов в ядре дислокации неизвестно, хотя в последнее время появляются работы, как правило, расчетного характера с применением компьютерного моделирования, посвященные этому вопросу.
Пунктирные линии на рис. 2.35 соединяют атомы после перемещения (скольжения) винтовой дислокации на один период решетки вправо. Если в исходном положении область несовершенства находилась между атомными рядами 5 и 7, то после смещения на один период решетки вправо она находится между рядами 6 и 8. Атомы над плоскостью чертежа (белые кружки) под действием сдвигающих напряжений, обозначенных верхней стрелкой, смещаются вниз. Атомы под плоскостью чертежа (черные кружки) под действием сдвигающих напряжений, обозначенных нижней стрелкой, смещаются вверх.
Необходимо обратить внимание на три важных обстоятельства. Во-первых, дислокация перемещается на один период решетки вправо в результате передвижений атомов только внутри области несовершенства; атомы вне области несовершенства остаются на своих местах. Во-вторых, дислокация перемещается на один период решетки вследствие передвижения атомов внутри ядра дислокации всего лишь на доли периода решетки. В этом отношении скольжение винтовой дислокации аналогично скольжению краевой дислокации. В-третьих, в области ядра винтовой дислокации атомы смещаются в направлении действующих на них сил (вниз и вверх на рис. 2.35), а сама дислокация перемещается перпендикулярно этому направлению. Последнее также отличает винтовую дислокацию от краевой.
Перемещение винтовой дислокации увеличило площадь ступеньки и площадь зоны сдвига. При продвижении винтовой дислокации слева направо область сдвига постепенно распространяется на всю ширину кристалла. На рис. 2.36 показан сдвиг на одно межатомное расстояние при пробеге правой винтовой дислокации через весь кристалл.
Под действием одинаковых сдвигающих напряжений винтовые дислокации разного знака скользят в прямо противоположных направлениях (рис. 2.37,а). Винтовая дислокация не характеризуется однозначно плоскостью сдвига. Действительно, винтовая дислокация обладает цилиндрической симметрией. Плоскостью сдвига может быть любая вертикальная плоскость, проходящая через линию ВС (см. рис. 2.35). Соответственно схема перемещений атомов на рис. 2.37, обеспечивающих скольжение винтовой дислокации, также справедлива для любых плоскостей, проходящих через линию ВС (см. рис. 2.35).
В отличие от краевой винтовая дислокация может переходить из одной плоскости скольжения в другую без переноса массы. Если на пути движения винтовой дислокации в плоскости Р (рис. 2.37,б) встречается какой-то барьер, то дислокация начинает скользить в другой атомной плоскости R, находящейся под углом к первоначальной плоскости скольжения P. Этот процесс называют поперечным скольжением.
Пройдя некоторый путь в плоскости поперечного скольжения и удалившись от барьера, винтовая дислокация может перейти в атомную плоскость S, параллельную первоначальной плоскости скольжения Р. Этот процесс называют двойным поперечным скольжением. Многократное его повторение называют множественным поперечным скольжением.
Узлы (положения атомов), направления в плоскости и пространстве обозначаются с помощью так называемых индексов Миллера. Положение любого узла кристаллической решётки относительно произвольно выбранного начала координат определяют заданием координат x,y,z.
Таким образом, структура кристалла, будучи физической реальностью, состоит из атомов, а пространственная решетка как способ представления периодичности повторения в пространстве гомологических точек состоит из узлов. |
 Скачать 44.92 Kb.
Скачать 44.92 Kb.
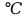 - серое олово с решеткой алмаза, выше 13,2
- серое олово с решеткой алмаза, выше 13,2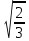 = 1,633.
= 1,633.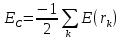 . E(r) – потенциальная энергия взаимодействия атома с другим атомом решетки, находящимся от него на расстоянии r, k – индекс суммирования по всем атомам решетки, а коэффициент 1/2 необходим для того, чтобы избежать двукратного учета парных взаимодействий.
. E(r) – потенциальная энергия взаимодействия атома с другим атомом решетки, находящимся от него на расстоянии r, k – индекс суммирования по всем атомам решетки, а коэффициент 1/2 необходим для того, чтобы избежать двукратного учета парных взаимодействий.