ФХМА. Физикохимические методы анализа
 Скачать 60.99 Kb. Скачать 60.99 Kb.
|
|
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Физико-химические методы анализа основаны на том, что анализируемый объект подвергают химическим превращениям, при этом измеряют физико-химические свойства вещества (аналитический сигнал), которые регистрируются приборами. Аналитический сигнал Хi зависит от природы и концентрации определяемого вещества. Физические методы анализа основаны на измерении физических характеристик, которые зависят от индивидуальных свойств вещества (показатель преломления, теплопроводность и т. д.). В этих методах не применяются химические или электрохимические реакции. Физико-химически и физические методы составляют группу инструментальных методов анализа. Классификация инструментальных методов по приемам применения По принципу измерения аналитического сигнала и получению информации о количественном содержании вещества различают прямые и косвенные методы анализа. Прямые методы основаны на зависимости аналитического сигнала от природы вещества и его концентрации. 1. Метод градуировочного графика. Для серии стандартных образцов измеряют интенсивность аналитического сигнала Хi и строят градуировочный график Хi = f(с). В тех же условиях измеряют Хi анализируемого раствора и по графику находят сх. Угол наклона градуировочного графика характеризует чувствитель- Хi ность метода. Чем больше α, тем выше чувствительность метода, т.е. тем меньшие концентрации вещества позволяет этот метод определять. Идеальный вариант, когда α = 45О. 2. Метод добавок. Измеряют интенсивность аналитического сигнала пробы Хi с концентрацией сх. Затем в пробу вводят известное количество стандартного вещества с концентрацией сст и вновь измеряют аналитический сигнал Хi+ст. Величина аналитического сигнала пропорциональна концентрации вещества. Составляют и решают систему уравнений и находят концентрацию сх: Хi = К сх
Метод добавок применяется при анализе сильно разбавленных растворов или при влиянии присутствующих примесей на аналитический сигнал. Косвенные методы (методы титрования) основаны на зависимости аналитического сигнала от объема добавляемого титранта. Графическое изображение зависимости называется кривой титрования. СПЕКТРАЛЬНЫЕ И ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Спектральные и оптические методы анализа основаны на взаимодействии определяемого вещества и электромагнитного излучения (ЭМИ). Методы классифицируются по нескольким признакам – принадлежности ЭМИ к определенной части спектра (УФ-спектроскопия, фотоэлектроколориметрия, ИК-спектроскопия), уровню взаимодействия вещества с ЭМИ (атом, молекула, ядро атома), физическим явлениям (эмиссия, абсорбция и т.д.). Классификация спектральных и оптических методов по основным признакам приведена в табл. 1.
Электромагнитное излучение из каждого диапазона длин волн несет разную энергию Е = hν (h – постоянная Планка, 6,62·10–34 Дж·с; ν – частота колебания электромагнитной волны, с–1) и поэтому по-разному взаимодействует с веществом, вызывая при этом различные физические явления. Уровень взаимодействия при этом также различен. В соответствии с этим различают атомную и молекулярную спектроскопию. Часть молекулярной спектроскопии, которая изучает свойства веществ в волновом и видимом диапазоне длин волн составляет оптические методы анализа. АТОМНО-ЭМИССИОННАЯ СПЕКТРОСКОПИЯ. ФОТОМЕТРИЯ ПЛАМЕНИ Атомно-эмиссионная спектроскопия – группа методов анализа, основанных на измерении длины волны и интенсивности светового потока, излучаемого возбужденными атомами в газообразном состоянии. При эмиссионном анализе определяемое вещество, находящееся в газовой фазе, подвергают возбуждению, сообщая системе энергию в виде ЭМИ. Валентные электроны атома переходят на более высокий энергетический уровень. Энергия, необходимая для перехода атома из нормального в возбужденное состояние, называется энергией возбуждения (потенциалом возбуждения). В возбужденном состоянии атом находится 10–9–10–8 с, затем, возвращаясь на низкий энергетический уровень, испускает квант света строго определенной частоты и длины волны. Приборами фиксируют длину волны испускаемую атомом и получают линейчатый атомный спектр, который состоит из набора отдельных линий. Элементы, содержащиеся в пробе, идентифицируют по набору спектральных линий (на основании частот или длин волн) испускаемого ЭМИ. Количественный анализ основан на измерении интенсивности спектральных линий элементов. Фотометрия пламения – метод анализа, основанный на фотометрировании излучения возбужденных в пламени атомов. Вследствие невысокой температуры в пламени возбуждаются спектры элементов, имеющих низкую энергию возбуждения, – щелочные и щелочноземельные металлы. При использовании наиболее распространенного пламени природного газа в смеси с воздухом (t = 1700–1900 ОС) определяют 12 щелочных и щелочноземельных металлов, медь, серебро (табл. 3). Изменяя характеристику пламени, можно увеличить число определяемых элементов Аналитические линии важнейших элементов
Таблица 4
Возбуждению атомов в пламени предшествуют другие процессы, происходящие в пламени: испарение растворителя, кристаллизация пробы, сублимация (возгонка) твердого вещества, термическая диссоциация (распад молекулы на атомы). Под действием температуры пламени атомы металла переходят в возбужденное состояние (Me• Качественный анализ проводят по окраске перлов пламени и характерным спектральным линиям элементов (табл. ). Количественный анализ основан на эмпирической зависимости интенсивности спектральной линии (I) определяемого элемента от его концентрации в пробе. 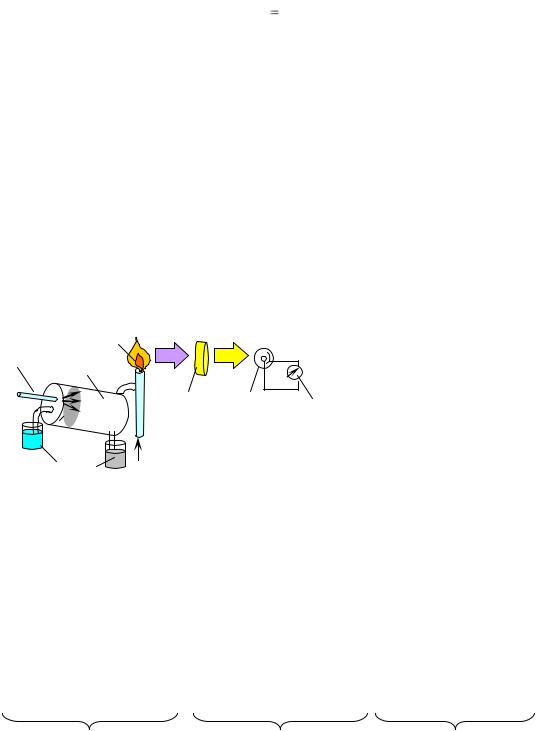 Схема пламенного фотометра: 1 – сосуд с анализируемым раствором; 2 – трубопровод от компрессора; 3 – распылитель; 4 – сосуд с конденсатом; 5 – пламя; 6 – светофильтр; 7 – фотоэлемент; 8 – микроамперметр I a где а – коэффициент, зависящий от режима работы источника возбуждение (температуры и стабильности пламени); b – коэффициент самопоглощения. Для определения концентрации металла в пробе применяют методы градуировочного графика и добавок. Устройство пламенного фотометра. Схема пламенного фотометра представлена на рис. 2. Анализируемый раствор через капилляр 1 под действием сжатого воздуха от компрессора 2 всасывается в распылитель 3 и в виде мелкодисперсного аэрозоля поступает в пламя горелки 5, предварительно смешиваясь с горючим газом. Конденсат выводится из распылителя и собирается в сосуде 4. Возбужденные в пламени атомы элементов излучают свет определенной длины волны. Для устранения мешающего влияния излучения других элементов в приборе имеется система чувствительных селективных светофильтров 6, позволяющих выделить из общего светового потока излучение определяемого элемента. Монохроматический световой поток, попадая на фотоэлемент 7, вызывает фототок, интенсивность которого регистрирует микроамперметр 8. Измеряемая прибором величина – интенсивность излучения I, мкA. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ Молекулярная спектроскопия объединяет методы анализа, в которых уровень взаимодействия ЭМИ с веществом – молекула. Спектроскопию характеризуют по ряду признаков: 1.По области электромагнитного излучения:
2. В зависимости от характера взаимодействия излучения с веществом все спектры и методы делятся: а) спектры поглощения – молекулярная абсорбционная спектроскопия. б) спектры испускания – молекулярно-эмиссионная спектроскопия. в) спектры рассеяния – спектроскопия рассеяния. МОЛЕКУЛЯРНО-АБСОРБЦИОННАЯ СПЕКТРОСКОПИЯ (МАС) МАС – совокупность методов анализа, в основе которых находятся качественная и количественная обработка спектров поглощения молекул в ближайшей УФ, видимой и ИК областях спектра. МАС основана на поглощении (абсорбции) света молекулами вещества. По аналогии с атомной спектроскопией, в молекулярной, молекулы обладают энергией Е. Попадая в электромагнитное излучение, молекула поглощает квант света (фотон) М + hν
1.Переход электрона на более высокую орбиталь. –Eē энергия электронного перехода. E0 2. Так как молекула более сложная система, чем атом, часть светового излучения воздействует на изменение энергии колебания атома в молекуле. Екол. – энергия колебания атомов 3.Часть светового излучения расходуется на изменение энергии вращения группы атомов в молекуле. Евр. – энергия вращения. Энергия молекулы – аддитивная величина. Е = Евр. + Екол. + Eē Энергия вращательного, колебательного и электронного движения не равны друг другу и соотносятся как: Евр.< Екол. < Eē 1 : 100 : 1000 В зависимости от того, какие энергетические состояния молекул участвуют в образовании спектров, различают спектры вращательные, колебательные и электронные. В каждой области спектра фотоны характеризуются определенной энергией. Колебательная и вращательная составляющие очень малы и энергии фотона в ИК области спектра и микроволновой достаточно чтоб возбудить вращательные и колебательные уровни энергии. Вращательные изменения в молекуле присутствуют всегда, даже при перепаде температур. Если результат поглощения электромагнитного излучения молекулой разложить в широкий спектр длин волн, то на спектре будут наблюдаться темные полосы поглощения. Молекулярные спектры являются полосатыми. Получить чисто колебательные спектры не удается, на них налагаются вращательные спектры. Дальнейшее увеличение энергии фотона приводит к возбуждению электронов и появлению в спектре полос, характеризующих электронные переходы. Энергии фотона в УФО достаточно для электронных переходов в молекулах неорганических соединений с ковалентной координационной связью и молекулах органических веществ с двойной –С=С– связью (ароматические). В дальнейшей УФО энергии фотона достаточно для получения спектра ненасыщенных соединений (углеводороды). Электронные спектры поглощения самые сложные, т.к. на них полагаются вращательные и колебательные абсорбционные спектры. Величина энергии Е1, Е2… и т.д. строго индивидуальна (регламентирована) для каждой молекулы и связана с длиной волны света:
h - постоянная Планка; с - скорость света. Молекула поглощает свет строго определенной длины волны. Эта зависимость находится в основе качественного анализа. С аналитической точки зрения для качественного и количественного анализа необходимы две характеристики: 1)длина волны – λ, которая максимально поглощается данным сортом частиц (молекул);
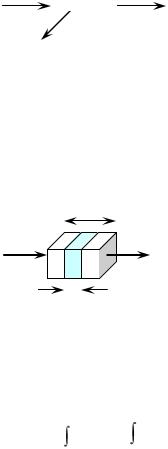 светопоглощ. слой Законы светопоглощения Закон Бугера-Ламберта: Слои равной толщины при прочих равных условиях поглощают равную долю падающего монохроматического излучения. В 1852 г. Альберт Бер проверил справедливость закона Бугера-Ламберта для растворов и установил, что коэффициент светопоглощения зависит от концентрации: k = k'с
I Если в уравнении Бугера-Ламберта-Бера концентрация выражена в моль/дм 3, а толщина поглощающего слоя в см, то оно примет вид:
моль Молярный коэффициент светопоглощения – это мера чувствительности фотометрических методов. Чем больше ε, тем выше чувствительность метода, тем меньшую концентрацию вещества можно определить. Факторы, влияющие на ε: 1. Природа вещества
4.рН раствора. ε может уменьшаться или увеличиваться (Например: чай с лимоном – ε уменьшается). 5.Длина волны (λ). Кривая распределения Гаусса описывает зависимость ε от λ и называется спектром поглощения раствора. ε λ опт λ, нм 6. Температура. Молярный коэффициент светопоглощения не зависит от концентрации и толщины поглощающего слоя. Физический смысл ε: если с = 1 моль/дм 3, а толщина слоя l = 1 см, то ε = А.
с Закон аддитивности Основной закон светопоглощения, описывающий поглощение смесью веществ называется за- коном аддитивности: Если через систему, содержащую несколько окрашенных частиц различного сорта, пропустить электромагнитное излучение, то оптическая плотность, есть сумма оптических плотностей растворов индивидуальных веществ: А А Аппаратура метода Все приборы МАС имеют несколько основных узлов, функции которых одинаковы, несмотря на разнообразие схем. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
