Схема производства соды аммиачным способом. ФХ основы получения кальцинированной соды.. Физикохимические основы получения кальцинированной соды по аммиачному способу Сольве. Сырьевая база, основные стадии и отходы производства
 Скачать 2.32 Mb. Скачать 2.32 Mb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования ИВАНОВСКИЙ ГОСУДАРСТВЕННЫЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ Кафедра технологии неорганических веществ Реферат Тема: Физико-химические основы получения кальцинированной соды по аммиачному способу Сольве. Сырьевая база, основные стадии и отходы производства. Выполнила: Резанова А.Н. магистрант 172 группы Проверил: Кунин А.В. Иваново, 2022г. Содержание Введение. Краткая история развития содовой промышленности 3 Сода кальцинированная техническая ГОСТ 5100-85. По физико-химическим показателям техническая кальцинированная сода должна соответствовать нормам, указанным в таблице. 5 Описание технологического процесса 6 Переработка вторичных материальных ресурсов производства соды аммиачным способом 13 Меры предосторожности. Техническая кальцинированная сода относится к веществам 3-го класса опасности. 17 Библиографическая ссылка 18 Введение. Краткая история развития содовой промышленности Сырье, используемое в производстве кальцинированной соды Описание технологического процесса Основное оборудование Переработка вторичных материальных ресурсов производства соды аммиачным способом Список литературы Введение. Краткая история развития содовой промышленностиСода была известна еще в глубокой древности в качестве вещества, применявшегося для чистки и шипевшего при соприкосновении с уксусом. Добывалась она до конца восемнадцатого века преимущественно из естественных месторождений Венгрии, Египта и других частей Африки и из золы морских растений, преимущественно в Испании. Сода того времени не отличалась чистотой. В 1775 г. французская академия объявила премию в 12 тыс. ливров за лучший способ приготовления соды из поваренной соли. Однако удачного разрешении задачи в то время найти не удалось. И только, когда наступила французская революция 1789 – 1794гг., и Франция, испытавшая блокаду и окруженная войсками коалиции, была отрезана от подвоза иностранного сырья и товаров, - Комитетом общественного спасения вновь был объявлен призыв ко всем гражданам – найти путь освобождения отечественной промышленности от зависимости от заграничных товаров и материалов. Ответом на призыв явились 16 предложений фабрикации соды, из коих первенство отдано было методу, автором которого был врач Николай Леблан. Аммиачный способ (способ Сольве.) В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день. В основу аммиачного способа производства соды, изобретенного Э. Сольве, была положена реакция обменного разложения хлористого натрия и бикарбоната аммония, в результате которой получались бикарбонат натрия и хлористый аммоний. После прокаливания осадок бикарбоната натрия превращался в карбонат натрия, или кальцированную соль. До сих пор этот способ остаётся основным способом получения соды во всех странах. Преимущества аммиачного способа производства соды: относительная дешевизна, широкая распространенность и доступность извлечения необходимого сырья; незначительность температур (до 100 градусов С), при которых осуществляются основные реакции процесса; достаточная отлаженность способа производства соды; невысокая себестоимость кальцинированной соды. Сырье, используемое в производстве кальцинированной соды Производственное предприятие, независимо от того, к какой отрасли оно принадлежит, сможет лишь тогда развиваться и приносить прибыль, когда оно построено на здоровой основе. Для этого необходимо, прежде всего, чтобы оно было расположено в таком пункте, где легче всего достать сырье и материалы производства, а также хороших рабочих, и где, равным образом, лучше и выгоднее сбывать продукты производства, не нуждаясь для этого в особых сложных перевозочных средствах. Это основное положение для организации рационально работающего предприятия в особенности должно быть отнесено к содовым заводам, так как экономичность работы их определяется главным образом стоимостью основных видов сырья и топлива, в частности соли, известняка или мела, аммиачной воды, каменного угля и кокса. В виду значительных расходных величин этих продуктов, содовые заводы строятся обычно или непосредственно на данном сырье и топливе, или вблизи последних, чтобы стоимость транспорта этих сырьевых материалов не ложилась тяжелым накладным расходом на стоимость их добычи. Соль (рассол). В аммиачном способе производства соды применяют не твердую соль, а рассол, что является большим преимуществом, так как добыча рассола путем подземного выщелачивания соли водой значительно дешевле добычи твердой соли обычным шахтным способом. Использование для приготовления рассола твердой соли, поднятой на поверхность земли, допустимо только в тех случаях, когда поваренная соль является отходом производства. 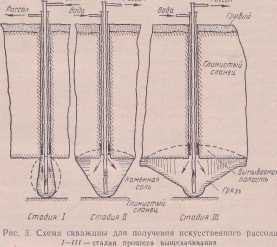 Рис.1 схема скважины для получения искусственного рассола: Ι−ΙΙΙ – стадии выщелачивания. Известняк и мел. Вторым основным сырьевым материалом для производства соды служит известняк или мел. Более предпочтительным сырьем является известняк. Недостатком мела является его пористая порода, он легко впитывает влагу, нарушающая нормальный ход обжига его в известковых печах. Обычно считается, что наилучшим сырьем является известняк с содержанием от 92% CaCO3, влаги от 1 до 5% и минимальным количеством силикатов, хотя возможны отступления от этих условий, в зависимости от характера производств. Кальцинированная сода встречается в природе в больших количествах, главным образом в соляных пластах и отложениях троны (минерала состава Na2CO3·NaHCO3·2H2O). На Земле известны более 60 таких месторождений. Сода кальцинированная техническая ГОСТ 5100-85. По физико-химическим показателям техническая кальцинированная сода должна соответствовать нормам, указанным в таблице.
Описание технологического процессаПроизводство кальцинированной соды по аммиачному способу включает 8 основных переделов: получение карбонатного сырья: вскрыша, взрывные работы, добыча, дробление, сортировка сырья и транспортирование; переработка карбонатного сырья: обжиг, охлаждение и очистка диоксида углерода, гашение извести с получением известковой суспензии; очистка рассола: взаимодействие сырого рассола с реагентами в реакторах и отстой рассола; абсорбция: отмывка в промывателях газов, выделяющихся на других стадиях, от аммиака, двух стадийное насыщение раствора хлорида натрия аммиаком и частично диоксидом углерода, поступающим со стадии дистилляции, охлаждение аммонизированного рассола; карбонизация: отмывка от аммиака газа, покидающего стадию карбонизации (сопровождается улавливанием диоксида углерода), предварительная карбонизация, карбонизация с выделением гидрокарбоната натрия в осадительных колоннах, компримирование (перед подачей в карбонизационные колонны) диоксид углерода, поступающего со стадий переработки сырья и кальцинации; фильтрация: отделение гидрокарбоната натрия на фильтрах и отсос воздуха вакуум – насосами; кальцинация: обезвоживание и разложение гидрокарбоната натрия в содовых печах, охлаждение и очистка диоксида углерода после содовых печей; регенерация аммиака (дистилляция): предварительный подогрев и диссоциация содержащихся в фильтровой жидкости карбонатов и гидрокарбонатов аммония в конденсаторе и теплообменнике дистилляции, смешение и взаимодействие нагретой жидкости с известковой суспензией в смесителе и отгонка аммиака в дистиллере. Весь содовый процесс полностью может быть изображен следующими химическими уравнениями: 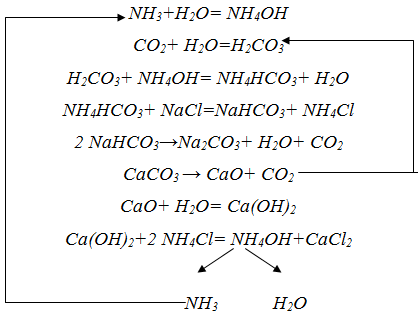 Взаимную связь реакций можно изобразить следующей схемой: 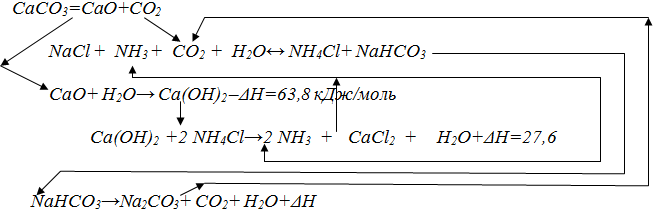 Реализация химической модели сопряжена с разработкой технологического режима с использованием физико-химических свойств водной четырехкомпонентной системы. В водном растворе существуют четыре компонента NaCl – NH4HCO3 - NH4Cl – NaHCO3 (независимых компонентов – четыре, ибо если известны значения трех компонентов, то по уравнению реакции можно рассчитать содержание четвертого.) Соль NH4HCO3 образуется в результате взаимодействия в растворе СО2 и NH3: СО2 (p) + 2NH3(p)↔NH2COONH4(p) – ΔΗ1 Образовавшийся карбамат гидролизуется: NH2COONH4(p) + H2O ↔ NH4HCO3(р) + NH3(p) + ΔΗ2 - ΔΗ + ΔΗ= -63,8 кДж Температурный режим избран по результатам исследования реакций, а материальные расчеты и соотношения реагирующих компонентов определены по данным о четырехполюсной системе. Ниже приведены графические методы разработки технологического режима для реакций такого типа. На основании диаграммы (рис.1) устанавливают, что хлорид натрия взаимодействует с бикарбонатом аммония, образуя бикарбонат натрия и хлорид аммония, и растворимость бикарбоната натрия в этой системе мала, так как в равновесном растворе 1 моль бикарбоната растворяется в 4240 молях воды, т.е. практически впадает в твердую фазу. Проекция диаграммы на квадрат солевого состава представлена на рис.2 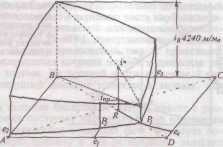 Рис. 3. Система Na+, NH+4║Cl-, HCO3- - H2O, Т 30єС: А-NaС1; B-NaHCO3; C-NH4HCO3; D - NH4C1; i-количество Н2О - молей воды/1 моль Σ солей; i* -равновесное, inp - практическое R-отношение А : С, вступающих в реакцию; Р – солевой состав раствора 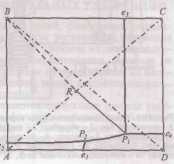 Рис.4. Проекция системы Na+, NH4+║Cl-, HCO-3- H2O, Т 30єС: А-NaС1; B-NaHCO3; C-NH4HCO3; D - NH4C1; e – солевой состав эвтонических растворов двухкомпонентных систем; Р – нонвариантные точки четырех - компонентной системы; R – солевой состав реакционной смеси Стабильной диагональю солевого квадрата, которая пересекает только два полюса кристаллизации, является диагональ бикарбоната натрия – хлорид аммония, соотношение между реагирующими компонентами выбирают графически по проекции диаграммы, учитывая необходимость получения бикарбоната натрия, не содержащего в твердой фазе аммонийных солей. Иллюстрацией этого приема служит рис 3. Он заключается в создании в растворе несколько увеличенного содержания воды по сравнению с нонвариантной фигуративной точкой Р1, на которую направлен луч кристаллизации. 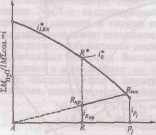 Рис.5 Сечение диаграммы по ARP1: i*LBN – количество воды в равновесном растворе; iR.пр – количество воды в технологическом растворе; ip1 - количество воды в растворе Р1; R – фигуративная точка реакционной смеси. Основное оборудование кальцинированный сода аммиачный хлорид Сущность процесса может быть выражена таким образом, что при обработке насыщенного аммиаком рассола углекислым газом сперва происходит как – бы нейтрализация этого раствора углекислотой, сопровождающаяся значительным выделением тепла, а в дальнейшем, по мере повышения в растворе концентрации средней углеаммониевой соли, начинается ее обменное разложение с поваренной солью с образованием соды, которая при дальнейшем действии на раствор углекислоты образует наименее растворимое соединение – бикарбонат. С практической точки зрения является интересным не только ход реакции и достижение наилучшего выхода бикарбоната, но и качество (физические свойства, структура) получаемого осадка бикарбоната. В заводских условиях, когда выпадение бикарбоната начинается при несколько повышенной температуре, а рост кристаллов – при охлаждении, получается крупно - кристаллический, хорошо отстаивающийся, хорошо фильтрующийся и хорошо промывающийся осадок. Пределом охлаждения на заводах чаще всего является температура 28 – 30єС, но иногда и ниже – до 25єС. Структура осадка имеет большое значение, так как легкость и скорость фильтрации и промывки сокращает расход пара на дистилляцию маточных жидкостей, а, кроме того, уменьшает остающуюся в бикарбонате после фильтрации влажность, что в свою очередь облегчает кальцинацию осадка и сокращает расход топлива на этот процесс. Слишком сильное охлаждение вызывает образование очень мелкого, илообразного осадка, который трудно фильтруется и нарушает и удорожает нормальный ход производства.  Схема производства соды аммиачным способом: 1-напорный бак; 2-абсорбер; 3-карбонизационная (осадительная) колонна; 4-холодильник; 5-фильтр; 6-колонна дистилляции (дистиллятор); 7-содовая печь (сушилка); 8-компрессор; 9-промыватель газа известковообжиговых печей; 10-известковообжиговя печь; 11-аппарат для гашения извести.  Переработка вторичных материальных ресурсов производства соды аммиачным способомИз технологического цикла производства кальцинированной соды аммиачным способом выводятся дистиллерная суспензия, которую можно разделить на осветленную жидкость и твердый шлам; твердые шламы после стадии рассолоочистки; газообразные вещества. Если газовые выбросы содержат вещества в пределах предельно допустимых норм, их выводят в атмосферу. Однако осветленную дистиллерную жидкость и твердые шламы необходимо перерабатывать в продукты, полезные для хозяйственной деятельности человека. В связи с этим осветленную дистиллерную жидкость и шламы следует рассматривать не как отходы содового производства, а как вторичные материальные ресурсы (BMP). В литературе широкое распространение получили термины «безотходная» и «малоотходная» технология получения того или иного продукта. При создании малоотходной, или экологически рациональной, технологии стремятся обеспечить потребность в данном продукте наиболее полным использованием природных ресурсов (материальных и энергетических), т. е. предусматривается организация переработки вторичных материальных ресурсов и исключение вредных выбросов в атмосферу и водоемы, а также максимальное сокращение потерь тепла в окружающую среду. К настоящему времени определились следующие основные направления в создании экологически рациональных технологических процессов: разработка технологических систем и водооборотных циклов с выводом жидких отходов и выбросом вредных газов, допускаемых пределах для данного региона; переработка вторичных материальных ресурсов (BMP) в полезные продукты; снижение потерь тепла в окружающую среду за счет утилизации вторичных энергоресурсов (ВЭР); создание территориально-промышленных комплексов с замкнутой структурой материальных потоков сырья и отходов Малоотходный комплекс производства кальцинированной соды имеет две системы водооборота, потребляющие около 18,0 м3 свежей воды на производство 1 т соды, около 2 м3 воды на стадию фильтрации шлама из дистиллерной суспензии, а кроме того, примерно 18 м3 расходуется на другие технологические нужды (всего 38 м3 на 1 т соды). Потребление свежей воды может быть сокращено за счет следующего: а) применения шламов дистилляции с концентрацией хлорид - ионов 8% (т. е. без промывки на стадии фильтрации) для получения полезных продуктов. В этом случае на гашение извести будут направлены слабоминерализованные стоки, а не промывные воды фильтрации шлама (потребление воды сокращается на 2,0 м3/т соды): б)ликвидации стока, выводимого из водооборотной системы производства соды па рассолопромысел для растворения соли, и выведение стока из водооборотной системы хлорида кальция для специальной очистки. В этом случае потребление воды сокращается примерно па 9,0 м3/т соды; в) очистки от взвешенных веществ, оксида и диоксида углерода слабоминерализованного стока после известкового цеха; сток может далее направляться на повторное использование; в этом случае потребление воды сокращается примерно на 8,5 м3/т соды; г) использования условно чистого конденсата в водооборотной системе хлорида кальция с экономией воды около 6 м3/т соды. После завершения выполняемых сейчас исследовательских работ можно ожидать снижения потребления свежей воды примерно до 10 мэ на 1 т соды с созданием предпосылок реализации бессточной схемы производства. Последнее предполагает использование для подпитки оборотной системы водоснабжения поверхностных сточных вод (ливневые и талые воды), объем которых зависит от расположения предприятия, климатических условий и занимаемой площади; в среднем этот объем составляет 0,3-0,6 м3/т соды. Производство хлорида кальция. При создании малоотходного комплекса производства соды предусматривается внедрение высокоэффективной технологии переработки осветленной дистиллированной жидкости, которая может либо перерабатываться с получением хлорида кальция, либо после соответствующей подготовки закачиваться в нефтяные скважины. Дистиллированная жидкость представляет собой водный раствор минеральных солей, основными компонентами которого являются хлорид кальция (10—14 %) и хлорид натрия (5—7%). Описываемый ниже способ получения хлорида кальция с одновременным выделением хлорида натрия основан на концентрировании водного раствора этих солей. Применение получаемого хлорида кальция в народном хозяйстве основано на его высокой гигроскопичности, т. е. способности поглощать из воздуха значительные количества влаги и легко растворяться в воде; пониженной по сравнению с водой температуре замерзания и повышенной температуре кипения концентрированных растворов. Основными потребителями хлорида кальция являются химическая промышленность (производство синтетического каучука, флотационные процессы и др.), холодильная техника, строительство (увеличивает скорость схватывания бетона), цветная металлургия (изготовление кальцийсодержащих сплавов баббитов), обработка руд для предотвращения смерзания, текстильная промышленность и другие отрасли народного хозяйства. Основным потребителем попутно получаемого хлорида натрия является сельское хозяйство (приготовление комбикормов и кормосмесей), иногда NaCl возвращают в голову процесса для получения соды. Закачка дистеллерной жидкости в нефтяные скважины. Второй вариант утилизации дистиллерной жидкости — использование ее после специальной подготовки для закачки в нефтяные скважины. Если производство соды расположено в районе добычи нефти, то этот вариант обладает следующими преимуществами: исключается потребность нефтепромыслов в свежей воде; увеличивается нефтеотдача за счет использования жидкости с большей плотностью; отпадает необходимость затраты большого количества тепла для испарения воды в производстве хлорида кальция при выделении солей, содержащихся в дистиллерной жидкости; возможность использования для подготовки жидкости накопители — «белые моря», — традиционно располагающиеся возле каждого завода, производящего соду аммиачным способом. Способ подготовки дистиллерной жидкости, используемой для закачки, включает следующие стадии: отстой дистиллерной суспензии в накопителе «белое море»; разбавление осветленной дистиллерной жидкости водой с целью снятия пересыщения по гипсу; карбонизация разбавленной дистиллерной жидкости газом известковых печей в присутствии ретурного шлама; отстаивание и транспортирование прокарбонизованной дистиллерной жидкости. Очистка газа от вредных выбросов атмосферу. Выше, при описании технологической схемы получения извести, были описаны системы, позволяющие сократить выбросы пыли до предельно допустимых норм. Однако до настоящего времени серьезной проблемой было сокращение (исключение) выбросов в атмосферу токсичных газов: оксида углерода и диоксида серы, которые образуются в количестве 27 кг СО и 5,6 кг SO2 на 1 т соды. Для этой цели разработан аппарат регенеративного типа для дожигания токсичных газов, состоящий из двух реакционных камер, сообщающихся между собой через камеру сгорания. В камере сгорания происходит интенсивная турбулизация потока технологического газа, содержащего токсичные горючие компоненты и незначительное количество (1-2%) кислорода. Интенсивная турбулизация обеспечивает предварительное дожигание примесей (в частности, смолистых соединений) на развитой нагретой поверхности перед подачей газовой смеси на катализатор. В качестве катализатора применяют боксит, на поверхности которого происходит беспламенное сжигание оксида углерода, сероводорода и других токсичных горючих примесей при температуре 750—800°С. Процесс проводят в нестационарном режиме при периодических изменениях направления подачи в реакционные камеры обезвреживаемого газа с низкой температурой. Наилучшим является режим, при котором не расходуется природный газ, а необходимые температуры в зонах поддерживают за счет тепла, выделяющегося при дожигании газов. Аппарат испытан в процессе обезвреживания оксида углерода в отходящие газах известково-обжигательных печей. При содержании в технологическом газе 1,5-2,3% СО аппарат работает в автотермическом режиме. Отходящие газы представляют собой вторичные энергетические ресурсы. Меры предосторожности. Техническая кальцинированная сода относится к веществам 3-го класса опасности.Аэрозоль технической кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее - дерматит. Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе рабочей зоны производственных помещений - 2 мг/м3. Работающие с технической кальцинированной содой должны быть обеспечены специальной одеждой, специальной обувью и индивидуальными средствами защиты. Список литературы Библиографическая ссылка Шатов А.А. ПРОИЗВОДСТВО КАЛЬЦИНИРОВАННОЙ СОДЫ - ОТ ПРОШЛЫХ К НОВЫМ ТЕХНОЛОГИЯМ // Научное обозрение. Фундаментальные и прикладные исследования. – 2017. – № 1. ; URL: https://scientificreview.ru/ru/article/view?id=8 (дата обращения: 13.05.2022).Размещено на | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
