курсовая по физхимии. ИТОГ курсовая. Физикохимические расчеты и анализ некоторых процессов химической технологии
 Скачать 374.9 Kb. Скачать 374.9 Kb.
|
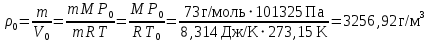 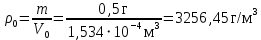 Рассчитаем мольно-объёмную концентрацию N,N-диметилформамида внутри рабочей зоны: 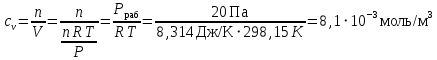 Переведём мольно-объёмную концентрацию в единицы ПДК, который определяется в мг/м3: 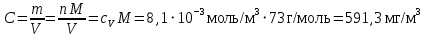 ПДК N,N-диметилформамида в воздухе составляет 10 мг/м3. Сравнивая концентрацию вещества в рабочей зоне с ПДК видно, что необходимо провести очистку от паров вредного вещества. Очистка будет проводится в адсорбере. 3 Адсорбционная очистка вентиляционных газов от N,N-диметилформамида 3.1 Характеристика метода адсорбционной очистки Метод основан на способности некоторых твердых тел избирательно поглощать газообразные компоненты из газовых смесей. Присутствующие в газовой смеси молекулы загрязненного газа или пара собираются на поверхности или в порах твердого материала. Поглощаемое из газовой фазы вещество - называется адсорбтивом, а твердое вещество, на поверхности или порах которого происходит адсорбция поглощаемого вещества - адсорбентом. Газовая фаза, в которой находится извлекаемый компонент - газ - носитель, а после того, как извлеченный компонент перешел в адсорбированное состояние, его называют адсорбатом. Применяют в этом случае: 1) когда другие методы оказываются неэффективны; 2) концентрация загрязняющих веществ очень мала и требуется гарантированная рекуперация извлекаемой примеси из-за ее значительной стоимости или опасности. Методом адсорбции из отходящих газов удаляют SO2 ,углеводороды, хлор, сероводород, сероуглерод, и другие. [3] 3.1.1 Характеристика процесса адсорбции Адсорбцией называется самопроизвольный процесс перераспределение вещества между объёмом фазы и поверхностным слоем. Различают физическую адсорбция и химическую адсорбцию (хемосорбцию). Физическая адсорбция осуществляется в основном за счёт действия сил межмолекулярного взаимодействия (сил Ван-дер-Ваальса) [3] 3.1.2 Аппаратное оформление процесса адсорбции  Аппарат, в котором происходит адсорбция, называется адсорбером. 3.2 Расчёт адсорбции N,N-диметилформамида на активированном угле Характеристика и параметры системы представлены на рисунке 3.2.1. Равновесная адсорбция рассчитывается по следующей формуле: 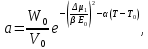 (3.2.1) (3.2.1)где a - величина равновесной адсорбции, моль/г; W0 - объём микропор адсорбента, мл/г; V0 - мольный объём адсорбента, мл/моль; E0 - энергия адсорбции бензола, кДж; 𝛼 - термический коэффициент адсорбции, К-1, 𝛽 - коэффициент подобия, T - температура адсорбции, К, T0 = 298 K и 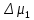 - изменение химического потенциала при адсорбции, которое рассчитывается по формуле: - изменение химического потенциала при адсорбции, которое рассчитывается по формуле: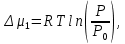 (3.2.2) (3.2.2)где R - универсальная газовая постоянная, P0 - давление насыщенного пара при нормальных условиях. Рассчитаем изменения химического потенциала при комнатной температуре и давлении паров P = Pраб = 22 Па: 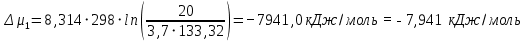 Коэффициент подобия 𝛽 равен отношению парахоров N,N-диметилформамида и бензола: 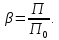 (3.2.3) (3.2.3)Парахор бензола 𝛱0 равен 205,4, а парахор N,N-диметилформамида рассчитывается как сумма парахоров атомов 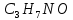 : :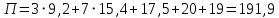 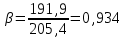 Термический коэффициент сорбции 𝛼 рассчитывается по формуле: 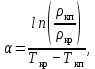 (3.2.4) (3.2.4)где 𝜌кп, 𝜌кр - плотность жидкого N,N-диметилформамида при температуре кипения Tкп и критической температуре Tкр соответственно. Плотность при критической температуре рассчитывается по формулам: 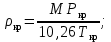 (3.2.5) (3.2.5)(3.2.6) 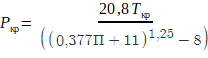 Рассчитаем термический коэффициент сорбции: 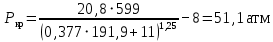 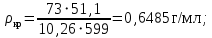 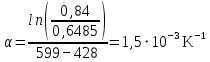 Рассчитаем величину адсорбции при рабочем давлении и комнатной температуре по формуле (3.2.1): 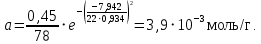 Приведем полученное значение к размерности грамм адсорбатива на кг адсорбента, умножив на молярную массу ДМФА и 1000. И получаем, что a = 284,7 г/кг. Рассчитаем величину адсорбции при зимних (-16°С) и летних (38°С) условиях. Зависимость адсорбции от температуры учитывается температурным коэффициентом сорбции 𝛼. Изменение химического потенциала также зависит от температуры, при этом эта зависимость проявляется как в множителе перед логарифмам, так и в давлении насыщенного пара, которое также зависит от температуры. Значение давления насыщенного пара при определённой температуре можно выразить через следствие уравнения Клаузиуса-Клайперона: 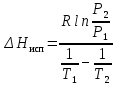 . (3.2.7) . (3.2.7)Рассчитаем теплоту испарения ДМФА: 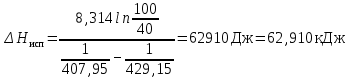 Принимая во внимание тот факт, что в нешироком интервале температур (≈ 100°) теплота испарения слабо зависит от температуры можно рассчитать значение давления насыщенного пара при любой температуре. Выразим давление пара при определённой температуре из уравнения (3.2.7): 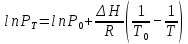 . (3.2.8) . (3.2.8)Зимние условия: 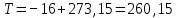 . .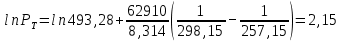 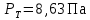 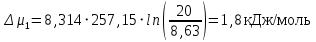 Так как изменение потенциала положительная величина, то адсорбция в этих условиях не происходит. ДМФА в этих условиях жидкость(температура замерзания -61 С)[1] Летние условия: 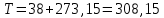 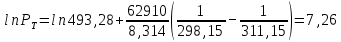 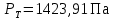 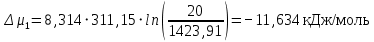 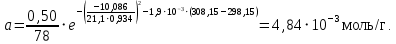 Приведем полученное значение к размерности грамм адсорбатива на кг адсорбента, умножив на молярную массу ДМФА и 1000. И получаем, что a = 569,4 г/кг. Для регенерации адсорбента используют водяной пар, который обычно расходуется в пределе 2÷5 кг/кг адсорбата. Концентрацию ДМФА в полученном растворе можно увеличить методом ректификации. Рассчитаем массу водяного пара, необходимого для регенерации адсорбера. На ректификацию подаётся раствор с концентрацией 0,09, т.е 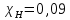 . Тогда такой раствор содержит 0,09 моль ДМФА и 0,91 моль воды или . Тогда такой раствор содержит 0,09 моль ДМФА и 0,91 моль воды или 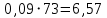 г ДМФА и г ДМФА и 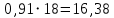 грамм воды. Тогда расход равен следующему отношению: грамм воды. Тогда расход равен следующему отношению: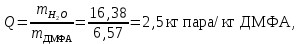 такая величина удовлетворяет практическим рекомендациям. 4 Ректификационная очистка водного раствора N,N-диметилформамида 4.1 Характеристика процесса ректификации За прошедшие столетия довольно простой с современной точки зрения процесс перегонки превратился в сложный процесс – ректификацию. Ректификация – это тепломассообменный процесс, применяемый для разделения жидких смесей, компоненты которых различаются по температурам кипения. Процесс осуществляется при контакте потоков пара и жидкости. Этот контакт происходит в специальных колонных аппаратах – ректификационных колоннах (рис. 6). Поток пара создается в выносном кипятильнике ректификационной установки. Поток жидкости (флегмы или орошения) организуется за счет конденсации уходящего с верха колонны пара в конденсаторе. Взаимодействие потоков осуществляется на специальных контактных устройствах, размещенных по высоте ректификационной колонны. В качестве контактных устройств могут использоваться или так называемые тарелки (ступенчатый контакт), или фигурный материал – насадка. [4] 4.2 Аппаратное оформление процесса ректификации  Принципиальная схема ректификационной установки: Т-1 – подогреватель сырья; К-1 – ректификационная колонна; Т-2 – конденсатор (дефлегматор); Т-3 – холодильник дистиллята; Т-4 – вертикальный термосифонный кипятильник; Т-5 – холодильник кубового остатка. [4] 4.3 Анализ фазовой диаграммы По справочным данным была построена фазовая диаграмма «температура кипения – состав» системы C3H7NO – H2O при P =600 Topp (рис.4.2). Концентрация раствора, который поступает на ректификацию, равна χн = 0,09= 9%. Распишем происходящие процессы поэтапно. Начальный раствор закипает при температуре 100,2 0С (точка B), при этом образуется пар (точка A) с концентрацией yн = 0,02 %. По второму закону Коновалова в экстремумах равновесной кривой концентрации паровой и жидкой фаз совпадают. На диаграмме точка S, координаты которой χА = yA = 100%, tA = 143,6 0С. В этой точке процесс разделения должен прекратиться, так как образуется «однокомпонентый» нераздельно кипящий раствор. Таким образом, равновесный процесс разделения раствора с χн = 9 % содержит шесть теоретических ступеней разделения (теоретические тарелки, ЧТГ = 6) при получении дистиллята с заданной концентрацией χд = 0,01% и кубового остатка χк = 0,98 4.4 Расчёт процесса ректификации На миллиметровке представлена диаграмма кипения бинарной смеси состава H2O-ДМФАпри 600 Торр. Концентрации выражены в мольных долях H2O. Согласно первому закону Коновалова концентрации паровой и жидкой фазы будут различны, при этом пар будет обогащён более летучим компонентом, то есть компонентом который при данных условиях будет иметь меньшую температуру кипения. Так как все концентрации выражены в мольных долях, то необходимо выразить массу раствора в молях. Для этого надо рассчитать среднюю молярную массу раствора исходного раствора 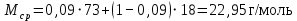 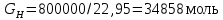 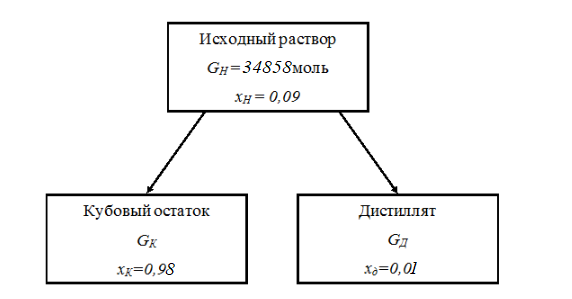 Рисунок 4.3.1 – Схема материального баланса процесса ректификации Схема материального баланса представлена на рисунке 4.3.1. Общий баланс: 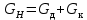 (4.3.1) (4.3.1)Баланс по N,N-диметилформамиду: 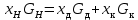 (4.3.2) (4.3.2)Составим систему из уравнений (4.3.1) и (4.3.2) 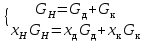 . .Решим её. 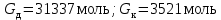 Таким образом в результате разделения был получен кубовой остаток с концентрацией 0,98 и дистиллят с концентрацией 0,01. Кубовой остаток должен будет быть направлен на дальнейшее разделение или быть возвращён в технологический процесс. Дистиллят с концентрацией 0,01 (мольная доля) или 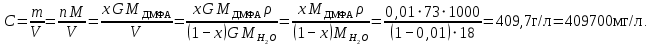 Такая величина существенно превосходит предельно допустимую равную 10 мг/л. Дальнейшая очистка дистиллята будет производится методом биохимической очистки. 5 Биохимическая очистка сточных вод 5.1 Сущность метода биохимической очистки Одним из наиболее типичных примеров промышленного применения микроорганизмов - биохимическая очистка сточных вод Органические вещества, содержащиеся в бытовых и промышленных сточных водах, являются благоприятной средой для микроорганизмов, которые в ней быстро размножаются, используя часть пищи для синтеза новых клеток, а другую перерабатывая в простые минеральные продукты - СО2, Н2О и др Этот процесс, протекающий в присутствии кислорода (воздуха), называется «биохимическим» окислением. До биохимического окисления сточные воды подвергаются механическому очищению (осаждению). В осадках, образующихся в результате механического и биохимического очищения сточных вод, органические вещества минерализуются затем чаще всего за счет анаэробных биохимических процессов Механизм изъятия органических веществ из сточных вод и их переработки микроорганизмами очень сложен и полностью не изучен. Согласно современным теориям его можно описать тремя последовательными стадиями массообмен и сорбция субстрата на поверхности микроорганизмов; -диффузия субстрата через клеточную мембрану микроорганизмов, метаболизм субстрата в клетках Суспендированные вещества и крупные молекулы в растворе надо заранее разрушить, чтобы они могли легко проходить сквозь клеточную оболочку. Это разрушение происходит при помощи ферментов, выделяемых бактериями Возможны два пути переноса вещества от поверхности внутрь клетки 1) последовательное растворение вещества в оболочке клетки и цитоплазматической мембране, благодаря чему оно диффундирует внутрь клетки, 2) присоединение транспортируемого вещества к специфическому бел-ку-переносчику, находящемуся в мембране, дальнейшее превращение комплекса вещество-переносчик в растворимое состояние, диффузия комплекса через мембрану в клетку, где комплекс распадается и белок-переносчик высвобождается для совершения нового цикла Основную роль в очистке сточных вод играют процессы превращения вещества, происходящие в клетках микроорганизмов, а именно окисление вещества, сопровождающееся выделением энергии, и синтез новых белковых веществ, протекающий с затратой энергии [5] 5.2 Аппаратное оформление процесса |
