курсовая по физхимии. ИТОГ курсовая. Физикохимические расчеты и анализ некоторых процессов химической технологии
 Скачать 374.9 Kb. Скачать 374.9 Kb.
|
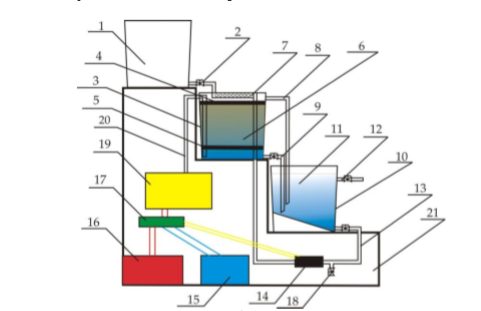 Рис. Схема экспериментальной лабораторной установки для очистки воды: 1 – приемный бак, 2 – трубопровод неочищенной воды, 3 – бак биологической очистки, 4 – верхняя сетка, 5 – нижняя сетка, 6 – насадочный материал с биопленкой, 7 – распределительное устройство для сточной воды, 8 – трубопровод перелива, 9 – трубопровод с водой после биологической очистки, 10 – бак для приема воды после биологической очистки, 11 – вода после биологической очистки, 12 – пробоотборник, 13 – трубопровод циркуляции воды, 14 – помпа, 15 – аккумуляторная батарея, 16 – блок питания 220 – 12 В, 17 – блок управления помпой, 18 – вентиль для слива очищенной воды, 19 – компрессор, 20 – шланг с воздухом, 21 – стенд. 5.3 Расчёт кинетики биохимической очистки Разбавим дистиллят в 10 раз и получим раствор с концентрацией С0 40970 мг/л. Известно, что реакция биохимического разложения проходит как реакция первого порядка и при температуре 23°С имеет константу скорости k равную 0,25 ч-1. Кинетическое уравнение первого порядка в дифференциальной форме имеет вид: 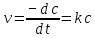 (5.3.1) (5.3.1)Разделим переменные и проинтегрируем это уравнение от 0 до 𝜏. 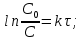 (5.3.2) (5.3.2)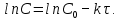 (5.3.3) (5.3.3)Подставив исходные данные в уравнение (5.3.2), получим следующие выражение: 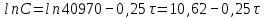 (5.3.4) (5.3.4)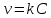 (5.3.5) (5.3.5)Для построения кинетической кривой по уравнениям (5.3.4) и (5.3.5) рассчитаем значение скорости и концентрации в произвольные моменты времени до достижения значения ПДК. Полученные данные заносятся в таблицу 5.3.1. Таблица 5.3.1 — Кинетика биохимического разложения ДМФА.
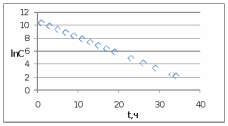 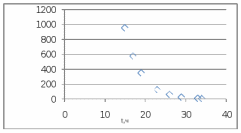 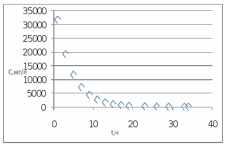 На скорость реакции влияет концентрация вещества в растворе. Из графиков видно, что в начале реакции, когда концентрация раствора велика, скорость реакции велика, но при её уменьшении скорость начинает резко падать. Время достижения ПДК рассчитывается по уравнению (5.3.3) 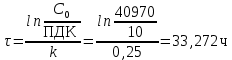 Изменение температуры также существенно влияет на скорость реакции. При изменении температуры на 10 градусов константа скорости возросла почти в три раза. Это позволяет вычислить энергию активации по уравнению Аррениуса и прогнозировать скорость реакции при различных температурах. 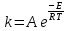 (5.3.6) (5.3.6)Составим систему из уравнений (5.3.6) 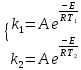 . (5.3.7) . (5.3.7)Решаем систему уравнений (5.3.7) и получаем значение энергии активации. 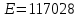 Дж и Дж и 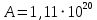 . .Запишем уравнение Аррениуса для данного процесса: 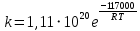 (5.3.8) (5.3.8)Для получения более подробной информации о ходе процесса обратимся к теории переходного состояния. Константа скорости определяется по формуле: 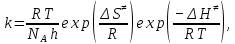 (5.3.9) (5.3.9)где NA - число Авогадро; h - постоянная Планка, 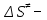 энтропия образования переходного состояния; энтропия образования переходного состояния; 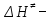 энтальпия образования переходного состояния равная энергии активации. энтальпия образования переходного состояния равная энергии активации.Зная, что 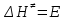 , приравняем уравнения (5.3.6) и (5.3.9) и сократив получим: , приравняем уравнения (5.3.6) и (5.3.9) и сократив получим: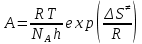 Значение предэкспоненциального множителя A было найдено ранее. Решим уравнение (5.3.10) относительно 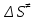 . . 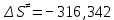 Дж/(моль•K) Дж/(моль•K)Энергия Гиббса образования переходного комплекса равна: 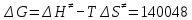 Дж/моль. Дж/моль.По уравнениям (5.3.2) и (5.3.6) можно рассчитать как изменится время реакции при изменении начальной концентрации и температуры. Объединённое уравнение (5.3.2) и (5.3.6) имеет вид: 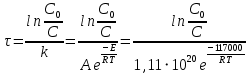 Для удобства сравнения занесём данные в таблицу 5.3.2.
Вывод: Видно, что при увеличении температуры время очистки уменьшилось 31%, а при уменьшении температуры время возросло на 69%. При увеличении концентрации в 10 раз время возрастает на 42%, при уменьшении - уменьшается на 56%. Заключение Основная задача работы рассмотрение адсорбции как метода очистки вентиляционных газов. Задача выполнена в практическом и теоретическом плане. С помощью рефракционного метода была совершена идентификация ДМФА, Расчеты показали, что примесь превышает предельно допустимую концентрацию и необходимо провести очистку. Очистку произвели с помощью метода адсорбции. Минусами адсорбции являются область использования с низкой концентрацией загрязнения и истирание сорбента, что приводит к низкой экономической эффективности. Адсорбции недостаточно для очистки вентиляционных газов и требуются дополнительные методы. Поэтому так же был использован биологический метод очистки. Таким образом, было использовано два метода очистки, адсорбционная очистка вентиляционных газов и биохимическая очистка сточных вод. Оба метода используются на большом количестве промышленных предприятий. Список использованных источников https://ru.wikipedia.org/wiki/N,N-Диметилформамид Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы. под общ.ред. Москвина А.В СПб.: АНО НПО «Профессионал» 2004. Адсорбция [Электронный ресурс] / В. Д. Ягодовский. — Эл. изд. — Электрон. текстовые дан. (1 файл pdf : 219 с.). — М. : БИНОМ. Лаборатория знаний, 2015. — (Учебник для высшей школы).—Систем. требования: Adobe Reader XI ; экран 10". Ректификации бинарной смеси. Метод. указ. к лабораторной работе. / Самар. гос. тех. ун-т; Сост. В.В. Филиппов. Самара, 2019. 36 с. Комиссаров Ю.А. Анализ и синтез систем водообеспечения химических производств — М.: Химия, 2002. — 496 c | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
