Получение нитрата аммония. курсовая работа по ХТНв. Физико химия процесса.
 Скачать 348.72 Kb. Скачать 348.72 Kb.
|
ОглавлениеВведение. 2 1.Физико – химия процесса. 4 2.Технологическая схема производства. 8 3.Материальный баланс 12 4.Тепловой баланс 15 Литература 17 Введение.Нитрат аммония (аммонийная (аммиачная) селитра) - химическое соединение NН4NО3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Нитрат аммония является концентрированным азотным удобрением. Его применяют в производстве взрывчатых веществ – аммонитов и гранулитов, в качестве реагента для растворения циркониевых оболочек твэлов в процессе регенерации облученного ядерного топлива. Аммиачная селитра имеет ряд преимуществ перед другими азотными удобрениями. Она содержит 34 - 34,5 % азота и в этом отношении уступает только карбамиду [(NH2)2CO], содержащему 46% азота. Аммиачная селитра NН4NО3 является универсальным азотным удобрением, так как одновременно содержит аммиачную группу NН4 и нитратную группу NО3 формы азота. Весьма важно, что формы азота аммиачной селитры используется растениями в разное время. Аммонийный азот NH2, непосредственно участвует в синтезе белка, быстро усваивается растениями в период роста; нитратный азот NО3 усваивается относительно медленно, поэтому действует более продолжительное время. Аммиачная селитра используется также в промышленности. Она входит в состав большой группы устойчивых в разных условиях аммиачно-селитренных взрывчатых веществ в качестве окислителя, разлагаясь в определенных условиях только на газообразные продукты. Таким взрывчатым веществом представляет собой смесь аммиачной селитры с тринитротолуолом и другими веществами. Аммиачная селитра, обработанная гидрокарбонатной пленкой типа Fе(RСОО)3RСООН, в больших количествах используется для взрывных работ в горнорудной промышленности, при строительстве дорог, гидротехнических и других крупных сооружениях. Физико – химия процесса.Характеристика исходного сырья и продукта. Для производства аммиачной селитры применяется 100%-ный аммиак и разбавленная азотная кислота НNО3 концентрацией 55 - 56%. Аммиак NН3 - бесцветный газ с резким специфическим запахом. - Реакционноспособное вещество, вступающее в реакции присоединения, замещения и окисления. - Хорошо растворим в воде. - Плотность по воздуху при температуре 0°С и давлении 0,1 МПа - 0,597.
- Предельно допустимая концентрация в воздухе рабочей зоны производственных помещений 20 мг/м3, в воздухе населенных мест 0,2 мг/м3. - Из смеси с воздухом аммиак образует взрывоопасные смеси. Нижний предел взрываемости аммиачно-воздушной смеси 15% (объемная доля), верхний предел 28% (объемная доля). - Аммиак раздражающе действует на верхние дыхательные пути, слизистые оболочки носа и глаз, попадая на кожу человека вызывает ожоги. - Класс опасности IV. Выпускается по ГОСТ 6621 - 70.
Азотная кислота НNО3 - жидкость, обладающая едким запахом. - Плотность по воздуху при температуре 0°С и давлении 0,1МПа-1,45г/дм3. - Температура кипения 75°С. - Смешивается с водой во всех отношениях с выделением тепла. - Азотная кислота, попадая на кожный покров или слизистые оболочки вызывает ожоги. Животные и растительные ткани под воздействием азотной кислоты разрушаются. Пары азотной кислоты, аналогично оксидам азота, вызывают раздражение внутренних дыхательных путей, одышку, отек легких. - Предельно допустимая концентрация паров азотной кислоты в воздухе производственных помещений в пересчете на NО2 - 2 мг/м3. - Массовая концентрация паров азотной кислоты в воздухе населенных мест не более 0,4 мг/м3. - Класс опасности II. Выпускается по ГОСТ 113 - 03 - 270 - 76.
Аммиачная селитра NН4NО3 - белое кристаллическое вещество, выпускаемое в гранулированном виде с содержанием азота до 35%
Согласно существующему в России ГОСТ 2–85, производят гранулированный нитрат аммония двух марок: А – высшей категории качества Б – высшей категории качества (высший сорт) и первой категории качества (первый сорт). Нитрат аммония марки А должен содержать не менее 98% NH4NO3, а марки Б – не менее 34,4% N в высшем сорте и 34,0% N в первом сорте. В зависимости от сорта нитрат аммония должен содержать влагу в пределах 0,2 – 0,3%. Содержание добавок (в пересчете на сухое вещество) в продукте высшей категории качества марок А и Б: нитратов кальция и магния – 0,2 – 0,5% (в пресчете на CaO), фосфатов – 0,5 – 1,2% (в пересчете на P2O5), сульфата аммония 0,3 – 0,7%, сульфата аммония + фосфата аммония 0,4 – 0,6%. В продукте первого сорта марки Б содержание добавок не нормируется. Величина pH 10%-ного водного раствора для всех сортов с сульфатно–фосфатной добавкой 4,0, а с другими добавками – 0,5. Параметры процесса. Процесс получения нитрата аммония базируется на реакции азотной кислоты с аммиаком: HNO3(ж) + NH3(г) = NH4NO3(тв) +144,9 кДж В процессе нейтрализации 47 – 60%-ной HNO3 образуется водный раствор нитрата аммония, который для получения целевого продукта необходимо упаривать. В процессе упарки используется теплота нейтрализации согласно приведенному выше уравнению реакции. Процесс нейтрализации азотной кислоты аммиаком производится при температуре 180 – 200оC под давлением 0,35 – 0,6 МПа, а самоиспарение раствора - при меньшем или при атмосферном давлении. Соковый пар при этом используют для дальнейшей упарки раствора от 75 – 80 до 95 – 99% основного вещества в целевом продукте в вакуум-аппаратах. Это исключает процесс кипения раствора в зоне реакции. В существующем способе производства нитрата аммония отвод теплоты осуществляется в самом нейтрализаторе, в котором параллельно с нейтрализацией происходят процессы кипения и упарки раствора. Поэтому реактор назван ИТН (использователь теплоты нейтрализации). Процесс нейтрализации азотной кислоты, разбавленной другими газами, проводят при температуре 90 - 100оC в аппаратах колонного типа скрубберных или тарельчатых, орошаемых циркулирующим раствором нитрата аммония, в который вводится азотная кислота. Образующийся при этом горячий раствор направляется в вакуум-испаритель, в котором при остаточной давлении 13 – 20 кПа охлаждается до температуры кипения (70 - 75оC), после чего часть его возвращают на процесс орошения нейтрализатора, а другую часть направляют на упарку. В процессе применения 47 - 55%-ной азотной кислоты в аппаратах ИТН образуются растворы, содержащие 62 – 83% NH4NO3. Для получения плава целевого продукта растворы упаривают в вакуум-выпарных аппаратах, используя в качестве теплоносителя соковый пар из аппаратов ИТН, при недостатке его и свежий пар. Процесс гранулирования плава, содержащего до 98,7% целевого продукта, осуществляют в потоке воздуха в футерованных кислотоупорным кирпичом. Технологическая схема производства. Рисунок 1 - Схема получения нитрата аммония на агрегате АС - 72М: 1 – подогреватель аммиака; 2 – подогреватель азотной кислоты; 3 – аппарат ИТН; 4, 5 – донейтрализаторы; 6 – комбинированный выпарной аппарат; 7 – промыватель паровоздушной смеси; 8, 18 – скрубберы; 9 – гидрозатвор; 10 – фильтр плава; 11 – сборник для плава; 12 – погружной насос; 13 – центробежный насос; 14 – сборник; 15 – напорная емкость; 16 – акустический гранулятор; 17 – грануляционная башня; 19, 22 – вентиляторы; 20 – ленточный транспортер; 21 – холодильник с кипящим слоем гранул; 23, 24 – подогреватели воздуха; 25 – нагнетатель воздуха. Согласно приведенной на рис. 1 технологической схеме, при получении нитрата аммония на агрегате АС – 72М исходный газообразный аммиак, пройдя подогреватель 1, в котором нагревается до 120 - 160℃ и 58 - 60%-ная азотная кислота из подогревателя 2 с температурой 80 - 90℃ поступают в два параллельно работающих аппарата ИТН 3. В аппаратах ИТН поддерживается близкое к атмосферному давление. Поскольку при избытке азотной кислоты давление пара азотной кислоты над раствором нитрата аммония меньше, чем давление аммиака при его избытке в растворе с целью уменьшения потерь связанного азота с соковым паром в виде NH3, HNO3, NH4NO3 и NO2, процесс ведут в слабокислой среде. Концентрация азотной кислоты в отходящем из аппарата растворе (2 – 5 г/л) регулируется автоматически. Температура этого раствора 150 - 170℃, а содержание в нем нитрата аммония находится в пределах 89 – 92%. Вытекающий непрерывно из аппарата ИТН раствор нитрата аммония нейтрализуется в двух донейтрализаторах – основном 4 и контрольном 5. В донейтрализаторы же вводят кондиционирующую добавку – 30 – 40%-ный раствор нитрата магния, приготовленный растворением технического оксида магния в азотной кислоте. Раствор нитрата аммония с содержанием избыточного аммиака (0,1 – 0,5 г/л) направляется на доупаривание в комбинированный выпарной аппарат 6, оттуда плав, проходя гидрозатвор – донейтрализатор 9 и фильтр 10, поступает в приемный сборник 11. Далее плав погружным насосом 12 по трубопроводу с антидетонационной насадкой перекачивается в напорную емкость 15, находящуюся над грануляционной башней 17. Из напорной емкости плав подается в башню через три виброакустических гранулятора 16. Струя плава, поступающего через внутренне сопло 2 гранулятора на пластину 3, генерирует ее колебания, передающиеся перфорированному днищу 5 (рис. 2).  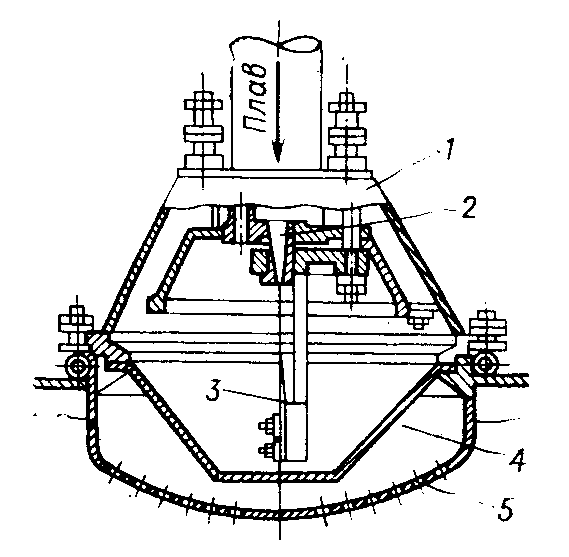 Рисунок 2 - акустический гранулятор: 1 – корпус; 2 – сопло; 3 – пластина; 4 – сетчатый фильтр; 5 – вибрирующее перфорированное днище. Через отверстия в нижней части в грануляционную башню 17 засасывается наружный воздух из аппаратакипящего слоя 21, в котором гранулы досушиваются и доохлаждаются. Высота падения капельплава в башне не превышает 50 м. В потоке воздуха они затвердевают, превращаясь в гранулы. Температура плава, подаваемого на процесс грануляции на 5 – 7 К превышает температуру его кристаллизации. Плав нитрата аммония с влажностью 0,2% начинает кристаллизоватьсяпри 167℃, а полностью затвердевает при 140℃. Количество воздуха – 300 – 500 тыс. м3/ч в зависимости от погодных условий. Из нижней части башни гранулы поступают на ленточный транспортер 20, с помощью которого подают их в трехсекционный аппарат 21 для доохлаждения в кипящем слое с автономной подачей воздуха в каждую секцию. Температура гранул после холодильника 20 - 50℃. В процессе гранулирования с последующим охлаждением в потоках воздуха гранулы подсушиваются. Целевой продукт содержит более 99,8% NH4NO3. При относительной влажности атмосферного воздуха более 60% продукт пропускают через подогреватель 23 так же, как и воздух, подаваемый в доупарочный аппарат 6. Аппарат кипящего слоя применяют нетолько лоя охлаждения грнул, нои в процессе гранулирования частиц нитрата аммония из растворов. Для этого в кипящий слой подают 80 – 85%-ный раствор NH4NO3. При этом вода выпаривается в потоке горячего воздуха. Из верхней части грануляционной башни воздух поступаетв шесть скрубберов 18. Где отмывается от пыли нитрата аммония и аммиака циркулирующим 20%-ным раствором NH4NO3, и вентилятором 19 выбрасывается в атмосферу. Через эти же скрубберы проходят и газы из выпарного аппарата после промывателя 7 и издонейтрализатора после скруббера 8. Материальный балансИсходные данные: Производительность 190000 кг/сутки 98% расплава аммиачной селитры. Сырье: аммиак – 99% об, 1% об – азота; азотная кислота 63%, потери аммиака 3% и азотной кислоты 2% NH3 + HNO3 = NH4NO3             NH3 HNO3 NH4NO3 Потери N2 Соковый пар Решение:  98% NH4NO3 = 7916,6 кг/ч 100% NH4NO3 = 7916,6 . 0,98 = 7758,3 кг m(H2O в NH4NO3) = 7916,6 – 7758,3 = 158,3 кг Теоретический расход m(HNO3 100%) = 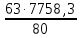 = 6109,7 кг = 6109,7 кгm(NH3 100%) = 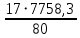 = 1648,6 кг = 1648,6 кгС учетом потерь: m(HNO3 100%) = 6109,7 ∙ 1,02 = 6231,9 кг m(HNO3 63%) = 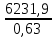 = 9891,9 кг = 9891,9 кгm(H2O в HNO3) = 9891,9 – 6231,9 = 3660 кг m(NH3 100%) = 1648,6 ∙ 1,03 = 1698,06 кг m(NH3 98,3%) = 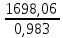 = 1727,4 кг = 1727,4 кгm(N2) = 1727,4 – 1698,06 = 29,34 кг Потери: m(HNO3 100%) = 6231,9 – 6109,7 = 122,2 кг m(NH3 100%) = 1698,06 – 1648,6 = 49,46 кг
Соковый пар = 11619,3 – 8117,6 = 3501,7 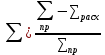 ∙ 100% = ∙ 100% = 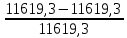 ∙ 100% = 0% ∙ 100% = 0%Тепловой балансПриход: Теплота вносимая HNO3 Q1 = 9891,9 ∙ 2,763 ∙ 30 = 819939,6 кДж Теплота вносимая NH3 Q2 = 1698,06 ∙ 2,186 ∙ 50 = 185597,9 кДж Теплота вносимая N2 Q3 = 29,34 ∙ 1,042 ∙ 50 = 1528,6 кДж Тепловой эффект для нейтрализации HNO3 63%: Q = 111 кДж ∕моль При нейтрализации выделяется: Q4 = 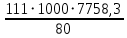 = 10764641,3 кДж = 10764641,3 кДжРасход: Теплота уносимая 98% расплавом NH4NO3 Q5 = 7916,6 ∙ 1,757 ∙ 130 = 1808230,1 кДж Теплота уносимая потерями HNO3: Q6 = 122,2 ∙ 2,763 ∙ 130 = 43893 кДж NH3: Q7 = 49,46 ∙ 2,186 ∙ 130 = 14055,5 кДж Теплота уносимая N2 Q8 = 29,34 ∙ 1,042 ∙ 130 = 3974,4 кДж Теплота уносима соковым паром Q9 = 3501,7 ∙ 2,02 ∙ 130 = 919546,4 кДж Теплота по разности, направленная на выпаривание растворов NH4NO3 Q10 = 11771707,4 – 2789699,4 = 8982008 кДж
ЛитератураХимическая технология неорганических веществ. Книга 1. Ахметов Т.Г., Перфирьева Р.Т. Соли азотной кислоты, Миниович М. А., М., 1964. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
