физиология бактерий. Физиология бактерий Физиология микробов
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
Физиология бактерий – 1. Физиология микробов - раздел микробиологии изучающий жизнедеятельность, питание, дыхание, рост и размножение бактерий и других прокариот. Изучение физиологии микробов: в основе разработки методов культивирования бактерий, получения чистых культур. важно для понимания патогенеза заболеваний, разработки новых методов диагностики, лечения и профилактики заболеваний. привело к прорыву в понимании природы заболеваний, лечения и профилактики. История физиологии: В 1856 г. к доктору химии Луи Пастеру обратились за помощью французские виноделы. Приготовленное ими в чанах вино прокисало. Пастер нашел причину - палочковидные бактерии, которые сбраживали виноградный сахар до молочной кислоты, а не до спирта, как это делали дрожжи. Эти бактерии получили название молочнокислых, или лактобактерий. Но основное - Пастер открыл дыхание без кислорода - брожение. Луи Пастер в работе «Mémoire sur la fermentation alcoholique» доказал, что спиртовое брожение — не просто химическая реакция, как считалось ранее, а биологический процесс, производимый дрожжами. Это легло в основу промышленного виноделия. Р.Кох предложил использовать плотные питательные среды из желатина и агара для выращивания культур, разработал метод выведения чистых культур, открыл палочку Коха (туберкулезная палочка), разработал бактериологический метод исследования. Метаболизм – совокупность реакций жизнеобеспечения клетки, происходящих при участии биологических катализаторов – ферментов: Катаболизм (окисление в-в, выделение Е) – у бактерий дыхание и брожение Амфиболизм (промежуточный обмен – превращения в-в) Анаболизм (построение клетки) Ферменты – высокоактивные биологически активные молекулы, способные к многократному взаимодействию с определенным субстратом: Простые (только из АК): пепсин, трипсин, лизоцим Сложные – холоферменты (апобелок и кофактор-может называться коферментом или простетической группой): сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (гем). Апобелок – термолабилен Кофактор – термостабилен Холофермент – если константа диссоциации сложного белка настолько мала, что все полипептидные цепи в растворе связаны со своими кофакторами Фермент – белок четвертичной структуры, связанный с каким – либо сахаром, т.е. он является гликопротеином. Химически кофермент и простетическая группа – это витамины или комплексные соединения металлов. Высокая специфичность фермента обусловлена особой формой активного центра, точно соответствующего молекуле субстрата. Причина изменения скорости реакции – сближение молекул субстратов при их захвате активным центром, образование хим.связей между субстратами и активным центром, направляющих протекание реакции по более легкому пути, исключительная гибкость формы активного центра, позволяющая ему принимать наилучшее для скорости строение на каждом этапе реакции. Кофактор: Растворимые коферменты (присоединяется к ферменту во время реакции, химически изменяется, а затем освобождается. Первоначальная форма кофермента регенерируется во второй независимой реакции (кофермент – органический кофактор) Простетические группы – кофермент, который прочно связан с ферментом и во время реакции его не покидает Активный центр – комбинация АК-остатков, связывающая субстрат с ферментом и выполняющая катализ. Их может быть несколько (по числу субъединиц) 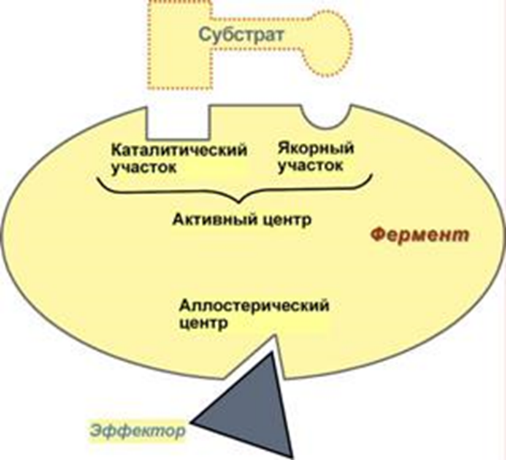 Аллостерический центр – центр, регулирующий активность фермента, который пространственно отделен от АЦ и есть не у всех ферментов. Их может быть несколько. Аллостерические эффекторы – низкомолекулярные в-ва связывающиеся с АлЦ (м.б.активаторами и ингбиторами) Субстрат – питательные вещества, поступающие в клетку и участвующие в реакциях метаболизма, являющихся точкой приложения действия ферментов. Бактериальный (культуральный) метод микробиологических исследований (диагностики) -метод диагностики инфекционных заболеваний бактериальной природы, основанный на выделении чистой культуры возбудителя и ее идентификации по совокупности морфологических, тинкториальных, культуральных, биохимических, антигенных и др. свойств Требования к питательным средам: быть питательными- содержать необходимые в-ва в легко усваиваемом виде (иногда вносят витамины и АК) иметь оптимальную концентрацию водородных ионов – рН, тк это влияет на проницаемость ЦПМ, след-но, и на питание. Для большинства нужна слабощелочная среда рН 7.2-7.4 Поэтому у среды должна быть буферность – нейтрализовать метаболиты быть изотоничными: осмотическое давление среды= осмотическому давлению внутри клетки (для многих – 0.5% раствор хлорида натрия) быть стерильными плотные среды должны быть влажными и иметь оптимальную для микроорганизмов консистенцию обладать определенным окислительно-восстановительным потенциалом – определенным соотношением в-в принимающих и отдающих электроны быть по возможности унифицированным – обладать определенным соотношением определенных в-в Жидкие среды готовят на основе пептона и мясного бульона. Плотные и полужидкие среды готовят из жидких, к которым для получения среды нужной консистенции прибавляют обычно агар-агар (Вальтер Хессе) или желатин (Роберт Кох) Агар-агар - полисахарид, получаемый из определенных сортов морских водорослей. Он не является для микроорганизмов питательным веществом и служит только для уплотнения среды. В воде агар плавится при 80-100° С, застывает при 40-45° С. Желатин - белок животного происхождения. При 25-30° С желатиновые среды плавятся, поэтому культуры на них обычно выращивают при комнатной температуре. Плотность этих сред при рН ниже 6,0 и выше 7,0 уменьшается, и они плохо застывают. Некоторые микроорганизмы используют желатин как питательное вещество - при их росте среда разжижается. Свернутая сыворотка крови, свернутые яйца, картофель, среды с силикагелем Обычно используют среды в сухой форме: порошкообразные, водорастворимые капсулы, гранулированные Среды по назначению: Простые - пригодны для выращивания многих видов микроорганизмов, неприхотливых к составу, и применяются как основа для специальных питательных сред для более требовательных видов патогенов. Примеры: МПБ, МПА, среда Хоттингера, ГРМ, тиогликолевая среда, пептонная вода Сложные - применяют в тех случаях, когда микроорганизмы не растут на простых средах. К простым средам добавляют сыворотку, белок и другие в-ва, нужные для роста бактерий. Примеры: кровяной, сывороточный агар, сывороточный бульон, асцитический бульон, асцит-агар и другие. Универсальные - на них микроорганизмы растут быстрее и более интенсивно благодаря большому количеству питательных добавок – аминокислот, витаминов, факторов роста; для патогенов важно наличие компонентов крови – гемоглобина или гемина, менадиона, цельных или гемолизированных эритроцитов Примеры: кровяной агар, шоколадный агар, гемин-агар, синтетические среды.  4. Селективные (элективные) - на них одни микроорганизмы растут быстрее и более интенсивно, чем другие виды бактерий благодаря селективным добавкам (желчь, краски, антибиотики и др.), которые способны подавлять развитие одних видов микроорганизмов, но не влияют на другие виды. Применяют на первом этапе выделения чистой культуры бактерий. Примеры: ЖСА для стафилококка, 1 % щелочная пептонная вода - для холерных вибрионов, сывороточные среды Ру и Леффлера – для возбудителей дифтерии, среды Плоскирева, Левина – для возбудителей дизентерии, Мюллера - для тифо-паратифозных бактерий (сальмонелл), для граммотрицательных – добавление трифенилметановых красителей (кристаллический фиолетовый, малахитовый зеленый), для стафилококков – можно добавить хлористый натрий в концентрации 7.5%. Жидкие элективные среды – среды накопления (н-р пептонная вода) 5. Дифференциально-диагностические - группа сред, которые позволяют определить биохимические свойства микроорганизмов и провести их дифференциацию. Они разделяются на среды для определения протеолитических, пептолитических, сахаролитических, гемолитических, липолитических, редуцирующих свойств. Основано на том, что разные виды бактерий имеют разный набор ферментов, расщепляющих разные субстраты в питательной среде. Состав: Основная питательная среда – для размножения Определенный хим.субстрат – отношение к которому является диагностическим признаком для МО Цветной индикатор – изменение окраски говорит о протекании определенных реакций Примеры: среды Гисса (пестрый ряд), среда Эндо, среда Левина, среда Ресселя, среда Ротбергера, среда Плоскирева. ДДС – 4 основные группы Способность расщеплять белки Способность расщеплять углеводы и спирты Способность обесцвечивать красители Способность усваивать определенные вещества Среда эндо: отличить штаммы с сбраживающим свойством от других (пит агар, лактоза, основной фуксин обесцвеченный сульфитом). Была розовая- стала красная. Среда Левина: эозин и метиленовый синий. Был черно-синий цвет – стал черный с металлическим оттенком, благодаря сбраживающим бактериям 6. Хромогенные среды - позволяют выявить специфическую ферментативную активность микроорганизмов, характерных для группы или для отдельного вида микроорганизма. Содержащийся фермент метаболизирует бесцветный хромогенный субстрат, образуя окрашенный продукт реакции. Идентификация возможна уже на этапе первого посева- сокращение времени исследования 7. Транспортные среды - предназначены для сохранения жизнеспособности микроорганизмов от момента взятия биоматериала до посева для диагностики. Сохраняет жизнеспособность до 72 часов. Состоит из пластиковой пробирки, питательной среды и аппликаторов с тампоном. Не содержит пит в-в, но сбалансирована по буферному и электролитному составу – дает выживать, но не размножаться. Примеры: CVTR (вирусология), Эймса (аэробы и анаэробы), Кери-Блэйр (аэробы и анаэробы), Стюарт (прихотливые микроорганизмы), Ди-Ингли (нейтрализация антисептиков) 8. Двухфазная среда - система с комбинацией 20\7 мл агара, омываемого 40\20 мл бульона. Бульонные среды богаты факторами роста, что позволяет выращивать как факультативные, так и облигатные анаэробы. Нужна для выявления гемогенных культур и их предварительной идентификации. Твердая фаза – стерильный питательный агар 30 мл, мясопептонный или сахарный агар скошенный во флаконе 100 мл. Жидкая фаза – стерильный бульон мясопептонный или сахарный, асептически внесенный во флакон с застывшим скошенным агаром. Уровень бульона должен достигать половины высоты скощенной п-ти агара - 30-40 мл. После внесения образца крови в бульон, их тщательно перемешивают и осторожно, чтобы не смочить пробку, смачивают ей скошенную п-ть агаара. Гемокультура развивается не только в бульоне, но и на агаре , что позволяет выявить ее частоту и облегчает ее идентификацию. Посев производится на плотные или жидкие питательные среды. Посев производится с помощью бактериологической петли либо пастеровской пипетки. Все манипуляции связанные с посевом (пересевом) микробных культур производятся над (рядом) с пламенем горелки. Перед посевом, петлю, сначала, прокаливают над пламенем горелки, затем остужают (обычно о чистый край питательной среды), и только потом производят манипуляции. Варианты посева на среду: Посев в жидкую среду (бакт.петлю погружают в среду. Если материал вязкий и не снимается с петли, его растирают об стенку пробирку, а затем смывают жидкой средой.) Посев на скошенный агар Посев в плотную пит.среду Метод Коха (серийные разведения) последовательное разведение исследуемого материала в жидкой питательной среде. Жидкий м-л переносится в среду, причем делают количественные пересевы до истощения смеси бактерий, чтобы потом на плотной среде можно было получить изолированные колонии разных типов. 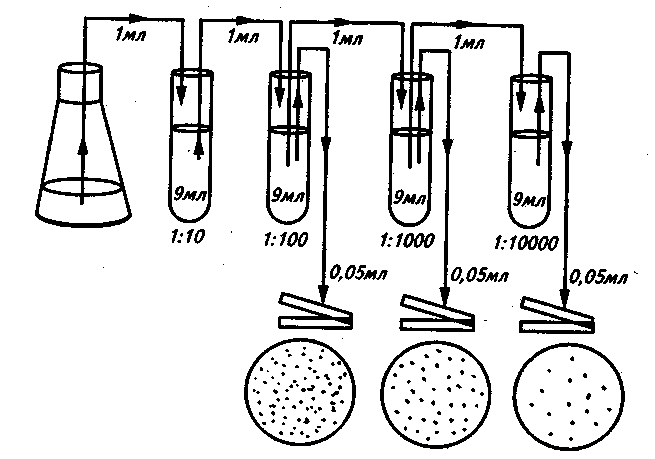 Сплошной посев «газоном». Посев на плотные пит среды. В инокулеме мало микробов или наоборот надо получить сплошной рост для постановки н-р антибиотикограммы  1Посев по Мельникову-Цареву – полуколичественная оценка с примерным определением микробной обсемененности в 1 мл исслед м-ла. Для этого используется специальная таблица с учетом сектора и выросших там колоний. 2Истощающий штрих – змеевидный штрих, можно получить изолированные колонии 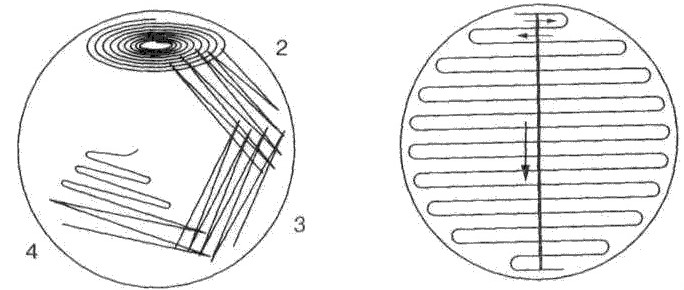 1 2 Единичный сектор Спиральный посев- используется спец аппаратура при посеве, а также при учете результатов посева, которые будут автоматически задокументированы Питательные среды |
