6 занятие (ликвор). Физиология ликвора
 Скачать 0.78 Mb. Скачать 0.78 Mb.
|
|
Физиология ликвора Ликвор (спинномозговая жидкость) – это биологическая жидкость, которая омывает структуры центральной нервной системы. Синтез ее происходит в венозных сосудистых сплетениях боковых желудочков головного мозга, откуда по через foramen interventriculare жидкость поступает в III мозговой желудочек. Последний через сильвиев водопровод сообщается с IV желудочком, из которого по срединной и боковой апертурам ликвор переходит в подпаутинное пространство спинного и головного мозга. Незначительная часть жидкости проникает также в субдуральное пространство. 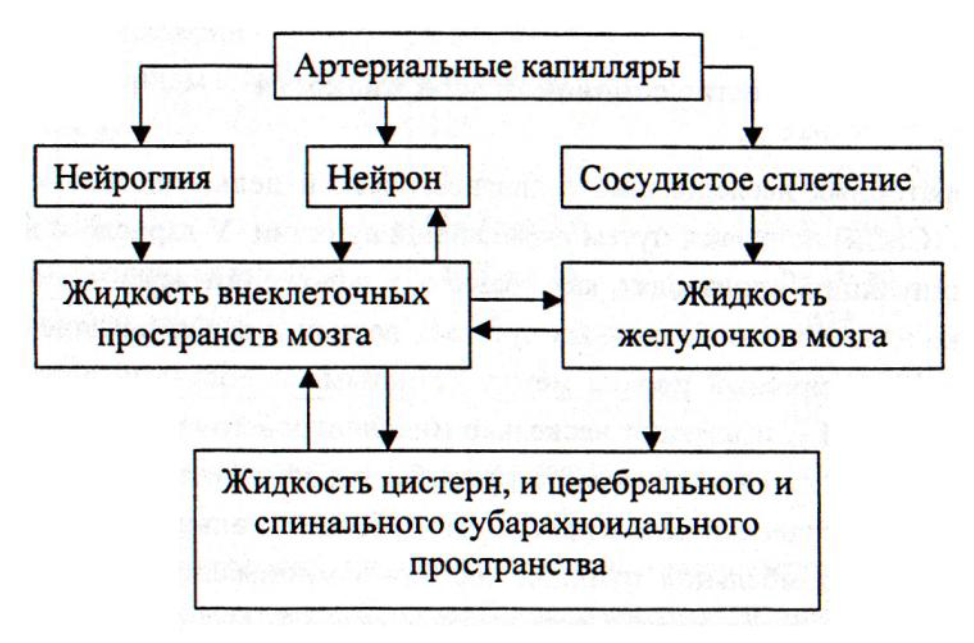 Образование ликвора в боковых желудочках происходит достаточно интенсивно, благодаря чему в их полости создается достаточное давление, чтобы придать току жидкости каудальное направление. Однако, спинномозговую жидкость нельзя приравнять к фильтрату плазмы крови, так как к ней примешивается внеклеточная жидкость нервной ткани, поступающая через эпендиму желудочков. В какой-то мере происходит и обратный процесс – поступление ликвора через эпендиму к нейроцитам и клеткам глии. Современные радиоизотопные методы исследования позволили установить, что спинномозговая жидкость в течение нескольких минут покидает полость желудочков и в течение 4-8 часов поступает в подпаутинное пространство из цистерн основания мозга. В сутки у взрослого человека секретируется около 500 мл ликвора, количество его в ликвороносных путях составляет 125-150 мл (10-14% от массы головного мозга). В боковых желудочках находится по 10-15 мл жидкости, в III и IV суммарно около 5 мл, в подпаутинном краниальном пространстве – 30 мл, в спинальном – 70-80 мл. В течение суток ликвор сменяется до 3-4 раз у взрослых и до 8-ми раз у детей. Циркуляция ликвора в субарахноидальном пространстве происходит по системе ликвороносных каналов и подпаутинных ячеек. Ток жидкости ускоряется при изменении положения тела в пространстве и под влиянием мышечных сокращений. На сегодняшний день считается, что ликвор, находящийся в поясничном отделе в течение одного часа перемещается краниально, возможно, что циркуляция происходит в обоих направлениях одновременно. Отток спинномозговой жидкости на 30-40% происходит через пахионовы грануляции паутинной оболочки в верхний сагиттальный синус, который является частью венозной системы твердой мозговой оболочки. Они появляются у человека в возрасте 1,5 лет, разрастаясь на наружной поверхности паутинной оболочки вдоль крупных пазух и вен. Обращены грануляции в сторону твердой мозговой оболочки и с веществом мозга не соприкасаются. Ликвор скапливается в верхнем сагиттальном синусе, создавая в нем давление на 15-50 мм.рт.ст. выше, чем венозное, за счет чего происходит переход жидкости из ликворных путей в кровеносную систему. 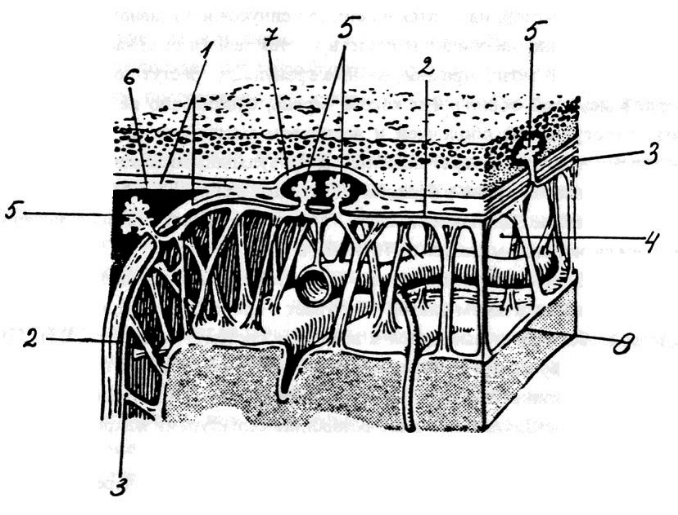 Рисунок 2 – Схема взаимоотношения оболочек головного мозга и грануляций паутинной оболочки (пахионовых грануляций). 1 – твердая мозговая оболочка; 2 – субдуральное пространство; 3 – паутинная оболочка; 4 – подпаутинное пространство; 5 – грануляции паутинной оболочки; 6 – верхний сагиттальный синус; 7 – боковая лакуна; 8 – сосудистая оболочка. Отток спинномозговой жидкости происходит также по ликвороносным каналам в субдуральное пространство, из которой она поступает в кровеносные капилляры твердой мозговой оболочки и переходит в венозную систему. Кроме того, она частично поступает в лимфатическую систему по периневральным пространствам черепно-мозговых нервов (5-30%), всасывается эпендимой желудочков (10%) и поступает в паренхиму мозга. Состав и функции ликвора По составу ликвор сходен с плазмой крови и состоит на 90% из воды и 10% сухого остатка. В нем содержатся аминокислоты (20-25), белки (около 14 фракций), ферменты, принимающие участие в метаболизме нервной системы, сахар, холестерин, молочная кислота и около 15 микроэлементов. В ликворе определяются нейромедиаторы: ацетилхолин, норадреналин, дофамин, серотонин; гормоны – мелатонин, эндофины, энкефалины, кинины. Функции ликвора: Механическая защита структур центральной нервной системы; Экскреторная – с жидкостью удаляются продукты метаболизма; Транспортная – ликвор служит для переноса метаболитов, биологически активных веществ, медиаторов, гормонов; Дыхательная – снабжает кислородом мозговые оболочки и нервную ткань; Гомеостаз – поддерживает стабильное окружение мозга, нивелирует краткосрочные изменения состава крови, поддерживает рН на определенном уровне, осмотическое давление в клетках мозга, обеспечивает нормальную возбудимость ЦНС, создает внутричерепное давление; Иммунная – участвует в создании специфического иммунобиологического барьера ЦНС. Окончательно функции ликвора не изучены по сей день, поэтому исследовательские научные работы по его изучению продолжаются. Преаналитический этап Общеклинический анализ спинномозговой жидкости проводится в течение 3-х часов после забора материала, поэтому анализ всего проводят в неотложном порядке. Для получения ликвора в большинстве случаев используют люмбальную пункцию, редко – субокципитальную, интраоперационно – вентрикулярную. Люмбальную пункцию проводит невролог/анестезиолог-реаниматолог в условиях процедурного кабинета, перевязочной или операционной. Больного укладывают на бок с приведенными коленями к груди, после чего вводят иглу в пространство между 4 и 5-м поясничными позвонками в подпаутинное пространство. Первые пять капель ликвора удаляют, так как в них содержится путевая кровь из поврежденных в процессе манипуляции кровеносных сосудов. Собирают жидкость в 2 стерильные пробирки: одна из них направляется на биохимическое и цитологическое исследования, другая используется для обнаружение фиброзной пленки или сгустка. Если существует необходимость в бактериологическом посеве, ликвором наполняется 3-я пробирка. Без опасности для здоровья у взрослого человека можно забрать 8-10 мл ликвора, у детей 5-7 мл, у грудничков 2-3 мл. Нельзя встряхивать полученный биоматериал, подвергать его воздействию перепада температур, так как это существо изменяет его показатели. Все пробирки маркируются до начала исследования, нумеруются, после наполнения их плотно закупоривают и немедленно отправляют в лабораторию. В направлении следует указать: Фамилию, имя, отчество больного, его возраст; Отделение, палату, номер истории болезни; Дату, время и место пункции; Цель исследования; Предположительный или клинический диагноз; Данные врача, направившего материал на исследование. Методы лабораторного исследования ликвора Макроскопическое исследование – это вся информация о биоматериале, которую лаборант может получить при помощи органов чувств. Цвет – в норме спинномозговая жидкость бесцветна и по виду не отличается от воды. Цвет ее определяют, сравнивая пробирку с материалом с такой же пробиркой, заполненной водой на белом фоне. Он может изменять при различных патологических процессах: красный – примесь неизмененных эритроцитов (эритроцитархия). Определить ее можно при помощи тест-полосок (ГемоФАН), которые имеют 2 шкалы сравнения: одна из них меняет цвет при наличии интактных эритроцитов, другая – при наличии свободного гемоглобина в ликворе; ксантохромный (желтый, желто-коричневый, розовый, коричневый) окрас возникает в присутствии оксигемоглобина, метгемоглобина и билирубина; розовый цвет ликвору придает оксигемоглобин, освободившийся из лизированных эритроцитов; желтый цвет обусловлен высоким содержанием билирубина, который образуется из гемоглобина. Для определения билирубинархии и ее выраженности используют тест-полоски (ИктоФАН), их реагентная зона меняет цвет от бледно-розового до насыщенного розового в зависимости от концентрации билирубина; коричневый цвет ликвору придают метгемоглобин и метальбумин, они появляются при наличии инкапсулированных гематом и геморрагий в ЦНС; зеленая окраска возникает при выраженной билирубинархии, так как происходит переход билирубина в биливердин – пигмент оливкового цвета. Иногда она обусловлена примесью гноя. Прозрачность – в норме спинномозговая жидкость прозрачная, определяют этот параметр, сравнивая полученный материал с дистиллированной водой. Легкое помутнение ликвора наблюдается при лейкоцитозе свыше 200х106/л, содержания эритроцитов более 400х106/л, общего белка – более 3 г/л. Если после центрифугирования спинномозговая жидкость становится прозрачной, то мутность ее обусловлена форменными элементами, если остается мутной – микроорганизмами. Опалесценция ликвора возникает при высокой концентрации фибриногена. Фибринозная пленка – в норме в спинномозговой жидкости низкое содержание фибрина и пленка при отстаивании не образуется. Высокое содержание фибрина дает нежную сеточку или пленку на стенках пробирки, мешочек или желеобразный сгусток. Ликвор, содержащий большое количество грубодисперсных белков сразу после выпускания свертывается в виде желеобразного сгустка. А - норма; Б - помутнение ликвора от примеси большого количества форменных элементов (менингит); В, Г - примесь крови в ликворе (субарахноидальное кровоизлияние, травма); Д - попадание крови в ликвор при проведении пункции (« путевая кровь») - после центрифугирования становится прозрачным, на дне пробирки оседают форменные элементы; Е, И - ксантохромия ликвора в результате гемолиза эритроцитов; Ж - зеленоватая окраска ликвора при гнойных менингитах; Ж - образование пленки фибрина при большом содержании фибриногена Микроскопическое исследование ликвора Это один из самых ответственных этапов исследования спинномозговой жидкости, на основании данных которого нередко подтверждаются либо опровергаются диагнозы. Подсчет количества форменных элементов проводится в течении 30 минут после извлечения спинномозговой жидкости с последующей дифференциацией клеток. Для подсчета лейкоцитов препарат окрашивают одним из реактивов: 5 мл 10% раствор ледяной уксусной кислоты + 0,1 метилового фиолетового + вода до 50 мл – время окрашивания 2 минуты; Реактив Самсона: 2,5 мл спиртового раствора фуксина 1:10 + 30 мл уксусной кислоты + 2 г карболовой кислоты + дистиллированной воды до 100 мл, время окрашивания 10-15 минут. Окрашенный препарат помещают в камеру Фукса-Розенталя объемом 3,2 мкл. Лейкоциты считают на малом увеличении во всех 256 квадратах, при высоком плеоцитозе 200-1000х106/л считают половину сетки и результат умножают на 2, при плеоцитозе свыше 1000х106/л подсчитывают один ряд больших квадратов и результат умножают на 4. Нормальные значения цитоза указаны в таблице 1, при различных видах патологии – в таблице 2. Цитоз в люмбальном ликворе
Плеоцитоз при различных заболеваниях
Количество эритроцитов в ликворе подсчитывают в счетной камере Горяева. Для этого СМЖ с примесью крови разводят в 10 раз — 9 частей изотонического раствора хлорида натрия и 1 часть СМЖ смешивают в пробирке. Полученную жидкость тщательно перемешивают, заполняют счетную камеру Горяева и, согласно правилам подсчета количества эритроцитов крови, определяют число эритроцитов в пяти больших квадратах. Количество эритроцитов в 1 мкл СМЖ определяют по формуле: где А – количество эритроцитов в 5 больших (80 малых) квадратах, 1/400 – объем малого квадрата, 10 – разведение ликвора, 80 – количество малых квадратов. При подсчете в камере Фукса-Розенталя в окрашенных фуксином клеточных и форменных элементах просматриваются структуры ядра и цитоплазмы, что позволяет проводить их дифференцировку. Оценку их проводят при увеличении 7х40. Регистрация результатов подсчета может иметь процентное или численное выражение (ликворограмма). Учитывая, что форменные и клеточные элементы могут подвергаться дегенеративным изменениям, при долгом нахождении в СМЖ, необходимо проводить оценку и подсчет форменных и клеточных элементов в окрашенных препаратах. Клетки ликвора имеют совершенно другое сродство к красящим веществам, чем клетки крови, поэтому и подбор красителей должен быть иным. Хорошие результаты дают следующие виды окраски препаратов: Окраска по Розиной. СМЖ центрифугируют 7–10 минут. Надосадочную жидкость сливают, осадок помещают на обезжиренное стекло, легким покачиванием распределяют его на поверхности стекла и через 1–2 минуты жидкость сливают. Стекло ставят в вертикальное положение и высушивают в сушильном шкафу при температуре 40–50 °С, после чего фиксируют 1–2 минуты метанолом и красят по Романовскому: препараты окрашивают 6–12 мин, в зависимости от толщины мазка. Препарат промывают дистиллированной водой и высушивают. Если ядра имеют бледно голубой цвет, мазок докрашивают еще 2–3 минуты. Окраска по Возной. Осадок, полученный при центрифугировании, выливают на стекло, слегка покачивая его, равномерно распределяют на поверхности. Высушивают при комнатной температуре в течение суток, фиксируют 5 минут метиловым спиртом. Затем окрашивают раствором азур эозина (таким же, как для окраски крови, но разведенным в 5 раз) в течение 1 ч. Если клетки бледноокрашены, докрашивает неразведенной краской под контролем микроскопа от 2 до 10 минут. Чем больше форменных элементов в ликворе, особенно при наличии крови, тем продолжительнее окраска. Окраска по Алексееву. На высохший, но не фиксированный препарат наносят 6–10 капель красителя Романовского–Гимзы, той же пипеткой осторожно распределяют её на весь препарат и оставляют на 30 секунд. Затем добавляют, не сливая краски, 12–20 капель дистиллированной воды, предварительно нагретой до температуры 50–60 °С, в соотношении 1 : 2. Покачиванием препарата перемешивают краску с водой и оставляют на 3 минуты. Смывают краску струёй дистиллированной воды, сушат препарат фильтровальной бумагой и микроскопируют. Метод пригоден для проведения срочного цитологического исследования. Нормальные значения содержания клеточных элементов в ликворе представлены в таблице 3. Содержание форменных элементов в ликворе в норме у детей и взрослых
Технология цитоцентрифугирования (цитоспин). Приготовление окрашенных препаратов ликвора из осадочной жидкости после центрифугирования не всегда позволяет получить тонкий слой клеток, пригодный для диагностики. Для решения этой проблемы была разработана технология цитоцентрифугирования, которая заключается в аппаратном изготовлении высококачественных препаратов. Для этого полученный ликвор подготавливают к исследованию и помещают в цитокамеру, после чего он дозированно подается на вертикально распложенные в роторе цитоцентрифуги слайды. Под действием центробежно силы клетки равномерно распределяются по стеклу, в то время как более легкая жидкость удаляется с поверхности препарата. Высушивание, фиксация и окраска препарата также проводятся в цитоцентрифуге. Аппарат позволяет создать до 8-ми диагностических зон на одном слайде. Атипичные клетки – чаще являются клетками опухолей ЦНС или её оболочек. Так же могут встречаться при хроническом воспалительном процессе (туберкулезный менингит, менингоэнцефалит, рассеянный склероз, энцефаломиелит) – это клетки эпендимы желудочковпаутинной оболочки, а так же лимфоциты, моноциты и плазмоциты с изменениями ядра и цитоплазмы. Измененные клетки и тени клетокобнаруживаются при длительномих нахождении в СМЖ. Чаще всего подвергаются аутолизу нейтрофильные гранулоциты, клетки паутинной оболочки, эпендимы желудочков. Диагностического значения измененные клетки и тени клеток не имеют. Кристаллыв ликворе обнаруживаются редко. На 4–5 день после субарахноидального кровоизлияния, черепно-мозговой травмы обнаруживаются кристаллы гемосидерина, в случае распада опухоли в содержимом кисты можно обнаружить кристаллы гематоидина, холестерина, билирубина, так же кристаллы холестерина образуются в очагах жировой дистрофии, некроза ткани мозга и в кистах мозга. Для выявления кристаллов в СМЖ используют реакции, представленные в таблице 4. Реакции, используемые для выявления кристаллов в ликворе
Элементы эхинококка – крючья, сколексы и обрывки хитиновой оболочки пузыря эхинококка могут быть выявлены при множественном эхинококкозе мозговых оболочек. Находят их чрезвычайно редко. Общеклиническое исследование ликвора Реакция ликвора. рН в норме слабощелочная (рН в пределах 7,4–7,5). Определение реакции СМЖ проводят с помощью тест-систем. Тестовое поле для определения рН содержит метиловый красный и бромтимоловый синий, а реагентная зона полосок содержит кислотно-щелочной индикатор бромтимоловый синий. Это обеспечивает различимое сочетание окраски от оранжевого через зеленый до синего при изменении рН в диапазоне 5–9. Каплю ликвора пипеткой наносят на реагентную зону. Оценка теста должна проводиться немедленно. При кровоизлиянии в мозг рН ликвора в норме или слабо кислая, особенно у больных с тяжелой формой, а при субарахноидальном кровоизлиянии рН ликвора становится кислой. Относительная плотность ликвора. Определение плотности проводят ареометром малого размера. Наиболее простым и доступным способом является использование диагностических полосок различных производителей, содержащих тестовую зону для определения относительной плотности. Повышение относительной плотности наблюдается при травмах головного мозга, менингитах (до 1,012–1,015), уремии, сахарном диабете и др. Уменьшается плотность при гидроцефалии, обусловленной гиперпродукцией СМЖ. Нормальные значения относительной плотности для люмбального ликвора 1,005-1,009, для субокципитального – 1,003-1,007, для вентрикулярного 1,002-1,004. Определение глобулинов методом высаливания (реакция Нонне-Апельта). Реакция основана на свойстве солей в определенной концентрации избирательно осаждать глобулины. Готовится насыщенный раствор сульфата аммония х.ч.: 85 г соли растворяют в 100 мл воды при кипячении. Полученный раствор выдерживают 48 ч при комнатной температуре, фильтруют и используют для постановки реакции. рН раствора нейтральная 7,0–7,1. В случае кислой реакции его подщелачивают крепким раствором аммиака. В пробирку вносят 0,5 мл ликвора, приливают 0,5 мл реактива и перемешивают (опыт). В контрольную пробирку равного диаметра наливают 1 мл воды (контроль). М.А. Базарнова и В.Т. Морозова (1988) советуют наливать в пробирку 0,25–1,0 мл насыщенного сульфата аммония (в зависимости от количества ликвора) и осторожно наслаивать на него равный объем ликвора. При положительной реакции на месте соприкосновения появляется беловатое кольцо. Результат определяют через 2–3 минуты. Заметив наличие кольца, пробирку встряхивают и оценивают степень образования мути. Регистрацию результатов реакции производят в течение 3 мин после смешивания ликвора с реактивом, так как в последующем помутнение может произойти и в нормальной СМЖ. Сравнение опыта с контролем производят на темном фоне. Для выражения результатов пользуются системой 4 плюсов: значительное помутнение 4 (++++); умеренное 3 (+++); заметная опалесценция 2 (++); слабая опалесценция 1 (+); Реакция дает относительное представление о нормальном и патологическом содержании глобулинов в ликворе. Слабую опалесценцию иногда находят и в нормальной спинномозговой жидкости при небольшом повышении содержания общего белка (больше 0,2 г/л). Наиболее достоверное представление о содержании глобулинов и их фракций можно получить при электрофоретическом исследовании ликвора, которое целесообразно проводить при положительной реакции Нонне–Апельта. Определение глобулинов реакцией Панди. Реакция основана на осаждении глобулинов насыщенным раствором карболовой кислоты. Готовится насыщенный раствор карболовой кислоты: 100 г карболовой кислоты растворяют в 1 л воды, встряхивают и оставляют в термостате при 37°С на 6—8 ч. После пребывания при комнатной температуре в течение 7 дней надосадочную жидкость сливают и используют в качестве реактива. На часовое стекло, помещенное на черную бумагу, наливают 1 мл реактива и по краю наслаивают 1–2 капли ликвора. В случае положительного результата в месте соприкосновения реактива с СМЖ образуется молочно-белое облачко, переходящее в муть. Для обозначения результатов реакции Панди пользуются системой четырех плюсов: значительное помутнение 4 (++++); умеренное 3 (+++); заметная опалесценция 2 (++); слабая опалесценция 1 (+). Реакция Панди осаждает такие белковые фракции, которые остаются неосажденными в реакции Нонне—Апельта, поэтому целесообразно ставить обе реакции одновременно. Определение белка полуколичественным методом (с помощью тест-систем). Диагностические полоски можно использовать в качестве ориентировочного метода определения белка ликвора, так как эти тест-системы позволяют определить практически только альбумин (АльбуФАН, Урискан, Урибел). Индикатор бромтимоловый синий в присутствии альбумина меняет исходно желтоватый цвет на бледно-зеленый, насыщенно-зеленый или темно-зеленый в зависимости от содержания альбумина в ликворе. Для проведения анализа тест-полоску погружают в ликвор до отмеченной линии строго на тот временной промежуток, который указан производителем в инструкции (для теста АльбуФАН он составляет 2-3 секунды). Излишки жидкости удаляют постукиванием ребра полоски о край пробирки. Результат считывают спустя 45-60 секунд в помещении с температурой воздуха от +15 до +30 градусов С. Цвет индикаторной зоны сравнивают с цветами, указанными на тубе с тест-полосками, он меняется в зависимости от концентрации альбумина в ликворе. Через 5 минут от проведения исследования результаты считаются недостоверными и считывать их нельзя. Реагентные зоны соответствуют концентрации альбумина: 0,15, 0,3, 1,0; 3,0 и ≥10,0 г/л. Если цвет реактивной зоны оказывается между цветами двух соседних этикеток, то результат определяется по наиболее близкой цветной зоне шкалы. Определение белка фотоколориметрическим методом (Белур 600). Метод основан на изменении оптической плотности ликвора после добавления в него реагента, связывающего белок (пиррагололового красного, сульфосалициловой кислоты, бриллиантового синего). Учет реакции проводится при помощи аппарата Белур 600 – миниатюрного и простого в эксплуатации фотоколориметра. В него помещают прозрачную кювету с реакционной смесью, через которую аппарат пропускает оранжевый свет с длиной волны 600 нм. С противоположной стороны световые волны воспринимает фотоэлемент, таким образом определяется количество поглощенного раствором волн света. Существует прямая связь между количеством белка и изменением оптической плотности раствора, по которой аппарат расчитывает концентрацию общего белка в растворе. Реакция Фридмана–Ференца.Используется для ранней диагностики менингита. Метод основан на окислительно-восстановительной реакции раствора перманганата калия и осаждении белка трихлоруксусной кислотой. Реактивы: 1% водный раствор перманганата калия, приготовленный на бидистиллированной воде и постоявший не менее 2–3 недель; 20 % раствор трихлоруксусной кислоты х.ч. К 1 мл СМЖ прибавляют 0,05 мл (1 каплю) реактива 1, смесь хорошо взбалтывают. В нормальном ликворе наблюдается яркое фиолетовое окрашивание, которое долго сохраняется. Цвет не меняется от прибавления 2–3 капель реактива 2. В ранней стадии менингита при смешивании ликвора с раствором перманганата калия фиолетовый цвет очень быстро (в течение 1–2 мин) переходит в красно-желтый и коричнево-желтый цвет. При добавлении трихлоруксусной кислоты (реактив 2) в случаях гнойного менингита цвет доходит до светло-желтого или наступает полное обесцвечивание с одновременным помутнением и осаждением белка. Изменения цвета по описанному типу не наступает при других органических поражениях мозга: травме, опухолях мозга, сифилисе мозга, рассеянном склерозе, протекающих без менингеальных симптомов. Метод относится к качественным реакциям. В настоящее время постановка реакции Фридмана–Ференца нецелесообразна в КДЛ, поскольку основной реактив перманганат калия включен в список препаратов ограниченного использования. Метод определения белка с сульфосалициловой кислотой. Интенсивность помутнения при коагуляции белка сульфосалициловой кислотой пропорциональна его концентрации. Реактивы: 6% раствор сульфосалициловой кислоты (ССК). 14% раствор безводного сульфата натрия. Для анализа применяют свежеприготовленную смесь равных объемов этих реактивов (рабочий раствор) 3. Стандартный раствор альбумина – 1 % раствор: 1 г лиофилизированного альбумина (из человеческой или бычьей сыворотки) растворяют в небольшом количестве 0,9% раствора хлорида натрия в мерной колбе вместимостью 100 мл и доводят объем раствором хлорида натрия до метки. Реактив нестойкий. Для стабилизации к стандартному раствору прибавляют 1 мл 5% раствора азида натрия (NaN3) В этом случае при хранении в холодильнике реактив годен к употреблению в течение 2 мес. 1 мл раствора содержит 10 мг альбумина 4. 0,9% раствор хлорида натрия. Для учета результата реакции использую фотоколориметр. В пробирку наливают 5 мл свежеприготовленного рабочего раствора и 0,5 мл ликвора. Тщательно перемешивают. Через 10 мин интенсивность помутнения измеряют на фотоэлектроколориметре в кювете с длиной оптического пути 1 см против контроля, длина волны 410–480 нм (сине-фиолетовый светофильтр). В контроль вместо реактива берут 0,9% раствор хлорида натрия. Расчет ведут по калибровочному графику. Недостатками метода при определении белка в СМЖ сульфосалициловым методом являются: низкая устойчивость комплекса, образующегося при взаимодействии белка с ССК; сложная, нелинейная зависимость оптической плотности реакционной смеси от концентрации белка; влияние лекарственных веществ на результаты анализа, так искажение результатов может быть следствием приема препаратов аспирина, хлорпромазина, имипрамина, лидокаина, метицилина, метотрексата, морфина, пенициллина, фенацетина, прокаина, стрептомицина, тирозина, ибупрофена, сулиндака; неполная преципитация ряда белков анализируемой пробы, приводящая к заниженному результату определения общего белка; обязательно построение калибровочного графика, так как использование расчетных коэффициентов невозможно, в связи с тем, что зависимость оптической плотности от концентрации белка не является прямопропорциональной. Перед опытом целесообразно поставить реакцию Панди (качественная проба на белок), и если результат реакции оценивают 3+ или 4+, то перед количественным исследованием ликвор надо развести изотоническим раствором хлорида натрия и при расчете учесть степень разведения. Прямолинейная зависимость при построении калибровочного графика сохраняется до 0,6 г/л, поэтому при более высоких концентрациях белка ликвор следует разводить. Обязательно колориметрировать опытную пробу против холостой, так как выраженная окраска СМЖ может приводить к ошибкам при определении концентрации белка (завышение результатов) при колориметрии против воды. Если муть начинает оседать, перед измерением на фотоэлектроколориметре пробирку следует тщательно встряхнуть. Биохимическое исследование ликвора Определение глюкозы. Для определения глюкозы в ликворе применяют те же методы, что и для выявления глюкозы в крови. Чаще всего — ферментативный (глюкозооксидазный) и ортотолуидиновый методы. Во избежание гликолиза определять содержание глюкозы нужно не позднее чем через 3–4 ч после пункции. Определение глюкозы с помощью тест-систем.Используются преимущественно для выявления гипергликоархии. Детекция глюкозы основывается на специфической глюкозо-пероксидазной реакции, способствующей окислению индикатора, который изменяет свою окраску. В ходе реакции отмечается последовательное изменение цвета от желтого (норма) через светло-зеленый до темно-зеленого. рН образца не влияет на результаты анализа. Практический лимит чувствительности составляет 2,2 ммоль/л. У здорового человека содержание глюкозы в СМЖ колеблется в пределах 2,8–3,9 ммоль/л. В субокципитальном и вентрикулярном ликворе концентрация глюкозы на 12–15% выше, чем в люмбальном ликворе. Содержание глюкозы в ликворе у новорожденных и недоношенных несколько выше, что обусловлено недостаточностью гематоэнцефалического барьера. Источником ее является глюкоза крови. Проникновение глюкозы из крови в ликвор происходит не только через сосудистое сплетение, но и через оболочки мозга по всей его поверхности. Определение глюкозы в ликворе желательно проводить одновременно с исследованием ее в крови через 4–6 час после приема пищи. При нормальном уровне глюкозы в крови, в люмбальном ликворе концентрация глюкозы составляет примерно 60% уровня в плазме. При гипергликемии разница между ликвором и кровью возрастает значительно, в ликворе глюкоза достигает только 30–35% уровня плазмы. Концентрация глюкозы в ликворе является результатом активного транспорта через ГЭБ, утилизации клетками паутинной оболочки, эпендимы, глии, нейронами и выхода в венозную систему. Уровень глюкозы в ликворе является одним из важных индикаторов функции ГЭБ и широко используется для его оценки. Глюкоза является основным субстратом для нейронов. Несмотря на то, что большинство нейронов получают глюкозу из кровотока, тем не менее, у части из них, прилегающих к желудочкам мозга, может нарушаться трофика при изменении концентрации глюкозы в ликворе. Исследование электролитов. В СМЖ обнаружены электролиты, которые установлены и в плазме крови, но в различной концентрации. В нормальных условиях концентрация электролитов в ликворе постоянна и мало зависит от изменений в крови. Определение концентрации хлоридов, калия, натрия в ликворе производят так же, как при исследовании крови. У здорового человека содержание хлоридов в СМЖ варьирует в пределах 120–130 ммоль/л. Хлор является основным анионом в СМЖ. Содержание хлора в ликворе зависит от его уровня в плазме крови. Нормальное содержание хлоридов наблюдаются при энцефалите, полиомиелите. Понижение содержания хлоридов в ликворе (гипохлорархия) является постоянным признаком менингита, особенно туберкулезного. Снижение содержания хлоридов часто наблюдается параллельно уменьшению количества глюкозы. Какой-либо зависимости между содержанием в СМЖ хлоридов и белка, а также плеоцитозом при менингитах не установлено. Понижение содержания хлоридов отмечается при нейросифилисе, бруцеллезе, компрессионных синдромах с выраженной гиперпротеинархией, при мозговых опухолях, вовлекающих мозговые оболочки; повышение — в спорадических случаях при прогрессивном параличе, заболеваниях почек (особенно уремии), сердечной декомпенсацией, рассеянном склерозе, опухолях мозга, абсцессе мозга, эхинококкозе. Субарахноидальное кровотечение в первые сутки дает легкую гиперхлорархию, после чего наступает гипохлорархия. Повышение содержания хлоридов в СМЖ, патогномоничного для какого-либо заболевания не наблюдается. Причины изменения содержания хлоридов до конца не ясны, очевидно, лишь, что оно обусловлено не только физико-химическими закономерностями, а имеет сложный генез. Содержание калия у здорового человека 2,6–2,9 ммоль/л. Повышение концентрации калия в СМЖ наблюдается при атеросклерозе, геморрагии, уремических энцефалитах, после эпилептических припадков. Незначительное уменьшение содержания калия отмечается при опухолях, вовлекающих оболочки мозга. Особенно характерно значительное увеличение концентрации калия в цистернальном ликворе непосредственно перед смертью — уровень калия может достигать 40 ммоль/л. Нормальные величины натрия139,9–156,1 ммоль/л и находится в прямой зависимости от его уровня в плазме крови. Скорость ликворообразования определяется скоростью переноса натрия через хориоидальное сплетение и доставки путем транскапиллярного обмена с мозгом при экстрахориоидальном ликворообразовании. Повышение концентрации натрия наблюдается при тяжелых почечных, эндокринных заболеваниях, систематических погрешностях в диете, у больных эпилепсией непосредственно перед припадком и после него, при субарахноидальном кровоизлиянии. Кальций – нормальные величины 1–1,5 ммоль/л. Концентрация кальция незначительно повышается при гнойных менингитах, туберкулезном менингите, некоторых травмах ЦНС. Уменьшение концентрации кальция в ликворе наблюдается при гипокальциемии и в послеоперационном периоде. Уровень кальция остается практически без изменений при эпилепсии, рассеянном склерозе, нейросифилисе, большей части менингитов и менингоэнцефалитов. Неорганический фосфор – в норме содержание его в ликворе 0,4-0,8 ммоль/л. Существует положительная корреляционная связь между уровнем фосфора и концентрацией общего белка. Повышение концентрации фосфора наблюдается при острых воспалительных процессах, туберкулезном менингите. Уменьшение содержания фосфора в ликворе встречается крайне редко. Магний – нормальные величины 1,05–1,07 ммоль/л. Снижение концентрации магния наблюдается при менингитах, особенно гнойных, при некоторых опухолях ЦНС, энцефалитах, нейросифилисе, алкоголизме, циррозах, энцефалопатии. Исследование липидов. Нервная ткань имеет достаточно специфичный липидный спектр, который в норме и при патологических состояниях находит свое отражение в СМЖ. Общие липиды – в норме концентрация общих липидов в ликворе очень низкая и составляет 0,01–0,02 г/л. Повышение уровня общих липидов отмечается при рассеянном склерозе, кровоизлияниях в мозг, менингитах (особенно туберкулезном), опухолях и полиневропатии. Достаточно характерно увеличение их содержания у больных с гиперлипидемией, метахромной лейкодистрофией, инфантильной амавротической идиотией, липоидозом (болезнь Ниманна–Пика и Тея–Сакса). Значительное повышение концентрации общих липидов наблюдается при менингиоме, невриномах и бактериальных менингитах. Снижение концентрации может обнаруживаться у детей с гидроцефалией. Холестерин – в норме в СМЖ содержится 12,0–14,0 мкмоль/л. В ликворе обнаружен свободный и эстерифицированный холестерин. На долю последнего приходится 2/3 от общего количества. Увеличение уровня общего холестерина отмечается при гнойном и туберкулезном менингитах, нейросифилисе, невриномах, менингиомах, субарахноидальном кровоизлиянии, мозговом инсульте. Повышение уровня холестерина при нормальной концентрации белка в СМЖ наблюдается у небольшого числа больных с мозговыми травмами, эпилепсией, некоторыми опухолями, спинной сухотке, амавротической идиотией, боковым амиотрофическим склерозом. При рассеянном склерозе количество свободного холестерина увеличивается при нормальном или слегка повышенном уровне общего холестерина. Фосфолипиды – в норме составляют 1,5% от уровня фосфолипидов в плазме крови. Основными составляющими фосфолипидов СМЖ являются сфингомиелин (миелинового и немиелинового типа), лизолецитин, инозитолфосфатид, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин. Разные заболевания приводят к изменениям содержания общих фосфолипидов или их отдельных фракций. Повышение концентрации общих фосфолипидов характерно для некоторых хронических демиелинизирующих заболеваний (боковой амиотрофический склероз, невральная амиотрофия), метахроматической лейкодистрофии, липоидозов, менингиом. Увеличение уровня общих фосфолипидов при гиперпротеинрахии не имеет большого диагностического значения. Увеличение содержания кефалина и сфингомиелинапри одновременном снижении концентрации общих фосфолипидов наблюдается у больных с рассеянным склерозом. Изменения количества этих фракций происходят параллельно с обострением или ремиссией болезни. При метахромной лейкодистрофии также отмечается повышение значений кефалина и сфингомиелина. Исследование активности ферментов ликвора. В СМЖ обнаружены почти все ферменты, принимающие участие в обмене веществ в мозге. Однако вследствие низкого содержания в ликворе определение их активности связано с рядом трудностей. Исследование активности ферментов в СМЖ базируется в основном на методах, используемых для сыворотки. Диагностической ценностью обладает определение следующих ферментов в ликворе: Лактатдегидрогеназа – нормальные величины 5,0–40,0 МЕ/л. Активность повышается у больных с сосудистыми заболеваниями, опухолями ЦНС, особенно с метастазами, бактериальными менингитами, травмами мозга. Общая активность ЛДГ в ликворе при тяжелых ЗЧМТ превышает нормальные величины в 10–18 раз и более. Соотношение активности ЛДГ венозной крови и ликвора является прогностическим критерием травмы. Исследование изоферментного спектра ЛДГ оказывается более информативным, чем общей активности. Лейцинаминопептидаза – нормальные величины 0,0–3,0 МЕ/л. Активность фермента повышается у больных с опухолями ЦНС и церебральной атрофией без соответствующего увеличения активности в сыворотке крови. Отмечено повышение активности лейцинаминопептидазы при менингитах, особенно пневмококковых. Фосфатазы – щелочная и кислая – нормальные величины 0,0–6,0 МЕ/л и 0,0–2,0 МЕ/л соответственно. Активность фосфатаз повышается при менингитах и полиомиелите. Уровень ЩФ значительно повышается при нейтрофильном плеоцитозе. По данным некоторых авторов, увеличение активности фермента является характерным признаком туберкулезного менингита. Повышение активности ЩФ в ликворе также показательно для инсульта. Увеличение активности КФ в ЦСЖ наблюдается при церебральной атрофии в результате пресенильной деменции или сосудистых заболеваний, при хорее Гентингтона. У больных с пресенильной деменцией повышенная активность КФ отражает степень мозговой атрофии. Холинэстеразы – истинная (ацетилхолинэстераза) и псевдохолинэстераза – нормальные величины: общаяхолинэстераза – 17,5±4,1 МЕ/л, истинная --1,2±0,9 МЕ/л, псевдохолинэстераза – 11,3±2,9 МЕ/л. Ацетилхолинэстераза содержится главным образом в нейронах мозга и эритроцитах, псевдохолинэстераза – глиальных клетках, плазме крови и внутренних органах. Повышение общей активности холинэстеразы наблюдается при менингитах, синдроме Гийена–Барре и гидроцефалии. При этих состояниях повышение активности фермента обусловлено псевдохолинэстеразой, что объясняется повреждением ГЭБ. У больных с опухолями мозга и мозговой деструкцией повышается содержание общей холинэстеразы. При миастении отмечается повышение активности истинной холинэстеразы. У больных с рассеянным склерозом определяется снижение активности данного фермента. Ацетилхолинэстеразная активность незначительно снижается при сенильной деменции типа Альцгеймера и значительно – при тяжелой деменции. Это обусловливается потерей холинэргических нейронов или расстройствами холинэргического метаболизма в мозге. |
