Флотация. ФЛОТАЦИЯ КАК СПОСОБ ОБОГАЩЕНИЯ. Флотация как способ обогащения
 Скачать 156.43 Kb. Скачать 156.43 Kb.
|
|
Дисциплина: Технологический процесс обогащения Тема: ФЛОТАЦИЯ КАК СПОСОБ ОБОГАЩЕНИЯФлотация представляет собой метод обогащения полезных ископаемых на промышленных предприятиях. Этот способ основан на способности одних частиц – гидрофильных - легко смачиваться жидкостью и отделяться от других частиц – гидрофобных. Процесс происходит в жидкой среде, которая аэрируется воздухом или в которую вводятся капельки масла. Разделение руды на элементы происходит на границе двух разных средств. Во флотационной установке гидрофобные частички прилипают к пузырькам газа или масла и поднимаются на поверхность, в то время как гидрофильные элементы оседают на дне емкости. Этот процесс имеет высокую эффективность и экономичность. Полная автоматизация позволяет уменьшить себестоимость технологических операций на обогатительной фабрике и в гидрометаллургии. Более подробно о том, что это такое – флотация, а также в каких сферах она используется, читайте далее. Методы флотацииВ зависимости от того, каким образом создается межфазная граница между средами, используются четыре разных способа флотации: Масляная. Используется для добычи сульфидных минералов, которые смачиваются в руде маслом и всплывают на поверхность воды, в то время как порода оседает вниз. Пленочная. Принцип работы этого оборудования основан на способности мелких гидрофобных частиц удерживаться на поверхности воды. Пенная. В установках через смесь руды в воде пропускаются маленькие пузырьки воздуха, которые всплывают на поверхность и собираются с нее. Помимо воды, в качестве флотационной жидкости могут использоваться другие вещества. Электрофлотация. Всплытие на поверхность жидкости частиц осуществляется за счет выделения электролитических газов в жидкости. Где применяется флотацияБлагодаря универсальности и эффективности метода технология флотации используется при добыче таких полезных ископаемых6 Серы; Золота (обработка золотосодержащих руд); Угля (обогащение угольных шламов); Железных руд; Меди (обогащение медной руды). Способы использования флотационных устройствРассматриваемая обогатительная технология в зависимости от типа используемого устройства позволяет решить несколько различны задач: Получение концентрата полезного ископаемого из руды, в которой содержится минимальное количество металла. Таким образом производится добыча меди, золота, титана, графита, песка для производства стекла и известняка для изготовления цемента. Разделение пульпы на несколько компонентов, которые затем используются для производства. Таким образом сортируют руду и выделяют из нее несколько разных видов полезных ископаемых. Помимо перечисленных задач, флотационные устройства могут применяться для выделения солей из перенасыщенного раствора, для очистки каучука естественного происхождения от посторонних примесей, а также очистки бытовых и промышленных канализационных стоков. Разновидности оборудованияДля обогащения руд методом флотации используются такие типы и виды оборудования: Механические установки – перемешивание пульпы, а также диспергирование воздуха производится с помощью импеллера. Он создает водяной вихрь, который распределяет засасываемый воздух на пузырьки. Пневматическое оборудование – насыщение воды воздухом производится с помощью аэраторов. Для разделения на пузырьки воздушный поток пропускается сквозь поры. Комбинированное – В этом случае воздух распределяется на пузырьки с помощью сит, а перемешивание обрабатываемого материала и распределение пузырьков по емкости осуществляется с помощью импеллера. При покупке оборудования необходимо обращать внимание на объем камеры, пропускную способность установки, мощность привода импеллера, удельный расход воздуха и другие характеристики. «Теоретические основы процесса флотации» Для осуществления процесса флотации в суспензию, представляющую собой смесь тонкоизмельченного материала с водой, загружают флотационные реагенты, изменяющие степень смачиваемости поверхности материалов. Под действием флотационных реагентов поверхность одних частиц смачивается водой (гидрофильная), а поверхность удаляемых материалов не смачивается водой (гидрофобная). Так, реагенты-собиратели закрепляются на поверхности материалов, которые становятся гидрофобными и могут прилипнуть к пузырьку воздуха. Для наилучшего контакта реагентов-собирателей с частицами материалов суспензия перемешивается определенное время, после чего в нее загружают реагенты-пенообразователи для лучшего диспергирования воздуха и создания прочных воздушных пузырьков, способных поднять на поверхность суспензии частицы материалов. Гидрофобные частицы, прилипшие к пузырькам, выносятся на поверхность суспензии, где образуют слой пены, которая снимается в виде пенного продукта или концентрата. 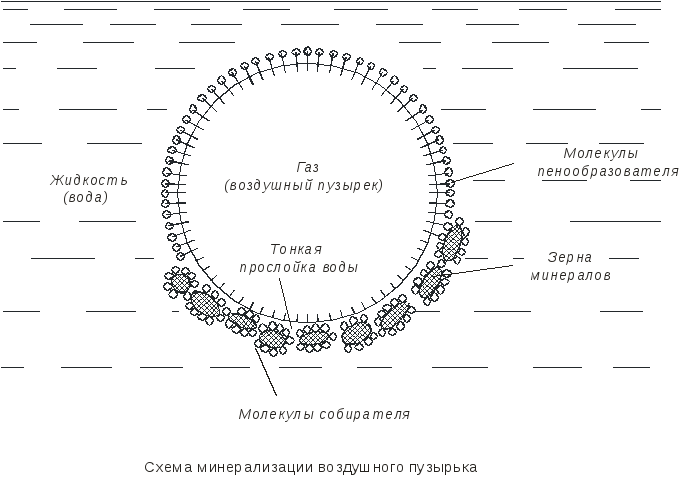 Рис.1. Схема минерализации воздушного пузырька На рис.1. схематически показана минерализация пузырьков воздуха и образование минерализованной пены в аппарате при флотации. Процессы смачивания. Физико-химические явления, происходящие при флотации, очень сложны. Во флотационном процессе участвуют три фазы - твердая (частица материала), жидкая (вода) и газообразная (воздух), поэтому поверхностные явления, происходящие при флотации, необходимо рассматривать на границе раздела фаз: жидкой - газообразной (Ж - Г), твердой - жидкой (Т - Ж) и твердой - газообразной (Т - Г). 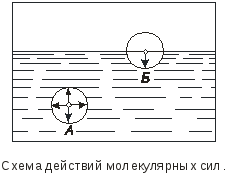 Рис.2.Схема действия молекулярных сил Всякая поверхность раздела двух фаз резко отличается по физико-химическим свойствам от объема граничных фаз. Это различие заключается в том, что на поверхности раздела фаз имеется избыток свободной энергии. На рис.2. схематически показаны силы, действующие на молекулы А и Б, расположенные внутри жидкой фазы и на границе жидкой и газообразной фаз. На молекулу А, находящуюся внутри жидкости, действуют силы взаимного притяжения со стороны всех окружающих соседних молекул. В результате этого силы притяжения молекул взаимно уравновешены, сами молекулы находятся в равновесии и для их перемещения внутри жидкости не нужно затрачивать работу. Силы молекулярного сцепления действуют лишь на близких расстояниях, поэтому молекулы испытывают притяжение со стороны ближних молекул. Для молекулыА, расположенной на поверхности жидкости, не все силы молекулярного сцепления уравновешены. Это объясняется тем, что молекулы воздуха в газообразной фазе удалены на значительные расстояния друг от друга и силы их взаимного притяжения ничтожны. Поэтому молекулы, находящиеся на поверхности, испытывают притяжение только со стороны молекул жидкости. Эти силы не уравновешены и направлены внутрь жидкой фазы, т.е. они стремятся втянуть молекулы внутрь жидкости. Чтобы создать новую поверхность раздела, необходимо затратить работу против молекулярного сцепления. Работа, затрачиваемая на образование 1 м2 поверхности раздела фаз, или эквивалентная ей свободная энергия, приходящаяся на 1 м2 поверхности, называется поверхностным натяжением. Оно обозначается буквой σ (сигма) и измеряется в Дж/м2 или Н/см. Поверхностное натяжение является очень важной характеристикой поверхности раздела фаз. Поверхностное натяжение воды при 20 °С равно 7,275 Н/м2. Его можно изменить, растворяя в воде различные вещества. Вещества, растворимые в воде и уменьшающие поверхностное натяжение, называются поверхностно-активными (ПАВ). Обычно это органические соединения, в молекулы которых одновременно входят полярная группа (ОН, СООН, NH2) и аполярная группа (углеводородная цепь). Растворимые вещества, например неорганические соли, повышающие поверхностное натяжение, называются поверхностно-инактивными. В зависимости от химической активности и строения различают полярные, аполярные и гетерополярные вещества. Полярными веществами называют химические соединения, хорошо растворимые в воде и обладающие значительной поверхностной энергией. Молекулы полярных веществ диссоциируют на ионы. К ним относятся органические кислоты и соли, некоторые минералы др. Аполярные вещества, наоборот, химически мало активны, плохо растворяются в воде и не смачиваются ею, обладают незначительной поверхностной энергией и не распадаются в воде на ионы. К ним относятся минеральные масла, жиры и другие органические соединения. Вещества, в состав молекул которых одновременно входят полярная группа и аполярная углеводородная цепь, называются гетерополярными (рис.3.). 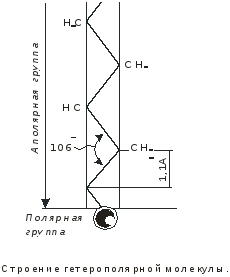 Рис. 3.Строение гетерополярной молекулы Если такое соединение растворить в воде, то его молекулы будут стремиться выйти на поверхность раздела фаз, где концентрация их больше, чем в объеме раствора. Гетерополярные молекулы ориентируются на границе раздела жидкость - газ так, что полярные группы направлены в воду, а аполярные углеводородные цепи - в воздух. Это объясняется тем, что аполярная группа почти не имеет сродства с водой и выталкивается в воздух. Молекулы ПАВ за счет полярной группы, наоборот, имеют сродство к более полярной фазе - воде. Таким образом, в результате концентрации гетерополярных молекул на границе раздела жидкость - газ происходит снижение поверхностного натяжения. Такая самопроизвольная концентрация вещества на границе раздела двух фаз называется адсорбцией. Адсорбция сопровождается уменьшением свободной энергии (поверхностного натяжения). Адсорбцию Г (моль/см2) на поверхности раздела фаз можно вычислить, измерив поверхностное натяжение раствора концентрацией С (моль/л). Уравнение, связывающее адсорбцию с изменением поверхностного натяжения, было предложено Гиббсом: где R - газовая постоянная, Дж/(моль∙град); Т - абсолютная температура, °К. Изменение поверхностного натяжения характеризуется производной dσ/dс в зависимости от концентрации вещества. Как видно из уравнения Гиббса, адсорбция положительна, когда производная dσ/dс отрицательна. В этом случае растворимое вещество будет понижать поверхностное натяжение и концентрация его в поверхностном слое будет больше, чем в объеме раствора. При отрицательной адсорбции, когда производная dσ/dс положительна, концентрация растворенного вещества в поверхностном слое меньше, чем в объеме раствора, и поверхностное натяжение повышается. 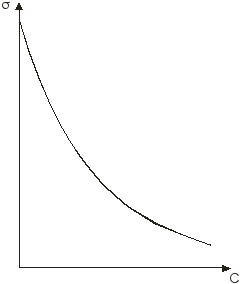 Рис.4.Зависимость поверхностного натяжения σ от концентрации С поверхностно-активного вещества Зависимость между поверхностным натяжением и концентрацией раствора ПАВ выражается графиком (рис.9.4.), который можно построить по экспериментальным данным. Используя такой график и уравнение Гиббса, можно путем расчета определить адсорбцию для ряда концентраций. Зависимость адсорбции от концентрации выражается также уравнением Лангмюра: г 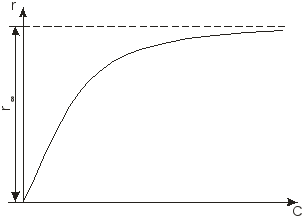 Рис. 5.Зависимость величины адсорбции Г от концентрации С де Очень удобно для математического описания адсорбции использовать уравнение Фрейдлиха в логарифмической форме: где k и n - постоянные величины при Т = const. Как видно из рисунка, зависимость адсорбции от концентрации имеет линейный характер, что позволяет графически определять значение постоянных k и п. Однако, уравнение Гиббса не применяется при высоких равновесных концентрациях. В этом случае применяют уравнение Лангмюра. Рассмотрим явление смачивания поверхности твердого тела водой. Вода является одной из взаимодействующих фаз и средой, в которой происходит разделение материалов при пенной флотации. Поэтому взаимодействие материалов с водой можно рассматривать как смачивание поверхности материалов, что в свою очередь связано с явлением гидратации. Молекула воды характеризуется несимметричным расположением атомов и поэтому в молекуле имеется два полюса - положительный и отрицательный. В целом же молекула нейтральна. Такая молекула называется полярной. За меру полярности принят дипольный момент µ который равен произведению заряда е на расстояние между полюсами l, т.е. μ = el. Дипольный момент воды равен 1,85 Д (Дебая), D = 1∙1018 электростатических единиц. Наличие дипольного момента у молекулы равнозначно наличию электрического поля, поэтому, если в непосредственной близости от полярной молекулы находится другая молекула, то она испытывает действие электрического поля. Так как вода обладает высоким дипольным моментом, то многие вещества под действием диполей воды диссоциируют на ионы, растворяются и гидратируются. Вокруг ионов в воде мгновенно образуется уплотненный слой диполей воды, т.е. ион гидратируется. Образование такой гидратной оболочки означает, что энергия связи между гидратированным ионом и диполями больше, чем между диполями воды. Образование гидратной оболочки вокруг молекул определяется их полярностью. Полярные молекулы гидратируются сильнее, аполярные - слабее. А гетерополярные молекулы гидратируются в зависимости от своей структуры различно. В молекуле будет гидратироваться наиболее сильно полярная группа, в то время как аполярная группа гидратируется намного слабее. Явление гидратации, таким образом, тесно связано с явлением смачивания. Явление смачивания твердых минеральных поверхностей является одним из основных физико-химических явлений, определяющих поведение минералов при флотации. 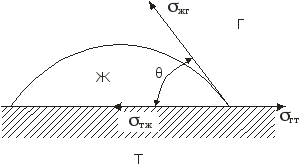 Рис.9.6.Схема действия поверхностных сил при смачивании твердой поверхности водой Рассмотрим процесс смачивания минеральной поверхности водой. Если на поверхность минерала (твердая фаза Т) в воздушной среде (газообразная фаза Г) поместить каплю воды (жидкая фаза Ж), то через некоторое время система придет в равновесие, и капля воды примет определенную форму (рис. 9.6.). Тогда на границе раздела трех фаз поверхностное натяжение будет на границе Ж :Т - σжт , на границе Ж:Г - σжг, на границе Г:Т - σгт. Возможность смачивания минеральной поверхности можно определить по работе адгезии. Так как под адгезией понимается взаимодействие жидкой и твердой фаз на границе раздела этих фаз, то работа адгезии есть работа, затрачиваемая на отрыв этих разнородных фаз. Когезия жидкости - это взаимодействие между молекулами в объеме жидкой фазы, а работа когезии равна работе, которую необходимо приложить, чтобы преодолеть взаимодействие между молекулами жидкости. Эта работа равна удвоенному значению поверхностного натяжения вновь образовавшихся при отрыве жидких фаз: Работа адгезии связана с изменением поверхностного натяжения на границе раздела фаз: В этом уравнении экспериментально можно определить лишь σГЖ. Поэтому Wадг определяют косвенным путем. Составим уравнение равновесия поверхностных сил на границе раздела трех фаз: где Тогда равновесное значение краевого угла смачивания можно определить из уравнения: Подставляя это равенство в уравнение работы адгезии, получим Краевой угол измеряется всегда в жидкую фазу. Величина cos На абсолютно несмачиваемых поверхностях (гидрофобная поверхность) Таким образом, с гидрофобной поверхности воздух легко вытесняет воду и прилипает к этой поверхности. Абсолютно гидрофобных тел в природе нет. Даже на парафине краевой угол равен 104 ÷ 107°. Примером гидрофильного материала может служить кварц. При прилипании частицы материала к пузырьку воздуха обязательно образуется краевой угол, и чем он будет больше, тем прочнее прилипание. Величину краевого угла, а тем самым косинус его можно изменять, обрабатывая поверхность материала флотационными реагентами, и по его величине судить о способности материалов смачиваться водой, т.е. о флотируемости. Краевой угол, таким образом, является мерой смачиваемости поверхности. Практика флотации показывает, что частицы материала могут флотироваться не только тогда, когда краевой угол больше 90°, но и тогда, когда значение его меньше 90°. Многие материалы флотируются при = 10 ÷ 15°. Замеряя величину краевого угла, можно качественно определять флотируемость минералов. Флотационную активность материалов методом измерения краевых углов определяют на минеральных шлифах. Практически во флотационной суспензии краевой угол замерить невозможно. Следует отметить, что рассмотренные зависимости будут справедливы лишь для статических условий, в то время как процесс прилипания частиц к пузырькам воздуха происходит в суспензии при непрерывном и интенсивном перемешивании. Поэтому необходимо процесс прилипания оценивать и кинетически. Прилипание, а следовательно, и флотируемость материалов зависит от большого количества факторов, к которым можно отнести физико-химические свойства поверхности флотируемых материалов, их крупность, характер и концентрацию флотационных реагентов, степень перемешивания суспензии, количество и крупность пузырьков воздуха в суспензии, вероятность столкновения частиц с пузырьками. Смачивание поверхности материалов осложняется гистерезисом смачивания. Если на горизонтальную поверхность материала в воде поместить пузырек воздуха, то образуется определенный равновесный краевой угол (рис. 9.7.). При наклоне пластинки периметр прикрепления пузырька, или периметр смачивания, остается неизменным, а величина краевого угла изменится. Причем угол 2, называемый оттекающим, будет больше равновесного, а натекающий угол - меньше равновесного. Таким образом, изменение периметра смачивания отстает от изменения краевого угла. Это отставание в изменении периметра смачивания называется гистерезисом смачивания. 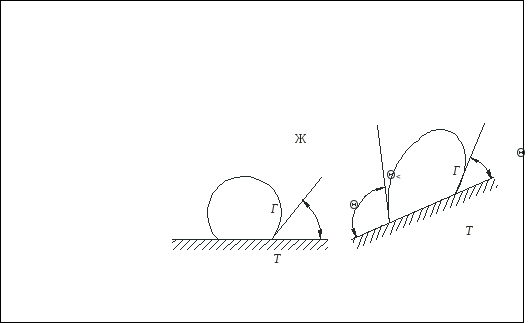 Рис. 7.Явление гистерезиса Гистерезис объясняется неровностями (шероховатостью) твердой поверхности, силами трения, образованием на поверхности материалов адсорбционного слоя ориентированных молекул, аполярные концы которых могут препятствовать растеканию воды на твердой поверхности. На шероховатой, неровной поверхности минерала гистерезис смачивания всегда выше, поэтому прилипание пузырьков воздуха к такой поверхности и флотируемость частиц улучшаются. В процессе флотации пузырек воздуха минерализуется благодаря прилипанию к нему большого количества частиц. Прилипание и флотация частиц происходят после столкновения их с пузырьком воздуха и разрыва водной прослойки между ними. Столкновение пузырьков с частицами чаще всего происходит при движении пузырьков снизу вверх, когда частица под действием силы тяжести падает, или при движении частицы вверх, когда поднимающийся пузырек движется с большой скоростью и сталкивается с ней. После столкновения частица огибает пузырек, толщина водной прослойки между ними постепенно уменьшается. Если поверхность материала плохо смачивается, то прослойка воды неустойчива и, достигнув малой величины (толщины в несколько молекул), разрывается самостоятельно, но не до конца. Оставшаяся тонкая устойчивая пленка не препятствует прилипанию твердой частицы к пузырьку. Работами Б.В. Дерягина и А.Н. Фрумкина показано, что, если поверхность частицы достаточно гидрофобна, то водная прослойка, достигшая минимальной толщины, при которой она становится термодинамически неустойчивой, разрывается мгновенно, скачкообразно. Этот момент и соответствует акту прилипания частиц к пузырьку, т.е. образованию краевого угла смачивания (образованию трехфазного периметра смачивания). Причем на участке прилипания частицы к пузырьку в пределах площади прилипания остается тонкая пленка воды, являющаяся новой двухмерной фазой, принципиально отличной по своим свойствам от объемной жидкости. Толщина водной прослойки в этом случае равна 400 Å. Если же поверхность частиц будет достаточно гидрофильной, то водная прослойка между частицей и пузырьком будет толстой, она останется термодинамически устойчивой, краевой угол будет небольшим и прилипания не произойдет - пузырек оттолкнется от частицы. Для осуществления флотации частиц, прилипших к пузырьку, последний должен поднять их на поверхность пульпы. Пузырек при всплывании испытывает воздействие различных механических сил (столкновение с другими частицами, пузырьками, струями суспензии, а также с движущимися частями машин и др. механизмов), которые могут оторвать частицы от пузырька. Чтобы частица не оторвалась, должны быть силы, способные удержать частицу на поверхности пузырька. Прочность прилипания частицы к пузырьку зависит от площади прилипания, радиуса пузырька и величины краевого угла смачивания, а также от массы частицы в воде. Чем больше масса частицы в воде, тем меньше должна быть смачиваемость материала, а следовательно, тем больше должен быть краевой угол смачивания, необходимый для прилипания частицы к пузырьку. Учитывая динамические силы, действующие на частицы при их движении в суспензии, и центробежные силы инерции, развиваемые в момент огибания частицей пузырька, можно рассчитать, что сила отрыва частицы увеличивается в среднем в 4 ÷ 5 раз по сравнению с силой тяжести частицы, а краевой угол возрастает при этом в 1,2 ÷ 3 раза. Работами В.И. Классена установлено, что образование начальной площади прилипания на поверхности частиц материала облегчается, когда мельчайшие пузырьки воздуха (микропузырьки) образуются непосредственно на поверхности материала. Затем крупный пузырек сливается (коалесцирует) с этими мелкими пузырьками и использует имеющуюся под ним площадь прилипания. Предполагается, что образование на поверхности гидрофобных частиц микропузырьков воздуха способствует удалению гидратной пленки с поверхности материалов. Прилипание частиц к пузырьку должно рассматриваться не в равновесных, а в кинетических условиях, и с этой точки зрения важна не только прочность, но и скорость прилипания. Исследованиями М.А. Эйгелеса показано, что при минерализации пузырька продолжительность прилипания частиц к пузырьку находится в пределах 0,0001 ÷ 0,015 с. Процесс флотации в целом оценивают скоростью флотации. Эта величина измеряется в минутах и характеризуется продолжительностью процесса для достижения определенного извлечения флотируемого материала при заданном качестве смеси. Для определения скорости флотации в настоящее время предложено большое количество формул. Наиболее простой из них является определение средней скорости флотации ср по уравнению где - извлечение в концентрат, %, за время t, мин. Однако по этому уравнению нельзя определить скорость флотации в определенный промежуток времени. Скорость флотации в данный момент времени равна производной d/dt и определяется константой скорости, численно равной тангенсу угла наклона кривой зависимости извлечения от времени. Для определения скорости флотации К.Ф. Белоглазовым предложено уравнение где k - константа скорости флотации. Это уравнение справедливо при флотации узких классов крупности материала из суспензии при постоянной концентрации флотируемого реагента. В более общем виде это уравнение имеет вид где k и n - параметры, зависящие от свойств флотируемого материала и условий флотации. Е 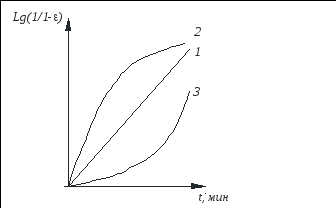 Рис. 8.Кривые скорости флотации Рис. 8.Кривые скорости флотациисли на основании результатов флотационных опытов построить кривую изменения скорости флотации в координатах |
