3 ПЗ. Флюоресцентная и фосфоресцентная спектроскопия. Фотометрические методы анализа
 Скачать 0.83 Mb. Скачать 0.83 Mb.
|
|
Флюоресцентная и фосфоресцентная спектроскопия. Фотометрические методы анализа. 1. Теоретические основы молекулярной люминесценции. Виды переходов. Люминесценцией называют свечение вещества, возникающее при переходе молекул из возбужденного состояния в основное. Люминесценция — довольно распространенное явление. Перевод молекул в возбужденное состояние может осуществляться различными путями, как и расходование приобретенной при этом молекулами энергии. Если возбуждение происходит за счет поглощения электромагнитного излучения в оптической области, то испускание излучения называют фотолюминесценцией. Хемилюминесценция представляет собой испускание света в результате протекания определенных химических реакций (например, окисление эфирных растворов n-бромфенилбромида магния вызывает зеленовато-голубое свечение). К числу разновидностей люминесценции, которые наблюдаются в природе, относится молния (пример электролюминесценции). Некоторые виды бактерий, ракообразных, рыб, грибов, медуз, моллюсков, губок, червей обладают способностью светиться (известный пример — светляки). Такое явление называется биолюминесценцией. Оно обусловлено реакцией кислорода с веществом, находящимся в организме, которое называют люциферином. Эта реакция катализируется ферментом люциферазой. Теоретические основы люминесценции При нормальных условиях в отсутствие возбуждения молекулы находятся в основном синглетном (S0) состоянии (рис. 1). На схеме изображен также ряд других энергетических уровней молекул: синглетные возбужденные состояния — S1, S2 и т. д., для каждого синглетного состояния существует соответствующее триплетное состояние (T1, T2 и т. д.) Каждый из этих электронных энергетических уровней имеет ряд подуровней, которые отвечают квантовым колебательным энергетическим состояниям. Сплошными вертикальными линиями показаны поглощение или испускание излучения; пунктирными — безылучательные переходы. Энергия, поглощенная молекулой, вызывает переход на один из более высоких уровней (этот процесс обозначен на схеме цифрой 1). Если переход заканчивается на каком-либо колебательном подуровне возбужденного уровня S1, то молекула очень быстро переходит на уровень S1, при этом энергия выделяется в виде тепла (этот процесс обозначен цифрой 2 — безызлучательный переход). 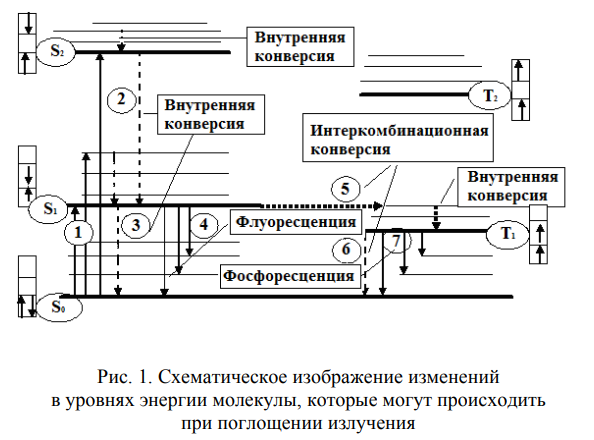 Рассмотрим различия между возбужденным синглетным и соответствующим триплетным состояниями. Возбужденный электрон синглетного состояния имеет спин, антипараллельный электрону, с которым он был спарен. В триплетном состоянии два внешних электрона имеют один и тот же спин, т. е. они не могут подойти близко друг к другу без нарушения принципа Паули. Принцип Паули: на каждом заполненном электрическом уровне могут находиться только два электрона, имеющие противоположные собственные магнитные моменты (спины). Поскольку в этом случае электроны удалены друг от друга, происходит уменьшение электронного взаимодействия, поэтому триплетное состояние всегда обладает более низкой энергией, чем соответствующее синглетное состояние. Около каждого уровня в клетках (соответствующих разным орбиталям) показано направление возбужденного электрона по отношению к спину оставшегося электрона. Если молекуле сообщить энергию (квант света), то произойдет переход одного электрона с заполненного уровня (S0) на один из незаполненных уровней. Молекула при этом оказывается в электронно-возбужденном состоянии. При переходах между синглетными уровнями (S1, S2 и т. д.) спин электрона не изменяется. Молекула в возбужденном состоянии S1 может с определенной вероятностью реализовать следующие пути превращения поглощенной энергии: а) передача энергии возбуждения другой молекуле (колебательная релаксация); б) превращение в тепло (безызлучательный переход — процесс 3): S1 S0; в) фотохимическая реакция: S1 продукт; г) испускание ее в виде излучения (на схеме — процесс 4): S1 S0 + hvфл. Излучение, испускаемое при переходе между состояниями, имеющую одинаковую мультиплетность, называется флуоресценцией; д) переход молекулы с S1 на один из колебательных подуровней (близкий по энергии) триплетного возбужденного состояния (T1) c обращением спина электрона: S1T1 (безызлучательный переход — процесс 5). Переходы с изменением мультиплетности запрещены, это значит, что процесс возможен с малой вероятностью. Процессы безызлучательного перехода происходят очень быстро (со временем порядка 10-3 –10-12 с). К этим быстрым процессам относятся: а) внутренняя конверсия; б) интеркомбинационная конверсия. Внутренней конверсией называется безызлучательный переход энергии из возбужденных состоянияний без изменения мультиплетности. Это означает, что в какое бы возбужденное состояние ни попала молекула (например S2), она очень быстро переходит в первое синглетное состояние (S)1. Внутренняя конверсия может происходить и между возбужденными триплетными состояниями (Т2 T1). Интеркомбинационной конверсией называются безызлучательные переходы между состояниями различной мультиплетности (например, S1 T1). На схеме процесс обозначен цифрой 5. Рассмотрим молекулу, находящуюся в возбужденном триплетном состоянии T1. Существует несколько путей растраты энергии из данного состояния молекулы: а) безызлучательный переход в S0 с обращением спина электрона (интеркомбинационная конверсия): T1 S0 (процесс обозначен цифрой 6); б) фотохимическая реакция; в) передача энергии возбуждения другой молекуле; г) испускание кванта фосфоресценции (процесс 7): T1 S0 + hvфосф. Излучение, испускаемое при переходе между состояниями с различной мультиплетностью, называется фосфоресценцией. Время жизни флуоресценции органических молекул составляет 10–9 –10–8 с, а время жизни фосфоресценции — от 10–3 с до нескольких секунд, потому что переходы между состояниями с различной мультиплетностью очень мало вероятны. Обсудим более подробно происхождение спектров флуоресценции и фосфоресценции. Рассмотрим зависимость потенциальной энергии (Е) двухатомной молекулы (для простоты) от межатомного расстояния (r). На рис. 2 изображены кривые потенциальной энергии и колебательные подуровни основного (S0) и первого (S1) синглетного состояния двухатомной молекулы. Минимумы кривых потенциальных энергий в основном и возбужденном состоянии сдвинуты, поскольку орбиталь, заполняемая электронами в возбужденном состоянии, занимает большую область пространства, чем в основном состоянии, и положение равновесия в возбужденном состоянии соответствует большему межъядерному расстоянию. 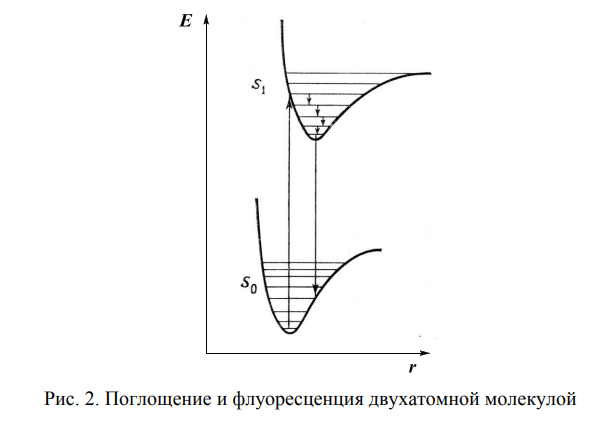 Принцип Франка — Кондона: наиболее вероятным будет такой электронный переход, при котором не произойдет изменений ни в межъядерном расстоянии, ни в импульсе (принцип вертикальности перехода изображается вертикальной линией). Из сопоставления длин стрелок на рис. 2 ясно, что фотоны испускаемого излучения обычно обладают меньшей энергией и, следовательно, большей длиной волны, чем фотоны возбуждающего излучения. Если в соответствии с принципом Франка — Кондона представить состояния двухатомной молекулы, способной переходить в триплет, в виде потенциальных кривых, то кривые (S1) и (T1) должны пересекаться в некоторой точке М (рис. 3). 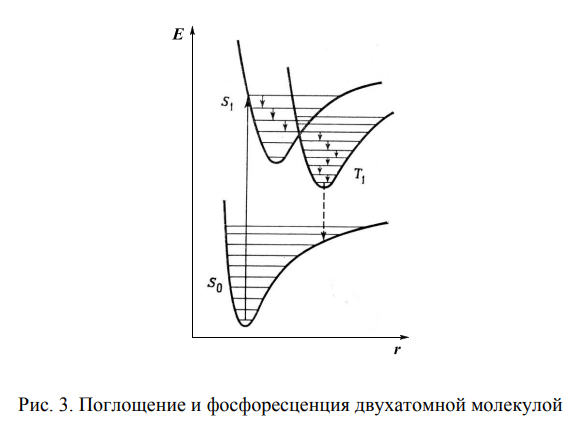 При поглощении света молекула переходит из основного состояния (S0) в первое электронно-возбужденное состояние (S1). Молекула быстро теряет избыток колебательной энергии. В точке пересечения (S1) положения и импульсы ядер для возбужденного синглетного уровня и первого триплетного уровня (T1) оказываются одинаковыми. Это означает, что молекула может перейти на соответствующий подуровень триплетного состояния. При этих условиях вероятность того, что такой переход произойдет, велика, несмотря на правило отбора, согласно которому переходы между состояниями с различной мультиплетностью запрещены. Далее потеря колебательной энергии в состоянии Т1 продолжается благодаря внутренней конверсии. 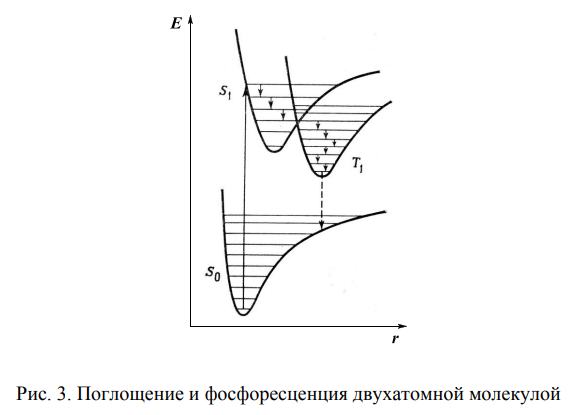 Поскольку состояние Т1 обладает более низкой энергией, чем состояние S1, спектр фосфоресценции наблюдается при больших длинах волн, чем спектр флуоресценции. Таким образом, одним из способов отдачи энергии при переходе из возбужденного состояния в основное является испускание кванта света люминесценции. Чаще всего таким фотоэлектроном сложных органических молекул является -электрон, участвующий в образовании делокализованных двойных сопряженных связей молекулы. Сами переходы с поглощением и испусканием света в системе -электронов представляют переходы типа -* и *- между основным и возбужденным синглетным состоянием. Параметры люминесценции и основные законы люминесценции Главными параметрами люминесценции (флуоресценции) являются: спектр люминесценции, квантовый выход, время жизни молекулы в возбужденном состоянии, спектр возбуждения. Рассмотрим эти параметры. Спектр флуоресценции — зависимость излучения от длины волны. Квантовый выход () — это отношение количества квантов, испускаемых с уровня S1, к количеству поглощенных квантов: = nфл / nпогл (1.1) Если бы все переходы вниз сопровождались излучением, то квантовый выход =1. Но за счет потерь рекомбинации (процессов, конкурирующих с флуоресценцией: тепловые потери и т. д.), он меньше единицы. Определить квантовый выход можно по методу Паркера — Рисса. В одинаковых условиях снимается спектр неизвестного вещества и эталона с известным квантовым выходом (0): = 0SD0 / DS0, (1.2) где D0, D — оптические плотности эталона и исследуемого вещества; S0, S — площади под кривыми флуоресценции, соответственно. В качестве эталона используют флуоресцин в растворе NaCl (0.1 М). Время жизни молекулы в возбужденном состоянии () определяется суммарной вероятностью его дезактивации: =1/ (kфл + kвн.к + kин.к), (1.3) где kфл — константа скорости флуоресценции; kвн.к — константа скорости внутренней конверсии; kин.к — константа скорости интеркомбинационной конверсиии. Спектром возбуждения флуоресценции называется зависимость интенсивности флуоресценции от длины волны возбуждающего света: Iфл / I0 = f (в), (1.4) где Iфл — интенсивность флуоресценции; I0 —интенсивность падающего (возбуждающего) света; в — длина волны возбуждающего света. Измерение спектров возбуждения флуоресценции имеет важное значение для решения целого ряда задач. Так, спектр возбуждения дает возможность установить спектр поглощения компонента, который флуоресцирует в исследуемой спектральной области, что позволяет идентифицировать этот компонент. Сравнительное изучение спектров возбуждения и флуоресценции позволяет обнаружить миграцию энергии возбуждения между различными компонентами в сложных системах. Так, если в двухкомпонентных системах флуоресцирует только один компонент, а в спектре возбуждения этой флуоресценции зарегистрированы полосы, соответствующие поглощению обоих компонентов, это означает, что в данной системе происходит миграция энергии с одного компонента на другой. Явление флуоресценции описывается рядом законов. Закон Вавилона: так как испускание флуоресценции происходит всегда с нижнего возбужденного энергетического уровня (S1), то квантовый выход не зависит от длины волны возбуждающего света. Правило Каша: так как испускание флуоресценции происходит всегда с нижнего возбужденного энергетического уровня (S1), то форма спектра флуоресценции не зависит от длины волны возбуждающего света. Закон Стокса: спектр флуоресценции будет расположен в более длинноволновой области, чем самый длинноволновый максимум в спектре поглощения. Спектр флуоресценции сдвинут в длинноволновую сторону по сравнению с полосами поглощения, т. к. энергия поглощенного кванта частично растрачивается на тепловые колебания. Это приводит к тому, что энергия флуоресценции меньше, чем энергия поглощения кванта света. 2. Количественный анализ. Фотометрия Фотометрический метод анализа основан на избирательном поглощении электромагнитных излучений различных участков спектра однородной системы. Каждая однородная система обладает способностью избирательно поглощать излучения определенных длин волн, причем количество поглощенной энергии пропорционально концентрации поглощающего вещества в растворе. Поэтому фотометрический анализ при условии использования монохроматических излучений называют методом адсорбционной спектрофотометрии. Степень монохроматичности потока излучения определяется интервалом длин волн, который выделяется данным монохроматором (светофильтром, призмой или дифракционной решеткой) из сплошного потока электромагнитного излучения. В зависимости от используемой аппаратуры в фотометрическом анализе различают фотоколориметрические и спектрофотометрические методы анализа. Фотоколориметрические методы, в которых измеряется светопоглощение окрашенных растворов, используют сравнительно несложную аппаратуру и при этом обеспечивают достаточную точность измерений (d = ±1-2 отн.%) и широко применяются в концентрационном анализе (определение концентрации растворов). В большинстве фотоколориметров монохроматизация осуществляется с помощью светофильтров. В спектрофотометрических методах применяют более сложные приборы - спектрофотометры, позволяющие проводить анализ как окрашенных, так и бесцветных соединений по избирательному поглощению монохроматического света в видимой (лямбда = 400 - 700 нм), ультрафиолетовой (лямбда = 200 - 400 нм) или ближней инфракрасной (лямбда = 700 - 1500 нм) областях спектра. Ввиду того, что спектр поглощения каждого поглощающего вещества имеет вполне определенную форму, спектрофотометр может быть применен как для количественного, так и качественного анализа химических соединений. Законы поглощения света. Термины и обозначения Интенсивность монохроматического светового потока, прошедшего через слой окрашенного раствора, уменьшается по сравнению с первоначальной величиной в зависимости от концентрации окрашенного вещества и толщины слоя раствора. Эти условия выражаются уравнением объединенного закона Бугера-Ламберта-Бера: 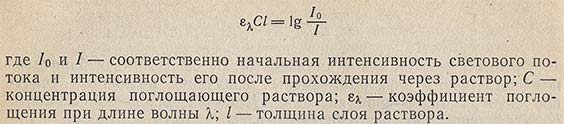 Если концентрация раствора выражена в молях на литр, а толщина поглощающего слоя - в сантиметрах, то постоянную E с лямбдой называют молярным коэффициентом поглощения (экстинкции). Он зависит от длины волны падающего света, природы растворенного вещества и температуры раствора. Молярный коэффициент поглощения отражает индивидуальные свойства окрашенных соединений и является их важной характеристикой. Для разных веществ молярный коэффициент поглощения имеет различное значение. Величину lg(I0/I) называют оптической плотностью поглощающего вещества и обозначают буквой D. Оптическая плотность может иметь любые положительные значения, однако современные приборы позволяют определять оптическую плотность, не превышающую 2-3. Отношение I/I0 = T характеризует пропускание или прозрачность раствора. Величина пропускания Т может изменяться от 0 до 1 или от 0 до 100%. Величину пропускания Т, отнесенную к толщине поглощающего слоя l = 1 см, называют коэффициентом пропускания. Оптическая плотность и пропускание связаны между собой соотношением D = 2 - lg Т (если Т выражено в процентах). При соблюдении основного закона светопоглощения оптическая плотность раствора прямо пропорциональна молярному коэффициенту поглощения, концентрации поглощающего вещества и толщине слоя раствора: При графическом изображении зависимости оптической плотности от концентрации (при постоянной толщине слоя l) получается прямая линия, которая проходит через начало координат при отсутствии поглощения света растворителем. Методы измерения поглощения света Найти абсолютные значения интенсивности светового потока до (I0) и после (I) прохождения его через раствор практически очень затруднительно. Поэтому при измерении поглощения излучений обычно сравнивают два световых потока: один проходит через испытуемый раствор, а другой через определенный стандартный раствор или через растворитель (нулевой раствор, поглощение которого условно принимается равным нулю). Сравнение можно проводить визуально или посредством фотоэлектрических приборов, в которых приемником излучений служат фотоэлементы. Визуально можно лишь констатировать наличие сходства или различия в окраске, но оценить количественно степень различия ее невозможно. Интенсивность окраски двух сравниваемых растворов выравнивают, изменяя концентрацию (метод разбавления, метод стандартных серий и метод колориметрического титрования), или толщину поглощающего слоя, или интенсивность светового потока (Последнее возможно в том случае, если более интенсивный поток ослабить при помощи измерительной диафрагмы.) Изменение ширины щели диафрагмы, находящейся на пути одного из двух сравниваемых световых потоков, может быть скоррелировано поворотом отсчетного барабана, отградуированного в величинах оптической плотности D или пропускания Т. Расчет концентрации светопоглощающих растворов При работе с приборами, позволяющими непосредственно измерять оптическую плотность D, для расчета концентрации испытуемых растворов можно применять следующие методы. 1. Графический метод, основанный на построении калибровочного графика в координатах оптическая плотность - концентрация. Для построения калибровочного графика измеряют поглощение серии окрашенных растворов известной, но различной концентрации, оптические плотности которых охватывают требуемый интервал. С этой целью применяют стандартный раствор определяемого вещества. Тщательно отмеряют пипеткой определенные части этого раствора, добавляют к ним соответствующий реагент и соблюдают условия максимального развития окраски (время выдержки, температура). После этого каждый раствор разбавляют в мерной колбе до определенного объема и измеряют поглощение при выбранной длине волны. График зависимости поглощения света от концентрации поглощающего вещества обычно представляет собой прямую линию, тангенс угла наклона которой равен коэффициенту пропускания Т или молярному коэффициенту поглощения E с лямбдой. При построении калибровочного графика результаты измерений вначале наносят в виде 5-8 точек, различающихся по концентрации не менее чем на 30%, а затем проводят прямую линию либо через эти точки, либо как можно ближе к ним. Это ведет к усреднению и уменьшению ошибок, вызванных неточностями приготовления и измерения поглощения стандартных растворов. Фотометрическую реакцию анализируемого образца проводят в тех же условиях, что и для стандартных растворов. Измерив поглощение раствора образца, можно по калибровочному графику определить его концентрацию. 2. Если заранее известно, что испытуемые растворы подчиняются законам поглощения излучений, то приготовляют два раствора - эталонный, концентрация которого Сэ известна, и испытуемый (его концентрация Сх) и определяют их оптические плотности Dэ и Dx. Концентрацию испытуемого раствора вычисляют по формуле: 3. Если заранее известно значение молярного коэффициента поглощения при данной длине волны монохроматического света E с лямбдой, то, зная толщину поглощающего слоя (толщину слоя кюветы), концентрацию испытуемого раствора вычисляют по формуле: Фотоколориметрические методы анализа Фотоколориметрические методы определения концентрации вещества основаны на сравнении поглощения или пропускания света стандартным и исследуемым окрашенными растворами. Под колориметрией имеют в виду методы определения концентрации окрашенных веществ в растворе по поглощению света. Если определяемый компонент бесцветен, то при помощи химической реакции переводят его в окрашенное соединение, после чего инструментальным или визуальным способом измеряют интенсивность окраски. В визуальных методах используют несложные приборы непосредственного сравнения интенсивности окрасок испытуемого раствора с серией стандартных растворов, полученных путем последовательного разбавления раствора известной концентрации, содержащего одно и то же окрашенное вещество. Визуально сравниваемые растворы должны быть налиты в пробирки или цилиндры одинакового размера и освещены от источника с рассеянным светом. В другом варианте визуального метода изменяют толщину слоя жидкости, через который проходит свет, и этим добиваются одинаковой интенсивности окраски испытуемого и стандартного растворов. Для этого используют цилиндры Генера - стеклянные градуированные цилиндры одинакового диаметра, снабженные у основания кранами для сливания жидкости. Важнейшие детали фотоколориметров Фотоэлементы. В отличие от визуальных методов колориметрирования в фотоколориметрии степень поглощения света определяется не глазом, а при помощи колориметров с фотоэлементами (ФЭК). Фотоэлемент преобразует световую энергию, проходящую через исследуемый окрашенный раствор, в электрическую. Сила возникающего фототока (общая чувствительность фотоэлемента) зависит от длины волны падающего на фотоэлемент света и от температуры. В приборах для фотометрического анализа в основном нашли применение селеновые, сурьмяно-цезиевые и кислородно-цезиевые фотоэлементы. Селеновые фотоэлементы пригодны для измерений только в видимой части спектра. Они обладают высокой чувствительностью, и при их применении не требуется усиливать возникающий фототок, измерение которого возможно обычным стрелочным гальванометром. Селеновые фотоэлементы нельзя применять для измерения в узких участках спектра, так как используемые в этих случаях узкополосные светофильтры значительно ослабляют световые потоки. Сурьмяно-цезиевые и кислородно-цезиевые фотоэлементы обладают небольшой чувствительностью, поэтому возникающие фототоки необходимо усиливать. Сурьмяно-цезиевые фотоэлементы применимы в ультрафиолетовой и видимой областях спектра, а кислородно-цезиевые - в видимой и ближней инфракрасной областях. Измерять оптическую плотность раствора следует при длине волны, при которой наблюдается максимальное поглощение света. Светофильтры. Область максимального поглощения света при фотометрическом анализе выделяют при помощи светофильтров, устанавливаемых на пути световых потоков перед поглощающими растворами. Светофильтры - жидкие или твердые среды, обладающие избирательным пропусканием излучения в достаточно узком интервале длин волн. В качестве светофильтров используют окрашенные растворы некоторых веществ, окрашенные оптические стекла, интерференционные светофильтры и диспергирующие призмы; последние характеризуются более высокой степенью монохроматизации, чем светофильтры. Ширина пропускания определенного спектрального участка (линейная дисперсия) для светофильтров колеблется от 100 до 20-40 нм; в призменных и дифракционных приборах линейная дисперсия колеблется от 0,5 до 2 нм. Кюветы. Они представляют собой прямоугольные или цилиндрические сосуды из стекла или кварца с определенным расстоянием между стенками (у прямоугольных кювет) - или между крышками - у цилиндрических. Стеклянные кюветы пропускают все лучи видимого света; кварцевые - не только видимые, но и ультрафиолетовые и частично инфракрасные лучи. Поверхность кюветы, на которую падает световой поток, и поверхность, через которую выходит непоглощенная часть светового потока, должны быть строго параллельны. В зависимости от интенсивности окраски раствора для измерения выбирают кювету с большей или меньшей толщиной слоя. Следует иметь в виду, что наименьшая ошибка измерения получается при D = 0,3-0,5. Поэтому нужно так подобрать кюветы, чтобы вести измерения в этом интервале оптической плотности. В наборах кювет для фотометрирования имеется, как правило, по две пары кювет с одинаковой толщиной слоя жидкости. Рабочие поверхности кювет должны быть чистыми. Перед заполнением кювет их следует тщательно промыть дистиллированной водой, затем ополоснуть исследуемой жидкостью и только после этого, непосредственно перед измерением, заполнить светопоглощающим раствором. Лабораторные фотоколориметры Фотоэлектрические лабораторные колориметры предназначаются для определения светопропускания или оптической плотности жидких окрашенных растворов и твердых тел, а также светопропускания взвесей, эмульсий и коллоидных растворов. С помощью современных фотоколориметров можно измерять коэффициенты пропускания или оптическую плотность в спектральной области 300-1000 нм. Все фотоколориметры имеют обязательно следующие элементы схемы: осветитель, светофильтры, кюветы, фотоэлементы, регулируемые сопротивления и гальванометры. Различают два основных метода измерения тока фотоэлемента: прямое измерение и нулевой метод. В последнем случае ток фотоэлемента, на который падает поток света, прошедший через кювету с исследуемым раствором, компенсируется при помощи щелевой диафрагмы или иным способом. Гальванометр при этом используется не для измерения тока, а только как нуль-прибор. Фотоэлектрический колориметр ФЭК-М. Колориметр имеет стеклянную оптику, прозрачную только для лучей видимого участка спектра. Источником излучения служит лампа накаливания (вольфрамовая лампа), дающая излучение в видимой части спектра. Прибор снабжен четырьмя светофильтрами с полушириной пропускания 80-100 нм и поэтому пригоден только для концентрационного анализа. В основу конструкции прибора (рис. 184) положен принцип уравнивания интенсивности двух световых потоков с помощью щелевой диафрагмы. 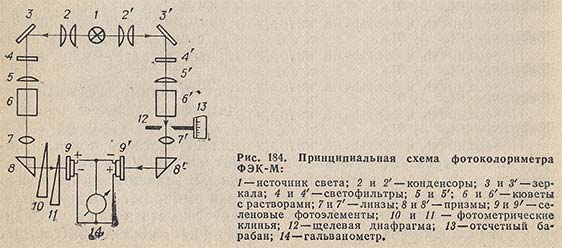 Измерение интенсивности световых потоков проводится с помощью двух селеновых фотоэлементов 9 и 9', соединенных между собой и со стрелочным гальванометром 14 по дифференциальной схеме таким образом, что при равенстве потока лучей стрелка гальванометра стоит на нуле. Световые потоки от источника излучения 1 направляются на зеркала 3 и 3', затем проходят через светофильтры 4 и 4' в кюветы с растворами 6 и 6' и попадают на селеновые фотоэлементы 9 и 9'. Перед фотоэлементами на пути левого светового потока помещены круговые фотометрические клинья 10 и 11 для ослабления светового потока, падающего на фотоэлемент, а на пути правого потока - щелевая диафрагма 12, связанная с отсчетным барабаном 13. На отсчетных барабанах имеется две шкалы: оптических плотностей D и коэффициентов светопропускания Т. Измерения оптической плотности растворов производят при помощи правого и левого барабанов. Шкала оптической плотности левого барабана проградуирована от 0 до 2 (Т = 100 4-0%). Шкала оптической плотности правого барабана имеет пределы измерений 0,00-0,52; точность измерений наибольшая на участке 0,15-0,52 (по шкале светопропускания 70-30%). Работа с правым барабаном имеет ряд преимуществ. Измерение проводят 3-5 раз и находят среднее значение оптической плотности. Для нахождения концентрации анализируемого раствора пользуются калибровочной (градуировочной) кривой. Определив значение оптической плотности анализируемого раствора, находят на оси ординат точку, соответствующую данному значению D, из которой проводят линию, параллельную оси абсцисс до пересечения ее с калибровочной кривой, а из точки пересечения опускают перпендикуляр на ось абсцисс и по точке пересечения с ней находят процентное содержание определенного вещества. Фотоколориметр-нефелометр ФЭК-60. Прибор предназначен для измерения концентрации жидких сред (прозрачных окрашенных растворов, взвесей, эмульсий, коллоидных растворов). Концентрация веществ определяется по ослаблению проходящего через слой жидкости пучка излучения, которое может быть вызвано поглощением в растворе или рассеянием во взвеси (эмульсии). Прибор может служить как колориметром (концентрационный), так и нефелометром. Прибор укомплектован сменными фотоэлементами: сурьмяно-цезиевым и кислородно-цезиевым. Спектральная область работы прибора - видимая и ближняя инфракрасная часть спектра (360-1000 нм). Из девяти пар светофильтров одна предназначена для измерений в ближней ультрафиолетовой, пять - в видимой и три - в ближней инфракрасной области. Колориметр-нефелометр ФЭК-60 является однофотоэлементным прибором, в основу которого положен принцип уравнивания интенсивности двух световых модулированных потоков при помощи переменной щелевой диафрагмы. Принципиальная оптическая схема колориметра-нефелометра ФЭК-60 представлена на рис. 185. 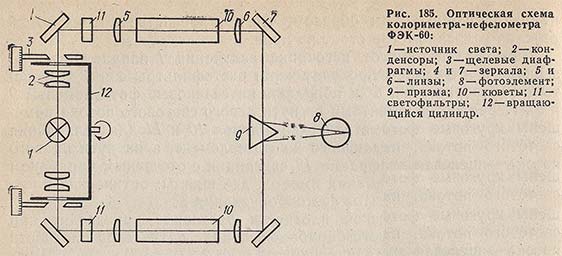 Два пучка лучей от источника света 1 проходят через две симметричные оптические системы, каждая из которых состоит из конденсора 2, щелевой диафрагмы 3, зеркал 4 я 7 и линз 5 и 6. Световые потоки, правый и левый, модулируются в противофазе с частотой 350 Гц посредством вращающегося цилиндра 12. Модулированные световые потоки, пройдя через светофильтры 11 и кюветы 10, направляются призмой 9 на общий приемник излучения - фотоэлемент 8 и возбуждают переменный электрический ток, пропорциональный разности интенсивности правого и левого световых потоков. Фототок усиливается четырехкаскадным усилителем. Выходной сигнал переменного тока выпрямляется фазовым детектором, к которому непосредственно подключен измерительный прибор - микроамперметр. Интенсивности модулированных потоков излучений - относительного (нулевого) и измеряемого - регулируют с помощью щелевых диафрагм 3. Одна из них, расположенная на пути правого светового потока, является измерительной. Она связана с отсчетным барабаном, проградуированным в значениях оптической плотности D и пропускания Т. Максимальное раскрытие щелевой диафрагмы соответствует 100% пропускания, а полное закрытие - нулю. Щелевая диафрагма, расположенная на пути левого светового потока, является компенсационной и шкалы не имеет. Измерения проводятся со сменными парными светофильтрами 11, выделяющими узкие спектральные участки в видимой или ближней инфракрасной области спектра. Для измерений в видимой области спектра используют сурьмяно-цезиевый фотоэлемент, а в инфракрасной - кислородно-цезиевый. Питание источника света, фотоэлементов и усилителя производится от сети переменного тока через питающее устройство, обеспечивающее стабилизацию напряжения с точностью ±0,5%. Первоначальная установка фотоколориметра, его включение в сеть при помощи тумблера на панели стабилизатора, проверка правильности установки осветителя и смена фотоэлементов производятся согласно инструкции, прилагаемой к прибору. Измерения можно начинать только спустя 15-20 мин после включения прибора; за это время прогреется электросхема и установится стабильный режим ее работы. Если в процессе работы заменяют светофильтр, то до измерения нужно выждать 1-2 мин. Следует иметь в виду, что вначале целесообразно уравнивать световые потоки при малой чувствительности прибора, что достигается включением в оба плеча нейтральных светофильтров из прилагаемого комплекта. Затем устанавливают «электрический нуль» прибора. Для этого закрывают измерительную и компенсационную диафрагмы и добиваются нулевого положения микроамперметра. Правый барабан устанавливают на Т = 100% (или D = 0), включают светофильтр на пути излучения, после чего на пути правого светового потока помещают кювету с испытуемым раствором; левый поток остается свободным. Вращением левого барабана устанавливают стрелку микроамперметра на нуль. После этого поворотом рукоятки вводят в правый поток кювету с нулевым раствором и вращением правого барабана восстанавливают нарушенное равновесие и приводят стрелку микроамперметра к нулю. Отсчет величины D производят по шкале диафрагмы. Спектрофотометрические методы анализа Спектрофотометрия широко применяется для установления связи между спектрами поглощения различных веществ и их химическим строением и составом, а также для количественного определения веществ. Абсорбционная спектрометрия основана на тех же законах светопоглощения, что и фотоколориметрические методы, однако, в отличие от последних, в ней используется поглощение монохроматического света с очень узким интервалом длин волн (1-2 нм). Это значительно увеличивает чувствительность и точность количественного анализа окрашенных растворов, поглощающих свет в видимой области спектра, а также «бесцветных» для глаза растворов, которые поглощают излучение в ультрафиолетовой (200-400 нм) или ближней инфракрасной области спектра. Спектрофотометры подразделяются на регистрирующие и нерегистрирующие. В регистрирующих приборах результаты всех измерений автоматически записываются на специальном бланке, имеющем вид сетки. Нерегистрирующие спектрофотометры обычно включают источник излучения, монохроматор, приемник излучения и отсчетное устройство. Количественные измерения пропускания производятся сравнением сигналов приемника при попеременной установке в световой пучок образца и эталона. При измерениях поглощения светового потока жидкостями обычно пользуются двумя идентичными кюветами, одна из которых заполняется исследуемым раствором, а другая (пустая или наполненная растворителем) играет роль эталона, пропускание которого принимают за 100%, а оптическую плотность считают равной нулю. К нерегистрирующим спектрофотометрам с кварцевой оптикой относятся модели СФ-4, СФ-4А, СФ-16, обеспечивающие возможность производить измерения, помимо видимой и ближней инфракрасной, также в ультрафиолетовой области спектра. К нерегистрирующим спектрографам со стеклянной оптикой относится модель СФ-5, используемая для измерений только в видимой и ближней инфракрасной области спектра. Нерегистрирующие спектрофотометры имеют одинаковую оптическую схему, но несколько различаются электрическими схемами и методикой измерений.  Принципиальная оптическая схема спектрофотометра СФ-16, с пределами измерения оптических плотностей 0-2 и пропускания 100-0, 10-0, 100-90% представлена на рис. 186. Свет от источника 1 попадает на зеркало-конденсор 2, которое направляет пучок лучей на плоское зеркало 3, поворачивающее лучи на 90° и направляющее их на входную щель монохроматора 4. Зеркальный объектив 6 направляет параллельный пучок лучей на призму 5, которая разлагает его в спектр и возвращает его обратно на объектив 6. Луч, прошедший призму под углом близким к углу наименьшего отклонения, попадает на выходную щель 7, расположенную под входной. Поворачивая призму вокруг оси, можно получить на выходе монохроматора лучи различных длин волн. Выходящий из монохроматора пучок света проходит фильтр 8, кювету с исследуемым раствором 9 и попадает на фотоэлемент 10. Фототок, возникающий в фотоэлементе, передается на усилитель постоянного тока. Усиленный ток попадает на милливольтметр. Спектрофотометр СФ-16 относится к однолучевым приборам, поэтому в процессе измерений на пути потока излучения устанавливаются поочередно «нулевой» и испытуемый образцы. Происходящие при этом изменения интенсивности излучения, падающего на фотоэлемент, вызывают изменение напряжения в системе усилителя, которое компенсируется путем изменения напряжения на потенциометре, связанном с отсчетным устройством. Включение прибора в сеть производится согласно прилагаемой к нему инструкции, в которой также даются указания относительно техники работы с ним.  3. Аппаратура люминесцентного анализа. При проведении люминесцентного анализа необходимо измерять всевозможные спектрально-люминесцентные характеристики люминофора: интенсивность люминесценции, спектр возбуждения, спектры люминесценции и др. С этой целью используют различные люминесцентные приборы. Каждый такой прибор включает в себя шесть основных узлов: – источник возбуждающего света; – селектор частоты возбуждающего света и частоты люминесценции; – кюветное отделение, предназначенное для размещения кюветы с измеряемым образцом (стандартным образцом или пробой); – фотоприемник люминесценции (фотоэлемент, фотоумножитель, фотодиод); – усилитель сигнала; – миллиамперметр. Приборы, предназначенные для измерения флуоресценции, можно разделить на три категории – флуориметры, флуоресцентные приставки к спектрофотометрам и спектрофлуориметры. Схема простейшего флуориметра приведена на рисунке 2. Во флуориметрах селекция частот возбуждающего света и света флуоресценции осуществляется с помощью светофильтров. Флуориметры применяют для проведения серийных анализов, где снижение селективности не является большим недостатком, а высокая чувствительность, напротив, представляет собой важное достоинство. При измерении флуоресценции с помощью флуориметров существенное значение имеет правильный выбор светофильтров, необходимых для разделения света, возбуждающего флуоресценцию (первичный светофильтр), и света флуоресценции (вторичный светофильтр). Первичный светофильтр должен пропускать свет в области поглощения определяемого вещества и не должен пропускать свет в области, отвечающей флуоресценции вещества. Вторичный светофильтр должен пропускать флуоресценцию, но возбуждающий свет должен им полностью поглощаться. Источниками возбуждающего света во флуориметрах обычно служат ртутные лампы низкого давления. С целью получения практически сплошного спектра излучения внутренние стенки этих ламп часто покрывают люминофором.  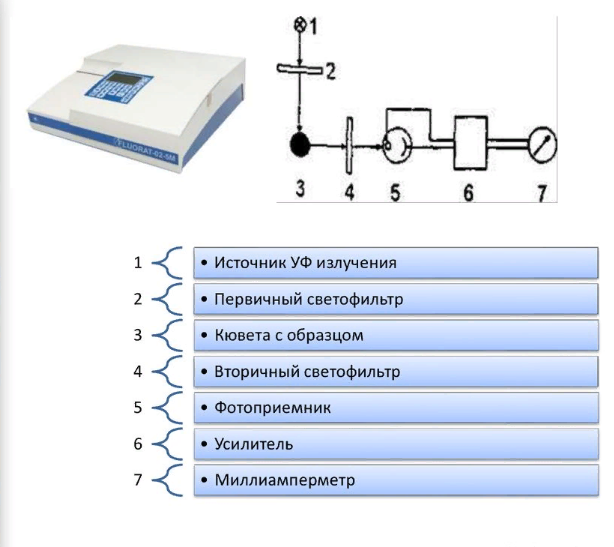 4. Практическое применение люминесцентного анализа. Спектры люминесценции, как и абсорбционные электронные спектры, применяются для качественного и количественного анализа, в структурных исследованиях, для изучения электронно-колебательных состояний молекул, физико-химических свойств растворов, газообразных, жидких и твердых образцов. Измерение люминесценции проводят на спектрофлуориметрах. Если квантовый выход люминесценции больше 1 %, то такие соединения легко обнаруживаются люминесцентным методом. Когда мы имеем дело с сильно люминесцирующим веществом, то флуоресцентный анализ оказывается в тысячи (102 –104 ) раз чувствительнее спектрофотометрического. Кроме того, этот метод более селективен, поскольку флуоресцирует меньшее число соединений, чем поглощает. В связи с высокой чувствительностью химический люминесцентный анализ широко используется в различных областях промышленности, включая, химическую и нефтехимическую, в биологии, медицине, геологии, в пищевой промышленности, сельскохозяйственном производстве, дефектоскопии, археологии, криминалистике и т. д. Так как чувствительность данного метода очень высока, его можно использовать только для очень разбавленных растворов, концентрация которых гораздо ниже, чем при измерении поглощения. Регистрацию спектров осуществляют по собственной флуоресценции или с помощью флуоресцентных зондов или меток, вводимых в изучаемую микромолекулу. Различают флуоресцентные зонды-красители, которые связываются с макромолекулами нековалентно (электростатическими и ван-дер-ваальсовыми силами), и флуоресцентные метки, связанные химической связью. Измерение спектров флуоресценции таких присоединенных меток и зондов особенно важно при изучении свойств нуклеиновых кислот, вследствие малой интенсивности собственной флуоресценции. К флуоресценции в видимой области способны в основном два класса веществ: 1) большое число минералов и неорганические твердые люминофоры; 2) органические и металлоорганические соединения, обладающие интенсивным поглощением в УФ-области. 5. Основные этапы и выбор условий фотометрического определения. Прежде чем приступить к выполнению фотометрического определения необходимо выбрать условия анализа. Можно рекомендовать следующую схему. – перевод анализируемого образца в раствор и отделение, в случае необходимости, мешающих компонентов; – выбор фотометрической формы вещества и проведение химических реакций для получения окрашенного соединения (если определяемое вещество не обладает интенсивным собственным поглощением) – установление области концентраций, в которой выполняется основной закон светопоглощения: – измерение оптической плотности исследуемого раствора; – расчет содержания вещества в анализируемой пробе и его метрологическая оценка. Анализ состоит из следующих стадий: ¨ Переведение анализируемого вещества в раствор и отделение при необходимости мешающих компонентов. Фотометрируемый раствор должен быть истинным во всем диапазоне определяемых концентраций. ¨ Анализируемый раствор должен обладать сильным селективным поглощением, т.е. быть окрашенным. Если раствор не имеет собственной окраски, его переводят в окрашенную форму, применяя ФМР. Необходимо подобрать фотометрический реагент и условие фотометрической реакции. ФМР подбирают так, чтобы молярный коэффициент светопоглощения окрашенной формы вещества был по возможности большим, а условия анализа (рН раствора, соотношение концентрации определяемого вещества и ФМР, температура, природа растворителя) – как можно проще. ¨ Приготовление раствора сравнения. Раствором сравнения может быть: 1) растворитель, содержащий все компоненты (ФМР и т.д.), кроме анализируемого вещества.; 2) раствор определяемого вещества, с которым проведены те же фотометрические реакции, что и с анализируемым раствором, но концентрация раствора точно известна. а) необходимо выделить λопт б) сохранить λ = const при помощи светофильтра. По максимальному светопоглощению выбирают оптимальную длину волны света l и светофильтр. В широком диапазоне длин волн выбирают оптимальную длину волны по самому узкому и высокому пику. Окраска светофильтра должна дополнять окраску анализируемого раствора до белой (табл. 6). ¨ Выбор оптимальной толщины поглощающего слоя (длины кюветы). Для выбора оптимальной толщины поглощающего слоя проверяют выполнение закона Бугера – Ламберта. В наборе к фотометрическим приборам имеются кюветы с толщиной поглощающего слоя от 1 до 50 мм. При выборе толщины слоя учитывают диапазон значений А, для которых относительная погрешность измерения минимальна (0,5–1,0 %): 0,1 < А < 0,8. Оптимальная оптическая плотность: А = 0,45. ¨ Выбор интервала концентраций, при которых соблюдается закон Бугера-Ламберта-Бера. Готовят серию стандартных растворов и раствор сравнения. Выбирают концентрацию растворов для построения градуировочного графика. Для раствора с минимальной концентрацией, помещенного в выбранную кювету, величина А должна быть не менее 0,1; для раствора с максимальной концентрацией А≤0,8: При Сmax lmin A ≤ 0.8 Растворы, не удовлетворяющие таким требованиям, исключают из серии стандартных. Измеряют оптическую плотность стандартных растворов и строят градуировочный график. ¨ В идентичных условиях измеряют оптическую плотность анализируемого раствора и по градуировочному графику находят концентрацию определяемого вещества в растворе. 6. Фотометрический анализ двухкомпонентных смесей. отометрический анализ двухкомпонентных смесей Часто возникает необходимость определения двух веществ в смеси без предварительного разделения компонентов. Метод фотоколориметрии в ряде случаев позволяет провести такое определение. При этом возможность проведения анализа и используемые приёмы зависят от взаимного расположения спектров поглощения обоих веществ. Рассмотрим все возможные случаи по отдельности. 1. Спектры поглощения компонентов не накладываются (рис.50). Рис. 50. Выбор длин волн для анализа двухкомпонентной смеси, когда спектры двух соединений не накладываются. В этом случае измеряют светопоглощение смеси (Aсм) при двух длинах волн л1 и л2. Затем концентрацию каждого компонента находят, как обычно. При этом Таким образом, компоненты смеси не мешают определению друг друга. 2. Спектры поглощения компонентов частично накладываются (рис.51). В этом случае измеряют светопоглощение смеси при двух длинах волн л1 и л2. Затем концентрацию компонента (2) находят, как обычно. При этом Рис. 51. Выбор длин волн для анализа двухкомпонентной смеси, когда спектры двух соединений частично накладываются. При л1 используют закон аддитивности: На практике предварительно строят три градуировочных графика: для каждого компонента (1) при л1 и для компонента (2) при л2. Измерив и , поступают следующим образом: § по градуировочному графику для вещества (2) при л2 находят С2, используя значение § по градуировочному графику для вещества (2) при л1, используя значение С2, находят светопоглощение этого вещества при данной длине волны ; § рассчитывают светопоглощение вещества (1) при л1, используя закон аддитивности: § по калибровочному графику для вещества (1) при л1 находят С1, используя значение Таким образом, в случае частичного наложения спектров поглощения компонентов смеси фотометрическое определение каждого компонента возможно, но достаточно трудоёмко. 3. Спектры поглощения компонентов накладываются во всей видимой области (рис.52). Рис. 52. Спектры двух соединений накладываются во всей области спектра В этом случае фотометрическое определение каждого компонента провести невозможно. 7. Спектрофотометрический анализ двухкомпонентных смесей. Спектрофотометрический анализ двухкомпонентных смесей Методом спектрофотометрии, в отличие от метода фотоколориметрии, в любом случае взаимного расположения спектров поглощения двух веществ можно провести определение обоих компонентов в смеси без предварительного разделения. Рассмотрим все возможные случаи по отдельности. 1. Спектры поглощения компонентов не накладываются. Справедливо всё, описанное в п. 1 предыдущего раздела. 2. Спектры поглощения компонентов перекрываются во всей используемой области длин волн. В этом случае используют расчётный метод Фирордта. Он основан на законе аддитивности поглощения. Сущность метода: если в смеси содержится 2 поглощающих вещества, то измеряют светопоглощение смеси при 2 различных длинах волн. Затем составляют систему из 2 уравнений с 2 неизвестными концентрациями и решают её относительно С 1 и С 2. Значения е для каждого компонента при каждой длине волны определяют предварительно. При составлении системы уравнений используют основной закон светопоглощения и закон аддитивности: 3. Спектры поглощения компонентов частично накладываются. В этом случае система уравнений Фирордта упрощается. Например, если вещество (2) не поглощает свет при длине волны л2, то получаем: 8. Приемы нахождения концентрации в фотометрических анализах. В фотометрических методах анализа можно использовать все известные приёмы нахождения концентрации по величине аналитического сигнала: § Метод градуировочного графика. Используется для серийных аннализов. Делают минимум 5-8 измерений для стандартных растворов при л = const и l = const. График строят в координатах А - С. Метод применяют даже в случае отклонений от закона Бугера-Ламберта-Бера. В этом случае график строят по большему числу точек. § Метод стандартов (молярного коэффициента, сравнения). Используют при одиночных определениях, причём метод двух стандартов (ограничивающих растворов) оказывается точнее. § Метод добавок. Используют для анализа реальных объектов любой вариант метода (расчётный или графический). Необходимым условием применимости метода является подчинение закону Бугера - Ламберта - Бера. При подборе величины добавки необходимо придерживаться условия: Ах+доб. - Ах 0,1. § Фотометрическое и спектрофотометрическое титрование. Основано на измерении оптической плотности в ходе титрования (см. следующий раздел). |
