Форма урока комбинированный (2 часа). Цели
 Скачать 27.55 Kb. Скачать 27.55 Kb.
|
|
Форма урока: комбинированный (2 часа). Цели: Образовательные: на основе представлений о составе и строении этиленовых углеводородов рассмотреть особенности их химических свойств; дать представление о химии полимеров и реакциях полимеризации; познакомить с пластмассами и их значением в жизни современного общества; охарактеризовать связь химии с жизнью. Развивающие: совершенствовать умение сравнивать, обобщать, делать выводы о свойствах веществ на основе строения и о строении веществ по их свойствам, применять знания для составления прогнозов и объяснений, развивать умение применять приобретенные знания в нестандартных ситуациях. Воспитательные: развивать умение работать в парах и малых группах, прислушиваться к мнению друзей, обратить внимание на применимость закона диалектики о переходе количественных изменений в качественные, показать единство материального мира на примере генетической связи углеводородов разных гомологических рядов. Оборудование: мультимедийная установка, шаростержневые модели углеводородов, презентация «Химические свойства алкенов». На ученических столах: коллекция «Пластмассы»; образец полиэтилена, тигельные щипцы, стеклянная палочка, спиртовка, спички, пробирки, раствор бромной воды, раствор KMnO4, инструкция проведения опыта «Изучение свойств полиэтилена». (Приложение 1) Ход урока I. Организационный момент. II. Актуализация опорных знаний и мотивация познавательной деятельности. Учитель: Предлагает ответить на вопросы (Слайды: 1-4) и наводит на определение темы и целей урока. Непредельные углеводороды – это углеводороды, .. которые имеют в углеродной цепи кратные связи (двойные, тройные). Алкены – это непредельные углеводороды … содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и отвечают формуле СnH2n. Простейший алкен – ... этен (этилен). Молекулярная формула этилена ... C2H4 Структурная формула этилена ... CH2=CH2 Электронное строение молекулы этилена обусловлено ...гибридизацией атомов углерода. Особенности двойной связи (Состоит из σ-связи и π-связи. Препятствует вращению атомов углерода вокруг своей оси). Энергия двойной связи больше, чем для одинарной, но не в 2 раза (почему?) (Ответ: есть взаимное отталкивание электронов, π-связь менее прочная). Двойная связь поляризуется легче, чем одинарная (почему?)(Ответ: благодаря более подвижным электронам π-связи). III. Определение темы урока, целей и задач урока. Учитель задаёт вопрос: Как вы считаете, какой будет тема урока? (Ученики высказывают версии, формулируют с помощью учителя тему урока. Записывают тему урока в тетрадь). Слайд 5. Учитель: Каковы должны быть цели нашего урока? (Ученики предлагают цели, формулируют вместе с учителем). Слайд 6. IV. Изучение нового материала. Беседа с классом. Учитель: В основе учения об органических веществах лежит теория химического строения А.М. Бутлерова. Объясните почему? (Ответ: Эта теория раскрывает взаимосвязь между строением веществ и их свойствами, показывает, что свойства веществ неслучайные). Учитель: Как Вы думаете, какие химические свойства будут характерны для этиленовых углеводородов? Объясните почему? (Ответ: для алкенов характерны реакции присоединения, которые протекают по месту разрыва непрочной p-связи; также алкены горят с выделением углекислого газа и воды). Учитель: проанализируйте и сделайте вывод, в чем состоит отличие химических свойств алканов от алкенов. (Ответ: отсутствие p-связей у алканов делает невозможными реакции присоединения. Для них характерны реакции замещения, которые протекают по свободнорадикальному механизму. Алкены обладают большей реакционной способностью, чем алканы, что объясняется наличием в их молекулах двойной связи: s и p). Учитель: какие частицы называются радикалами? (Свободные радикалы-атомы, группы атомов, имеющие неспаренные электроны). Какие частицы называются электрофилами? (Электрофилы-катионы или молекулы, имеющие незаполненную электронную орбиталь, стремящиеся к заполнению ее электронами, так как это приводит к более выгодной электронной конфигурации атома). Учитель: И так, делаем вывод: p-связь легко разрушается под действием электрофильных («любящих электроны») реагентов, поэтому для алкенов характерны реакции электрофильного присоединения. (Слайд 7). Учитель: в какие реакции присоединения алкены могут вступать? (Ответы: гидрирование, галогенирование, гидратация, гидрогалогенирование). (Слайд 8). Химические свойства алкенов. 1. Присоединение. Гидрирование. Для правильного написания продуктов присоединения к алкенам необходимо помнить, что углеродный скелет в этих процессах не претерпевает изменений. Галогенирование (Слайд 9-11). 1) Качественная реакция на p-связь. (Слайд 9: видеофрагмент опыта). Обсуждение. Ученик у доски записывает реакцию взаимодействия пропена с бромной водой. 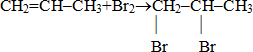 Проверка (Слайд 10). 2) Учитель обращает внимание учеников, что условия проведения реакции отражаются на продуктах реакции. (Слайды 11-12). Радикальное галогенирование-замещение атомов Н на галоген (Слайд 12).При высоких температурах (более 400°С) или облучении протекает замещение на хлор атомов водорода (расположенных по соседству с двойной связью). Учитель задает проблемный вопрос. Как будет происходить присоединение H2O и НГ к несимметричным алкенам? Ученики выдвигают свои гипотезы. (Слайд 13). Гидрирование и гидратация к несимметричным алкена. Правило В.В. Марковникова. (Слайды 14-16). Объяснение механизма реакций электрофильного присоединения. (Слайды 17-19). 2. Реакции полимеризация. (Слайды 20-22). На примере реакции полимеризации этилена закрепляются понятия, которые ученики получили в 9 классе и при изучении темы «Типы химических реакций в органической химии» в 10 классе, «полимер», «мономер», «структурное звено», «степень полимеризации». Рассказ учителя об истории открытия полимерных материалов, применения, свойствах, затронуть вопросы экологической безопасности распространения и утилизации пластмасс. (Слайды 23-26). Работа с коллекцией «Пластмассы». Выполнение лабораторного опыта: «Изучение свойств полиэтилена». (Приложение 1). После проведения опыта, идет обсуждение результатов исследования, в ходе которого ученики делают выводы (Слайды 27,28): Полиэтилен полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, в размягченном состоянии легко меняет форму, из расплава можно вытянуть нити. Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени. Не изменяет окраску желтой бромной воды и фиолетового раствора перманганата калия. Данные растворы веществ не действуют на полимер, т.к. отсутствует в составе полимера p-связь. 3. Реакции окисления. (Слайды 29-42). А) Реакция горения. (Слайд 30: видеофрагмент опыта). Учитель: Каким пламенем горит этилен? Какие вещества образуются при горении? Ученик на доске записывает уравнение реакции горения этилена, остальные- в тетрадях. (Слайды 31, 32) Б) Мягкое окисление. Реакция Вагнера. (Слайд 33: видеофрагмент опыта): качественная реакция на p-связь. 3CH2=CH2+2KMnO4+4H2O —> 3HOCH2–CH2OH+2MnO2+2KOH (Слайды: 34, 35) Вывод: обесцвечивание фиолетового раствора перманганата калия, при мягком окислении образуются двухатомные спирты-гликоли. В) Жесткое окисление. (Слайды 36-40). На усмотрение учителя данный материал может быть рассмотрен на элективных курсах при подготовке к ЕГЭ. Г) Каталитическое окисление. (Слайды: 41, 42). Учитель объясняет, что очень важными промышленными процессами является каталитическое окисление этиленовых углеводородов. V. Заключительная часть. Закрепление материала. 1. Назовите, какие химические свойства характерны для алкенов. Опорный конспект. (Слайд 43). 2. Выберите правильные ответы. (Слайд 44) Реакция гидробромирования пропена протекает: в соответствии с правилом В.В. Марковникова в соответствии с правилом А.М. Зайцева по радикальному механизму по электрофильному механизму с преимущественным образованием 2-бромпропана с преимущественным образованием 1-бромпропана Ответы: 1, 4, 5 3. Предложите способ очистки пропана от примесей этилена. Напишите уравнения соответствующих реакций. (Слайд 45). 4. Назовите химические реакции, которые являются общими для алканов и алкенов. (Слайд 46). VI. Подведение итогов урока. Рефлексия. Учитель предлагает ученикам определить результаты урока, сравнить их с целями. VII. Домашнее задание. (Слайд 47). § 12 по учебнику О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин. Химия. 10 класс (М. Дрофа, 2005); стр. 101 № 4 (б), № 6, 7. VIII. Оценки за урок. (Слайд 48). Список используемой литературы. (Слайд 49). О.С. Габриелян, И.Г. Остроумов. Настольная книга учителя химии. 10 класс. М. 2001 «Блик и К°» Н.Е. Дерябина. Органическая химия. Книга 1. Углеводороды и их монофункциональные производные. М. 2012. Единая коллекция цифровых образовательных ресурсов. school-collection.edu.ru Органическая химия. Видеоопыты: взаимодействие этилена с бромной водой, взаимодействие этилена с раствором перманганата калия, горение этилена. Интернет-ресурсы. |
