фотомтрические методы анализа. Фотометрические методы анализа. Фотометрические методы анализа
 Скачать 321.3 Kb. Скачать 321.3 Kb.
|
|
Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Министерства Здравоохранения РФ Фармацевтический факультет Кафедра фармацевтической химии КУРСОВАЯ РАБОТА Тема: «Фотометрические методы анализа» Работу выполнил студент группы: Проверил старший преподаватель каф. фарм. химии, к.ф.н. : Шебатин Р. В. Санкт-Петербург 2019 Содержание Введение Теоретические основы фотометрии Закон Бугера-Ламберта-Бэра Основной закон фотометрии Закон Бугера-Ламберта Закон Бэра Виды фотометрического анализа Визуальное сравнение Фотоэлектроколориметрия Спектрофотометрия Аппаратура для фотометрических измерений Спектрофотометры Фотоэлектроколориметры Расчеты фотометрических измерений Метод градуировочного графика Метод молярного коэффициента поглощения Метод добавок Заключение Список литературы Введение В настоящее время рынок лекарственных препаратов растет, а вместе с этим ужесточаются требования к качеству лекарственных веществ. От доброкачественности и количественного содержания действующих веществ и примесей напрямую зависит эффективность и безопасность лекарственных средств. Поэтому контроль качества лекарственных средств – один из важнейших этапов всего производственного цикла. Для определения загрязняющих веществ и количественного определения действующих веществ используют инструментальные методы аналитической химии. Данные методы основаны на измерении различных физических свойств определяемых веществ или продуктов их химических превращений (аналитических реакций) с помощью физических и физико-химических приборов. Результат измерения, несущий химико-аналитическую информацию, часто называют аналитическим сигналом. Фотометрический метод анализа - один из самых старых и распространенных методов физико-химического анализа. Его распространению способствовали сравнительная простота необходимого оборудования, особенно для визуальных методов, высокая чувствительность и возможность применения для определения почти всех элементов периодической системы и большого количества органических веществ. Открытие все новых и новых реагентов, образующих окрашенные соединения с неорганическими ионами и органическими веществами, делает в настоящее время применение этого метода почти неограниченным. Цель данной работы - исследование возможности применения фотометрического анализа в контроле качества лекарственных средств. Задачи данной курсовой работы: дать общую характеристику фотометрического метода; описать применение фотометрических методик в анализе лекарственных средств; выявить преимущества и недостатки фотометрии в контроле качества лекарственных веществ; Объект исследования - лекарственные средства. Предмет курсового исследования - качественный и количественный фотометрический анализ. Теоретические основы фотометрии Фотометрический метод анализа формировался в XVIII-XIX вв., когда фотометрия была лишь одним из разделов оптики. Измерение интенсивности излучения важно, например, для астрономических исследований. В XX в. фотометрический анализ стал разделом аналитической химии. Теоретической основой применения фотометрии в химическом анализе стал закон поглощения света, который не вполне правильно называли законом Бэра; теперь его чаще именуют законом Бугера-Ламберта-Бэра [1]. Метод анализа, основанный на переведении определяемого компонента в поглощающее свет соединение с последующим определением количества этого компонента путём измерения света поглощения раствора полученного соединения, называется фотометрическим. По окраске растворов окрашенных веществ можно определять концентрацию того или иного компонента или визуально, или при помощи фотоэлементов - приборов, превращающих световую энергию в электрическую. В соответствии с этим различают фотометрический визуальный метод анализа, называемый часто колориметрическим, и метод анализа с применением фотоэлементов - собственно фотометрический метод анализа. Фотометрический метод является объективным методом, поскольку результаты его не зависят от способностей наблюдателя, в отличие от результатов колориметрического - субъективного метода. Фотометрический метод анализа - один из самых старых и распространённых методов физико-химического анализа. Его распространению способствовали сравнительная простота необходимого оборудования, особенно для визуальных методов, высокая чувствительность и возможность применения для определения почти всех элементов периодической системы и большого количества органических веществ. Открытие всё новых и новых реагентов, образующих окрашенные соединения с неорганическими ионами и органическими веществами, делает в настоящее время применение этого метода почти неограниченным. Фотометрический метод анализа может применяться для большого диапазона определяемых концентраций. Его используют как для определения основных компонентов различных сложных технических объектов с содержанием до 20 - 30 % определяемого компонента, так и для определения микропримесей. Комбинирование фотометрических методов с некоторыми методами разделения - хромотографическим, экстракционным позволяет на 1-2 порядка повысить чувствительность определения. В некоторых случаях фотометрический метод может быть применён для одновременного определения в растворе в растворе нескольких ионов, хотя его возможности ограничены. В основе фотометрических методов анализа лежит закон Бугера-Ламберта-Бера. Закон Бугера-Ламберта-Бэра Основной закон фотометрии Если световой поток интенсивности I0 падает на кювету, содержащую исследуемый раствор, то часть этого потока Iк отражается от стенок кюветы и поверхности раствора, часть его Iа поглощается молекулами вещества, содержащегося в растворе, и расходуется на изменение электронной, вращательной и колебательной энергии этих молекул, часть Iа 1 поглощается молекулами самого растворителя. Если в растворе присутствуют твёрдые частицы в виде мутей или взвесей, то часть световой энергии Irотражается и от этих частиц и, наконец, часть энергии It проходит через кювету. На основании закона сохранения энергии можно написать уравнение: I0 = Iк + Iа + Iа 1 +Ir + It (1) При анализе прозрачных растворов в уравнении (1) член Ir равен 0. при работе на протяжении всего исследования с одним растворителем член Iа 1 можно считать постоянным. Кроме того, растворители всегда подбирают так, чтобы они сами в исследуемой области спектра обладали минимальным поглощением, которым можно пренебречь. При использовании одной и той же кюветы значение отражённого светового потока Iк очень мало и им можно пренебречь. Поэтому уравнение (1) можно упростить: I0 = Iа + It (2) Непосредственными измерениями можно определить интенсивность падающего светового потока (I0 ) и прошедшего через анализируемый раствор (It ). Значение Iа может быть найдено по разности между I0 и It ; непосредственному же измерению эта величина не поддаётся. На основании многочисленных экспериментов П. Бугером, а затем и И.Ламбертом был сформулирован закон, устанавливающий, что слои вещества одинаковой толщины, при прочих равных условиях, всегда поглощают одну и ту же часть падающего на них светового потока. Закон Бугера-Ламберта Два раствора одного и того же соединения различной концентрации одинаковы по оттенкам цвета, но различаются по интенсивности окраски. Интенсивность окраски измеряют по ослаблению энергии светового потока определённой длины волны. Интенсивность входящего светового потока обозначают обычно I0 , а интенсивность ослабленного поглощением светового потока через I. Величину поглощения света можно выражать разницей этих двух величин, или их отношением. Для различных фотометрических исследований наиболее удобно выражать интенсивность светопоглощения величиной: 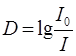 (3) (3)Эта величина называется оптической плотностью и постоянно применяется в различных расчётах. Удобство применения именно этой функции обусловлено прямой пропорциональностью между оптической плотностью и концентрацией, а также толщиной слоя раствора окрашенного соединения. Рассмотрим поглощение света раствором вещества, находящегося в кювете с параллельными стенками. Толщину слоя поглощающего свет раствора обозначим через b, а интенсивность светового потока, входящего через раствор, через I0 . разделим длину, занимаемую раствором в кювете, на b участков. Когда свет пройдёт через первый участок поглощающего свет раствора, интенсивность света ослабится в n раз и в конце первого участка будет равна 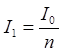 (4) (4)где n – число больше единицы. Конец первого участка является в то же время началом второго. Во второй участок раствора попадает, таким образом, поток света с интенсивностью I1 . при прохождении света через второй участок снова произойдёт ослабление света в такой же степени, т.е. в n раз. Таким образом, в конце второго участка интенсивность светового потока равна: 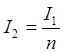 (5) (5)Принимая во внимание уравнение (4), получим: 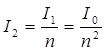 (6) (6)Таким образом, когда поток света пройдёт через всю толщину (т.е. согласно условию через b участков), интенсивность выходящего потока равна 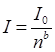 (7) (7)Отсюда 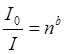 (8) (8)или, логарифмируя и вводя полученное значение в уравнение (3), находим выражение, связывающее оптическую плотность D с толщиной слоя: где lgn – постоянная величина, характерная для данного вещества. Как видно из уравнения (9), численное значение lgn можно найти, установив оптическую плотность раствора в кювете длиной 1 см (b=1). Зависимость между оптической плотностью и толщиной слоя, выражаемая уравнением (9), называется законом Бугера – Ламберта. Зависимость (8) можно также вывести из величины поглощения в бесконечно малом слое, интегрированием на всю толщину кюветы. Для этого, аналогично сказанному выше, рассмотрим поглощение монохроматического света телом с параллельными стенками. Бесконечно тонкий слой поглощает долю энергии входящего в него параллельного монохроматического пучка света, пропорциональную толщине слоя db. Тогда относительное уменьшение интенсивности светового потока 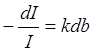 (10) (10)где k – коэффициент, характеризующий поглощение света данным телом и зависящий от свойств данного тела. Этот коэффициент в широких пределах не зависит от интенсивности светового потока, только при очень больших её значениях k перестаёт быть постоянным и наблюдается зависимость k от I, т.е. возникает нелинейность поглощения и k перестаёт быть пропорциональным I. Проинтегрировав уравнение (10), получим: Логарифмируя уравнение (10), получим: 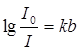 (12) (12)Постоянный коэффициент k аналогичен величине lgn из уравнения (9), т.е. k=lgn. Из рассматриваемого закона вытекает: отношение интенсивности светового потока, прошедшего через слой раствора, к интенсивности падающего светового потока не зависит от абсолютной интенсивности падающего светового потока; если толщина слоя раствора увеличивается в арифметической прогрессии, интенсивность светового потока, прошедшего через него, уменьшается в геометрической прогрессии. Закон Бэра Ослабление интенсивности светового потока при прохождении через раствор зависит от количества поглощающих свет центров на пути светового потока. Рассмотрим поглощение света раствором окрашенного соединения при условии, что состав и структура этого соединения не меняется с изменением его концентрации. Примером такого раствора может быть хромат калия; для постоянства pH при разбавлении к раствору прибавляют тетраборат натрия. Если налить немного этого раствора в высокий цилиндр и измерять поглощение света сверху, т.е. в полном слое. Согласно условию, общее количество поглощающих свет центров остаётся постоянным при разбавлении раствора, поэтому общее светопоглощение также не изменяется. При разбавлении раствора в n раз концентрация раствора уменьшится в n раз, а толщина слоя в цилиндре во столько же раз соответственно увеличится, поэтому общая оптическая плотность не изменится. Следовательно: где k – коэффициент пропорциональности, обозначаемый обычно через Пусть раствор, концентрация которого С1 , при толщине слоя b1 имеет такую же оптическую плотность, как и раствор того же вещества при большей толщине слоя b2 . Очевидно, во втором растворе концентрация С2вещества меньше, чем в первом растворе в отношении: С1 : С2 = b2 : b1 (14) С1 b1 =С2 b2 (15) Эту зависимость установил в 1852 г Бэр и экспериментально проверил её измерениями оптической плотности газообразного хлора при различных давлениях. Объединяя уравнения (9) и (14), можно написать: 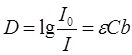 (16) (16)Эта зависимость называется законом Бугера – Ламберта – Бэра и применяется при различных расчётах в фотометрическом анализе. Если концентрация С выражена в молях на литр, а толщина слоя b – в сантиметрах, то коэффициент Также нужно сказать, что источниками ошибок при фотометрии могут быть отклонения от закона Бугера – Ламберта – Бэра и особенности возникающей окраски. Отклонения от закона Бугера – Ламберта – Бэра могут быть вызваны и посторонними веществами, присутствующими в растворе. Виды фотометрического анализа Фотометрический метод количественного анализа основан на переведении определяемого компонента в поглощающее свет соединение; количество этого продукта реакции устанавливают путем измерения светопоглощения [1-7]. В фотометрическом анализе применяют реакции различных типов. Для определения неорганических компонентов чаще всего используют реакции образования (иногда — разрушения) окрашенных комплексныхсоединений. Большинство металлов и неметаллов способны к образованию различных комплексных соединений, в том числе окрашенных, или, во всяком случае, способны к взаимодействию с окрашенными комплексами. Поэтому область применения фотометрических методов анализа практически не имеет ограничений. В настоящее время известны достаточно простые фотометрические методы определения почти всех элементов или их соединений. Для фотометрического определения органических компонентов чаще всего используют реакции синтезаокрашенных соединений. Реакции синтеза удобно применять и для определения некоторых неорганических компонентов, например сульфидов или нитритов. Значительно реже применяют в фотометрическом анализе реакции окисления — восстановления — при определении неорганических компонентов практически важное значение имеет только окисление хрома до хромата и марганца до перманганата. Довольно часто реакциями окисления — восстановления пользуются в различных стадиях фотометрического определения органических веществ. Наконец, ряд фотометрических методов основан на каталитическом эффекте. Чувствительность фотометрических методов, основанных на обычных реакциях образования окрашенных соединений, имеет естественный предел. Поэтому если необходимо значительное повышение чувствительности, поступают следующим образом. Определяемый компонент вводят в некоторую систему в качестве катализатора, в результате каждая частица определяемого компонента приводит к образованию большого количества частиц продукта реакции. Количество продукта каталитической реакции определяется фотометрическим методом. Таким образом, центральное место в фотометрическом анализе занимает химическая реакция. Время, затрачиваемое на анализ, чувствительность метода, его точность и избирательность зависят в основном от выбора химической реакции и оптимальных условий образования окрашенного соединения. Правильное измерение светопоглощения, разумеется, имеет большое значение [10-12]. Однако выбор того или другого способа измерения поглощения света обусловлен, как правило, не особенностями анализируемого материала или выбранной реакцией, а общими условиями работы той или другой лаборатории [5 - 9]. Различают три следующие группы способов измерений концентрации окрашенного соединения в растворе: - визуальное сравнение. Глаз является весьма чувствительным устройством. Однако визуально нельзя установить количественно степень поглощения света или даже оценить, во сколько раз один раствор окрашен сильнее, чем другой. Глазом можно довольно хорошо установить равенство интенсивности окрасок или цвета двух растворов. - инструментальные методы. а) поглощение света измеряют при помощи приборов с фотоэлементом.Такие приборы называют фотоэлектроколориметрами (ФЭК). В отличие от визуального способа, с помощью ФЭК можно непосредственно измерить ослабление интенсивности первоначального светового потока. Обычно при работе с ФЭК перед выполнением анализов составляют калибровочный график по серии стандартных растворов. Калибровочным графиком пользуются для многих определений, что очень удобно для массовых однотипных анализов. Если поглощение света измеряют с помощью ФЭК, такой способ называют фотоколориметрическим анализом; б) наиболее совершенным, хотя и более сложным прибором является спектрофотометр.В спектрофотометре ослабление интенсивности светового потока измеряется также с помощью фотоэлементов. Однако в спектрофотометре имеется призма или дифракционная решетка, а также щель. Это позволяет выделить узкий участок спектра, именно тот, c которым «оптически реагирует» окрашенное соединение. Известно очень мало «серых веществ», поглощающих свет равномерно во всех участках спектра. Большинство же окрашенных веществ поглощает преимущественно какой-нибудь один участок спектра. Поэтому измерение при длине волны, соответствующей максимуму спектра поглощения, увеличивает чувствительность. Кроме того, облегчается определение одного окрашенного соединения в присутствии другого, иначе окрашенного, в частности, при работе со спектрофотометром значительно улучшаются результаты фотометрического определения с применением окрашенных реактивов. Все названные выше способы измерения концентрации окрашенного соединения обычно называют фотометрическим анализом, независимо от того, выполняется ли измерение визуальным методом, фотоэлектроколориметром или спектрофотометром [1-3]. Приведенное выше разделение способов измерения светопоглощения не имеет резких границ. Так, в фотометре Пульфриха сравнение двух световых потоков выполняется визуально, однако более интенсивный поток ослабляется измерительной диафрагмой. Существенным преимуществом спектрофотометров является возможность изучения светопоглощения в отдельных участках спектра, т. е. наблюдения всего спектра поглощения, что очень важно для правильного выбора оптических условий измерения, а также для физико-химических характеристик окрашенных соединений. Фотометрические, в особенности спектрофотометрические, методы имеют большое значение не только для химического анализа. Спектрофотометрия является одним из наиболее важных методов изучения реакций между веществами в растворе, а также изучения состава и строения соединений, влияния различных факторов на равновесия между реагирующими веществами. С помощью спектрофотометрических методов сделай наиболее ценный вклад в химию комплексных соединений, являющуюся одной из важных теоретических основ фотометрического анализа неорганических соединений. Аппаратура для фотометрических измерений Для фотометрических измерений используют две большие группы приборов: фотоколориметры и спектрофотометры. В колориметрах нужные спектральные диапазоны выделяются при помощи светофильтров, ограничивающих участки спектра, в которых могут проводиться измерения. В спектрофотометрах участки спектра выделяются при помощи призм или дифракционных решеток, что позволяет устанавливать любую длину волны в заданном диапазоне. Конкретная последовательность операций при измерении оптической плотности или пропускания зависит от конструкции спектрофотометра или колориметра [2 - 11]. Однако основные принципы остаются неизменными. Сначала устанавливают необходимую длину волны, выбирая светофильтр на колориметре или вращая соответствующую рукоятку на спектрофотометре. Затем устанавливают нуль. Для этого в световой поток помещают кювету со стандартным раствором. Изменяя ширину щели, добиваются того, чтобы показания прибора соответствовали величине, предусмотренной инструкцией. На следующем этапе стандартный раствор заменяют исследуемым и производят отсчет величины оптической плотности или пропускания. Спектрофотометры Современные спектрофотометры позволяют работать с высокомонохроматизированным потоком излучения. Они применяются для концентрационного анализа и при изучении спектров поглощения веществ. Устройство и принцип действия спектрофотометра [2]. Структурную схему спектрофотометра можно представить в виде следующих основных блоков: источник света, монохроматор, кюветное отделение, фотоэлемент, регистрирующее устройство. Световой пучок от источника света попадает в монохроматор через входную щель и разлагается дифракционной решеткой или призмой в спектр. В монохроматический поток излучения, поступающий из выходной щели в кюветное отделение, поочередно вводятся контрольный и исследуемый образцы. Излучение, прошедшее через кювету, попадает на фотоэлемент, который преобразовывает световую энергию в электрическую. Электрический сигнал затем усиливается и регистрируется. Монохроматор – это оптическая система, выделяющая из всего спектра источника света излучение определенной длины волны. Это обычно призмы, по-разному преломляющие свет разных длин волн, или дифракционные решетки. В видимой области используются обычные стеклянные призмы, но в ультрафиолетовой области они не годятся, поскольку стекло начинает поглощать уже при λ < 400 нм, поэтому призмы делают из кварца. В качестве монохроматоров применяются также дифракционные решетки, которые представляют собой плоскопараллельную пластину с нанесенными на ней параллельными линиями – бороздками. Основное достоинство дифракционных решеток состоит в том, что можно увеличивать их разрешающую способность, поскольку она прямо пропорциональна плотности линий. Кроме того, во всем диапазоне длин волн дифракционные решетки имеют линейное разрешение, тогда как разрешение призменного монохроматора с увеличением длины волны уменьшается. Исследуемое вещество растворяют в соответствующем растворе и помещают в оптически прозрачный сосуд для измерений – кювету. Обычно кюветодержатель имеет ячейки для четырех кювет. Поскольку стекло поглощает ультрафиолетовый свет, для проведения измерений в ультрафиолетовой области спектра используют кварцевые кюветы. Для измерений в видимой области можно использовать пластиковые или стеклянные кюветы. При работе с летучими или химически активными веществами кюветы закрывают крышками. Поскольку кювета, помещенная в спектрофотометр, становится составной частью его оптической системы, с ней нужно обращаться очень аккуратно. Царапины и грязь на стенках кюветы сильно рассеивают и поглощают свет, искажая результаты измерений. Об этом особенно надо помнить при работе в ультрафиолетовой области. Кюветы можно протирать мягкими тканями, например, из хлопка. Не рекомендуется использовать для этих целей фильтровальную бумагу. Раствор лучше заливать в кювету, поставив ее в предварительно вынутый из прибора кюветодержатель. Содержимое кюветы должно быть гомогенным – это необходимое условие получения воспроизводимых данных. Нужно следить за тем, чтобы раствор не был мутным. Кюветы нужно заполнять до такого уровня, чтобы поток излучения проходил целиком через слой раствора. Чаще всего используются кюветы с оптическим путем 1 см, в которые обычно заливают 2,5–3 мл раствора. В такие кюветы входит 4–5 мл, но заполняют их полностью лишь в том случае, когда это необходимо. Есть кюветы с оптическим путем 50, 20, 5, 2 и 1 мм. Фотоэлементы преобразовывают световую энергию в электрическую. Электрический сигнал затем усиливается и регистрируется. Фотоны, бомбардируя поверхность фотоэлемента, выбивают из него электроны, количество которых пропорционально интенсивности света. От размера щели зависит диапазон длин волн света, падающего на образец. Поэтому для получения надежных результатов надо работать при минимально узкой для данных условий эксперимента щели. Если щель выбрана правильно, то при изменении ее размеров вдвое показания прибора не меняются. Оптическая схема спектрофотометра СФ-26 представлена на рисунке 1. 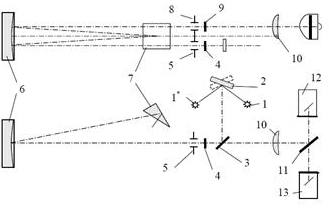 1 – монохроматор; 2 – зеркальный конденсатор; 3 – зеркало; 4 – линза; 5 – входная щель; 6 – зеркальный объектив; 7 – призма; 8 – выходная щель; 9 – линза; 10 – контрольный образец; 11 – поворотное зеркало; 12,13 – фотоэлементы. Рисунок 1 – Оптическая схема спектрофотометра СФ-26 Современный спектрофотометр представлен на рисунке 2.  Рисунок – 2 Спектрофотометр UV-mini-1240. Фотоэлектроколориметры Фотоэлектроколориметр – это оптический прибор, в котором монохроматизация потока излучения осуществляется с помощью светофильтров [2 - 12]. Рассмотрим колориметр фотоэлектрический концентрационный КФК-2. Назначение и технические данные. Однолучевой фотоколориметр КФК-2 14 предназначен для измерения пропускания, оптической плотности и концентрации окрашенных растворов, рассеивающих взвесей, эмульсий и коллоидных растворов в области спектра 315–980 нм. Весь спектральный диапазон разбит на спектральные интервалы, выделяемые с помощью светофильтров. Пределы измерения пропускания от 100 до 5 % (оптической плотности от 0 до 1,3). Основная абсолютная погрешность измерения пропускания не более 1 %. 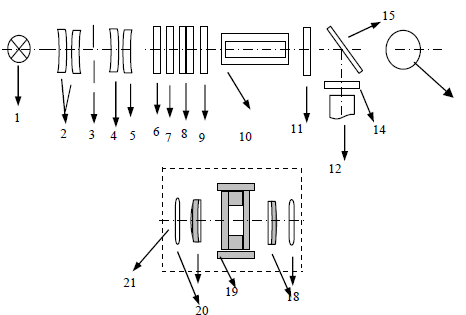 1 - лампа; 2 – конденсатор; 3 – диафрагма; 4,5 – объектив; 6 – теплозащитный светофильтр; 7 – нейтральные светофильтры; 8 – цветные светофильтры; 9,11 – защитные стекла; 10 – кювета с исследуемым раствором; 12 – фотодиод – 24 в области спектра 590 – 980 нм; 13 – светофильтр из цветного стекла; 14 – пластина для разделения светового потока; 15 – фотоэлемент Ф – 26 в области спектра 315 – 540 нм; 16,18 - линзы; 19 – кювета для малой емкости; 20 - приставка для микроанализа. Рисунок 3 – Принципиальная схема фотоколориметра КФК - 2 Для того чтобы из всей видимой области спектра выделить лучи определенных длин волн в фотоколориметрах на пути световых потоков перед поглощающими растворами устанавливают избирательные поглотители света – светофильтры. Светофильтры пропускают лучи лишь в определенном интервале длин волн с полушириной пропускания λ1/2макс–λ1/2макс и практически полностью поглощают лучи других длин волн. Сам прибор фотоколориметра представлен на рисунке 4.  Рисунок 4 – Фотоколориметр КФК-2 Расчеты фотометрических измерений Для обработки результатов фотометрических измерений и количественного определения действующего вещества используют следующие методы. Метод градуировочного графика В соответствии с законом Бугера – Ламберта – Бэра график в координатах А – с должен быть линеен и прямая должна проходить через начало координат. Для построения такого графика достаточно одной экспериментальной точки. Однако градуировочный график обычно строят не менее чем по трём точкам, что повышает точность и надёжность определений. При отклонениях от закона Бугера – Ламберта – Бэра, т. е. при нарушении линейной зависимости A от c, число точек на графике должно быть увеличено. Применение градуировочных графиков является наиболее распространённым и точным методом фотометрических измерений. Основные ограничения метода связаны с трудностями приготовления эталонных растворов и учётом влияния так называемых третьих компонентов, т.е компонентов, которые находятся в пробе, сами не определяются, но на результат влияют. Пример градуировочного графика представлен на рисунке 5. 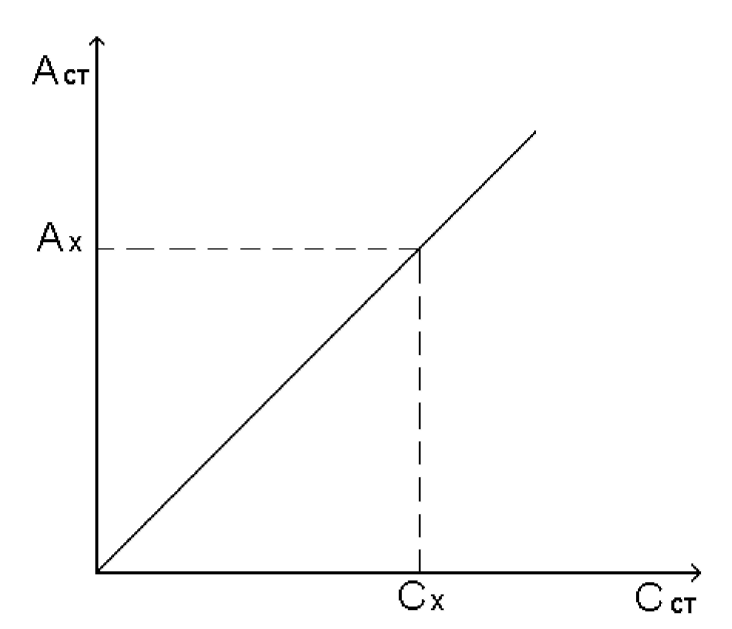 Рисунок 5 – Градуировочный график зависимости А от с Метод молярного коэффициента поглощения При работе по этому методу определяют оптическую плотность нескольких стандартных растворов Aст , для каждого раствора рассчитывают 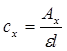 Ограничением метода является обязательное подчинение анализируемой системы закону Бугера – Ламберта – Бэра, по крайней мере, в области исследуемых концентраций. Метод добавок Этот метод применяют при анализе растворов сложного состава, так как он позволяет автоматически учесть влияние «третьих» компонентов. Сущность его заключается в следующем. Сначала определяют оптическую плотность Ax анализируемого раствора, содержащего определяемый компонент неизвестной концентрации cx , а затем в анализируемый раствор добавляют известное количество определяемого компонента (сст ) и вновь измеряют оптическую плотность Ax + ct . Оптическая плотность Ax анализируемого раствора равна: А оптическая плотность анализируемого раствора с добавкой стандартного: Сравнение уравнений (17) и (18) даёт: Отсюда находим концентрацию анализируемого раствора: 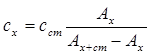 Концентрацию анализируемого вещества в методе добавок можно найти также по графику в координатах Ax +ст=f(cст ). Уравнение (18) показывает, что если откладывать Ax + ct как функцию сст , то получится прямая, экстраполяция которой до пересечения с осью абсцисс даст отрезок, равный - cx (рис. 6) 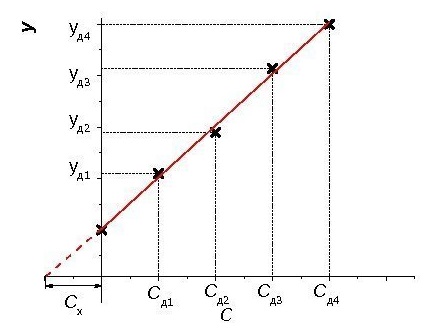 Рисунок 6 – метод добавок Заключение В современном мире существует достаточно большое количество методов для определения подлинности, доброкачественности и количественного содержания лекарственных веществ. На основании проделанной работы можно сделать следующие выводы: 1. Фотометрический метод анализа очень распространен благодаря тому, что он легок и удобен в исполнении, при поддержке указаний методики можно добиться качественных результатов; 2. В фотометрическом анализе применяют реакции различных типов. Для определения неорганических компонентов чаще всего используют реакции образования (иногда — разрушения) окрашенных комплексныхсоединений. Большинство металлов и неметаллов способны к образованию различных комплексных соединений, в том числе окрашенных, или, во всяком случае, способны к взаимодействию с окрашенными комплексами. Поэтому область применения фотометрических методов анализа практически не имеет ограничений; 3. Для фотометрических измерений используют две большие группы приборов: фотоколориметры и спектрофотометры. В колориметрах нужные спектральные диапазоны выделяются при помощи светофильтров, ограничивающих участки спектра, в которых могут проводиться измерения. В спектрофотометрах участки спектра выделяются при помощи призм или дифракционных решеток, что позволяет устанавливать любую длину волны в заданном диапазоне. Однако основные принципы остаются неизменными. На основании простоты, удобства и точности анализа фотометрические методы нашли широкое применение не только в фармацевтической области, но и в других областях. Методами абсорбционной спектрометрии анализируются руды, минералы, объекты окружающей среды, продукты переработки обогатительных и гидрометаллургических предприятий. Эффективно эти методы используется в металлургической, электронной областях промышленности, в медицине, биологии, криминалистике и т.д. Большое значение они имеют в аналитическом контроле окружающей среды и решении экологических проблем. Значительно расширились области практического применения методов абсорбционной спектроскопии благодаря более широкому использованию инфракрасной области спектра и приборов на базе ЭВМ. Это позволило разработать методы анализа сложных многокомпонентных систем без их химического разделения. Простые, быстрые и точные методы анализа имеют огромное значение для исследования различных реакций, установления состава и исследования различных химических соединений. Успехи химии координационных соединений, достижения микроэлектроники, приборостроения дают все основания ожидать дальнейшего повышения точности и чувствительности этих методов. Список литературы 1. Коренман, И.М. Фотометрический анализ. Методы определения органических соединений / И.М.Коренман. - М.: Химия, 2000. - 343с. 2. Бабко, А.К. Фотометрический анализ. Общие сведения и аппаратура / А.К.Бабко. - М.: Химия, 2008. – 375 с. 3. Булатов, М.И., Калинкин, И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам / М.И.Булатов, И.П.Калинкин. - М.: Химия, 2008. 378 с. 4. Васильев, В. П. Теоретические основы физико-химических методов анализа / В.П.Васильев. — М.: Высш. шк., 2005. 5. Крешков, А. П. Основы аналитической химии. Т. 3 / А.П. Крешков. — М.: Химия, 1970. 6. Купце,У., Шведт, Г. Основы качественного и количественного анализа / У.Купце, Г.Шведт. — М.: Мир, 2013. — 424 с. 7. Коваленко, П.Н., Багдасаров, К.Н. Физико-химические методы анализа / П.Н.Коваленко, К.Н.Багдасаров. - Ростов-на-Дону. Изд. РГУ, 2014. - 290 с. 8. Берштейн, И.Я.Спектрофотометрический анализ в органической химии / И.Я.Берштейн. - Л.: Химия, 2000. - 200 с. 9. Илларионова Е.А., Сыроватский И.П. Фотометрия. Теоретические основы метода. Практическое применение метода: учебное пособие / Е.А.Илларионова, И.П. Сыроватский. – Иркутск, 2013. – 83с. 10. Скугг Д., Уэкст Д. Основы аналитической химии. Т. 2.— М.: Мир, 2007. 11. Ляликов Ю.С. Физико-химические методы анализа / Ю.С.Ляликов. - Москва, «Химия», 2011. |
