определение никеля в стали. Фотометрическое определение никеля в стали
 Скачать 121.16 Kb. Скачать 121.16 Kb.
|
|
ФГАОУ ВО «Уральский Федеральный Университет Имени первого Президента России Б.Н. Ельцина» Химико – технологический институт Отчет к лабораторной работе На тему: Фотометрическое определение никеля в стали. Студент Боркин Р.А Институт ХТИ Группа ХЗ-300014 Зачетная книжка №03002417 Цель работы: практическое освоение методики фотометрического анализа (методы абсолютной и дифференциальной фотометрии) Сущность метода определения Определение никеля основано на образовании комплексного соединения никеля с диметилглиоксимом (ДМГ) винно-красного или буровато-красного цвета, способного поглощать свет. Молярный коэффициент светопоглощения комплекса при λ = 490 нм. Комплекс образуется в щелочной или аммиачной среде в присутствии окислителей - брома, йода, пероксида, гипохлорит- или персульфат-ионов. Следует иметь в виду, что при большой концентрации никеля (>1,5 мг/л), часть его выпадает в осадок в виде диметилглиоксимина никеля. Для получения окрашенного комплекса точно взвешенную навеску стали ( ̴0,100г) растворяют в разбавленной 1:4 серной кислоте при кипячении с последующим добавлением нескольких капель концентрированно азотной кислоты для разрушения карбидных включений никеля. Полученный раствор охлаждают, разбавляют дистиллированной водой до определенного объема в мерной колбе, тщательно перемешивают и отбирают аликвотную часть для приготовления окрашенного комплексного соединения. Многие компоненты (Fe, Mn, Cr, Si и др.) мешают определению. Их влияние устраняют добавлением в исследуемый раствор винной или лимонной кислот для образования тартратных или цитратных комплексов, не мешающих определению. Наряду с исследуемым раствором готовят серию стандартных растворов никеля с диметилглиоксимом для построения градуировочного графика. После небольшой выдержки, около 15 минут измеряют оптические плотности исследуемого и стандартных растворов. Механизм реакции: 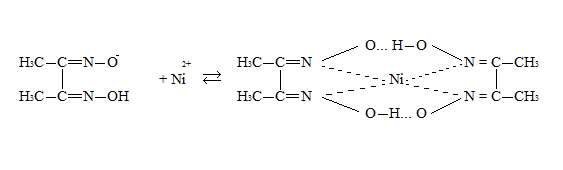 Объект анализа: проба, содержащая 2-10% никеля. Реактивы: Никеля стандартный раствор, Т=2,95*10-5 г/мл; Калия гидроксид, 5% раствор; Аммония персульфат, 5% раствор; Кислота винная, 10% раствор; Диметилглиоксим, 1% щелочной раствор. 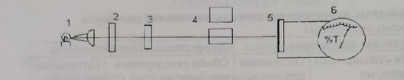 Рис. 1. Схема однолучевого фотометра: 1 - вольфрамовая лампа; 2 - подвижная диафрагма для настройки пропускания света на 100%; 3 - светофильтр; 4 - кювета с анализируемым раствором; 5 - Фотоэлемент; 6 - микроамперметр Разложение пробы стали и приготовление анализируемого раствора 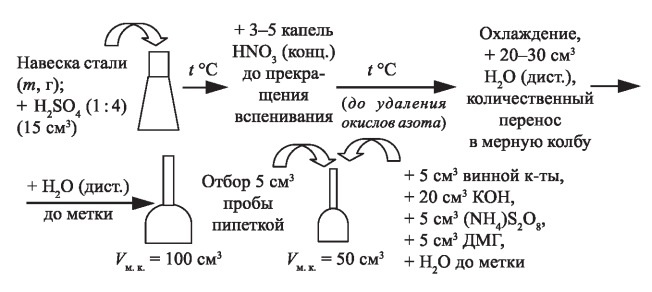 Рис. 2. Схема разложения пробы и приготовления анализируемого раствора. Приготовление стандартных растворов и построение градуировочных графиков: В пять мерных колб вместимостью 50,00 мл добавить соответственно: 1,00; 3,00; 5,00; 7,00; 9,00 мл стандартного раствора никеля, а затем в строго определенном порядке добавляют реактивы в таких же объемах, как и в случае приготовления анализируемого раствора (+5 мл винной кислоты, +20 мл КОН, +5 мл (NH4)S2O8, +5 мл ДМГ). Объемы полученных растворов в мерных колбах доводят дистиллированной водой строго до метки и тщательно перемешать. После небольшой выдержки порядка 15 минут, приступают к фотометрированию растворов. Фотометрирование раствора и построение градуировочного графика Выполнение анализа: Вариант №9 Навеска m=0,1023г перенесена в колбу на 250 мл. Затем отбирается 2мл стандартного раствора и переносится в колбу на 50мл, добавляются все реактивы как для градуировочных растворов. Измерение производится относительно нулевого раствора. Оптическая плотность пробы составляет: 1 измерение – 0,144; 2 измерение – 0,375; 3 измерение – 0,671. Результаты измерения оптических плотностей раствора
Вычисление результатов: mNi = TNi * Vx * Vколбы/Vпипетки = 2,95*10-5 * 2 * 250/2 = 0,0074 г. ωNi = (mNi/mнавески) * 100% = (0,0074/0,1023) * 100% = 7,23% Вывод: Определение никеля в пробе составило 7,23% 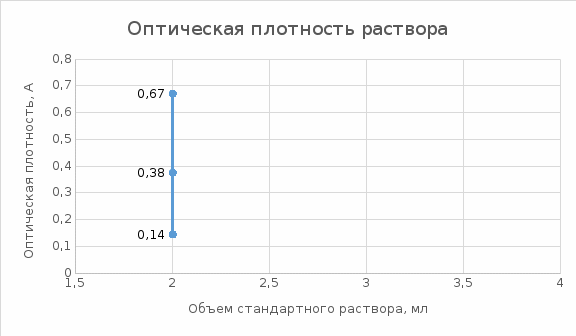 |
