Лабораторная работа (копия). Гальванические элементы
 Скачать 83.88 Kb. Скачать 83.88 Kb.
|
|
Лабораторная работа № 1. Тема: «Гальванические элементы». Цель: 1. Уяснить принцип работы гальванического элемента (Якоби-Даниэля). 2. Выявить влияние концентрации электролита на значение ЭДС элемента. Оборудование и реактивы: стеклянные химические стаканы, цинковая и медная пластины, растворы сульфата цинка и сульфата меди, солевой мост, вольтметр, соединительные проводники с клеммами. Ход опыта (методику эксперимента записать в отчете): Просмотрите видеозапись: «Гальванический элемент». Гальванический элемент состоит из соединенных между собой полуэлементов, каждый из которых представляет собой металлический электрод, погруженный в раствор соли того же металла. Полуэлементы соединяются в электрическую цепь с помощью трубки, заполненной токопроводящим раствором (так называемого солевого моста). Составьте схему и рисунок гальванического элемента. Схема гальванического элемента Якоби-Даниэля: (-)Zn|ZnSO4||CuSO4|Cu(+) Рисунок:   Zn  Используя таблиnу №3 («ряд напряжений») в Приложении Задания на контрольную работу №1 по дисциплине «Химия», определите, какая металлическая пластина будет являться анодом. Запишите схему гальванического элемента в ионном виде, объясните, что символизируют в этой записи одинарные и двойные вертикальные линии. Анодом будет металл с меньшим значением потенциала (цинк, 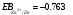 ); а катодом - с бОльшим (медь, ); а катодом - с бОльшим (медь, 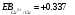 ) )Схема гальванического элемента в ионном виде (-)Zn|Zn2+||Cu2+|Cu(+) двойные линии показывают границу раздела растворов электролитов, а одинарные - границу раздела фаз. Составьте ионные уравнения, происходящие на аноде и катоде. Напишите общие молекулярные и ионные уравнения реакций, протекающих при работе гальванического элемента. Анод: Zn-2e-=Zn2+ Катод: Cu2++2e-=Cu Общее уравнение: CuSO4+Zn=ZnSO4+Cu↓ ионное: Cu2++SO42-+Zn=Zn2++SO42-+Cu↓ Опишите, за счёт чего образуется и как направлен электрический ток в этом элементе. Электрический ток направлен в противоположную сторону от направления движения электронов (т.к. они имеют отрицательный заряд), т.е. от катода к аноду. Электрический ток образуется за счёт разницы потенциалов катода и анода. Используя уравнение Нернста, представленного в конце видеоматериала, рассчитайте значение электродвижущей силы для каждого из следующих опытов. Потенциалы электродов найдём с помощью уравнения Нернста: 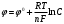 , где , где 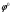 – стандартный электродный потенциал, T – температура (в Кельвинах), F - постоянная Фарадея, R - универсальная газовая постоянная, n - число моль переходящих от анода к катоду электронов на моль металла, С – концентрация ионов металла в растворе. – стандартный электродный потенциал, T – температура (в Кельвинах), F - постоянная Фарадея, R - универсальная газовая постоянная, n - число моль переходящих от анода к катоду электронов на моль металла, С – концентрация ионов металла в растворе.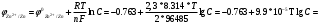 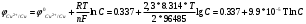 ЭДС элемента найдём по формуле: 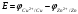 Используем значение комнатной температуры для уравнения Нернста T=25+273=298 К Опыт 1. В стакан с 1М (моль/л) раствором CuSO4 опустите медный электрод, в другой с 1М раствором ZnSO4 – цинковый. Оба раствора соедините солевым мостом, а медный и цинковый электроды при помощи проводников присоедините к чувствительному вольтметру. 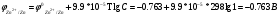 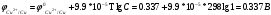 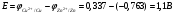 Опыт 2. В стакан с 0,1М раствором CuSO4 опустите медный электрод, в другой – с 1М раствором ZnSO4 – цинковый. Рассчитайте значение ЭДС полученного элемента. 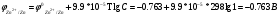 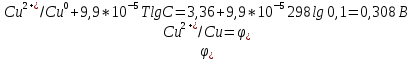 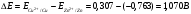 Как изменится значение измеренной ЭДС по отношению к значению ЭДС в опыте 1 и почему? ЭДС снизилась из-за понижения ЭДС медного электрода, что было следствием понижения концентрации ионов меди. 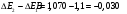 , ЭДС уменьшилось на 0,03В , ЭДС уменьшилось на 0,03ВОпыт 3. В стакан с раствором 0,05М CuSO4 опустите медный электрод, в другой с 0,1М раствором ZnSO4 – цинковый. Рассчитайте значение ЭДС полученного элемента.  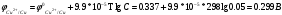  Опыт 4. В стакан с раствором 0,5М CuSO4 опустите медный электрод, в другой с 0,05М раствором ZnSO4 – цинковый. Рассчитайте значение ЭДС полученного элемента. 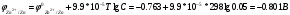  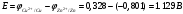 Таблица 1.
8. Определите значение δ (относительная ошибка, %), которая рассчитывается по формуле: 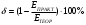 , если измеренная реальная ЭДС в составленном гальваническом элементе равна , если измеренная реальная ЭДС в составленном гальваническом элементе равна 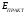 . .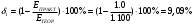 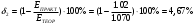 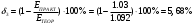  9. Сделайте вывод по лабораторной работе, руководствуясь поставленной целью. В ходе лабораторной работе была определено, что ЭДС гальванического элемента Якоби-Даниэля зависит логарифмически от концентрации растворов. Отличия экспериментальных ЭДС от теоретических составили 4.67-9,09%. При понижении концентрации ионов меди ЭДС элемента уменьшается, а при понижении концентрации ионов цинка ЭДС элемента увеличивается. |
