Галогенирование. Галогенирующие агенты. Механизм реакции галоген. Галогенирование. Галогенирующие агенты. Механизм реакции галогенирования аренов и их производных. Цель рассмотреть реакции галогенирования аренов и их производных
 Скачать 198.19 Kb. Скачать 198.19 Kb.
|
|
Галогенирование. Галогенирующие агенты. Механизм реакции галогенирования аренов и их производных. Цель: рассмотреть реакции галогенирования аренов и их производных. СодержаниеВведение 1 1. Галогенирующие агенты 2 2. Галогенирование ароматических соединений (Аренов) 2 2.1. Механизм галогенирования 2 2.3. Бромирование ароматических соединений 4 2.4. Йодирование ароматических соединений 5 3. Галогенирование производных аренов 6 4. Методы получения органических галогенидов 8 Заключение 8 Литература 9 ВведениеДля аренов наиболее характерны реакции, идущие с сохранением ароматической системы-реакции замещения атомов водорода, связанных с циклом. Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение π-электронного облака с двух сторон плоского σ-скелета молекулы. Механизм галогенирвания идет по электрофильному замещению атома водорода. 1. Галогенирующие агентыВ качестве электрофильных галогенирующих агентов в реакции используется молекулярные галогены или комплексы галогенов с разнообразными кислотами Льюиса (FeCl3, FeBr3, AlCl3, AlBr3, галогениды Ga, Sb, Sn, Ti). Очень часто применяются растворы Cl2 или Br2в уксусной кислоте. 2. Галогенирование ароматических соединений (Аренов)2.1. Механизм галогенированияГалогенирование аренов - это, как правило, электрофильное замещение атома водорода. Галогенирование ароматических углеводородов осуществляется действием галогенов в присутствии катализаторов: кислот Льюиса, железа, йода и др. по электрофильному механизму (SE). 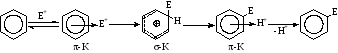 2.2. Хлорирование аренов в безводной среде. - Подготовка хлора. Хлор, как правило, поступает на производство в баллонах, под давлением в жидком состоянии. Хлорные баллоны соединяют через коллектор с испарителем. Жидкий хлор попадает в теплообменник, испаряется и в газообразном состоянии осушается. В качестве осушающего агента используются концентрированная серная кислота. - Подготовка жидкого сырья заключается в его осушке. С этой целью применяют безводный хлорид кальция, гидроксиды натрия или калия. Хлорид кальция может поглощать влагу в количестве, равном своей массе, что соответствует образованию шестиводного гидрата CaCl2.6H2O. Загрузку хлорида кальция рассчитывают на поглощение 3050% влаги от его массы. Некоторые углеводороды осушают методом азеотропной отгонки воды. - Хлорирование органических жидкостей проводят в аппаратах, называемых хлораторами или абсорберами, которые должны иметь:
Все это создает значительные трудности при конструировании хлораторов периодического действия. - Хлорирование твердых веществ проводят в среде растворителя. Катализатор в этих случаях, как правило, не требуется, поскольку в качестве растворителей используют вещества, активирующие процесс (например, серная кислота). Реактор (хлоратор) для хлорирования твердых веществ в среде серной кислоты, представляет собой чугунный или стальной котел с рубашкой, снабженный турбинной мешалкой и кольцевым барботером. - Обработка продуктов хлорирования заключается в разделении и очистке веществ, составляющих реакционную массу, получаемую в результате хлорирования. Как правило, для этого приходится пользоваться ректификацией смеси. - Очистка отходящих газов заключается в выделении хлорируемого сырья из газовой смеси и последующей абсорбции хлористого водорода. При большом содержании органического вещества в отходящем газе его конденсируют в графитовых или эмалированных теплообменниках вследствие большой агрессивности среды (конденсационный метод). При малом содержании вещества в газе, его пары поглощаются растворителями (сорбционный метод). 2.3. Бромирование ароматических соединений- Подготовка сырья осуществляется так же, как при хлорировании. Субстрат сушат. Бром, как правило, используют товарный, но при необходимости очищают перегонкой. Реакторы – броматоры– более простые, чем хлораторы, т.к. бром - жидкость и растворяется в органических жидкостях. Для защиты от коррозии их обычно эмалируют или снабжают никелевыми вкладышами (значительно реже). Величина теплообменной поверхности реактора не лимитирует скорость ведения процесса. - Загрузка брома является технологически неудобной стадией процесса, которую довольно трудно механизировать. Практический интерес представляет применение брома в виде бромовоздушной смеси, жидкого брома или раствора брома в инертных растворителях. - Бром является дорогим и дефицитным сырьем. Для его полного использования процесс проводят либо в присутствии окислителей, либо осуществляют регенерацию брома из бромоводорода. В некоторых случаях экономически целесообразно улавливать бромид водорода растворами щелочей и выделять из них товарный бромид натрия. А) В качестве окислителей используют хлорат калия, хлор и др.:  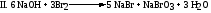  Однако использование водных растворов солей (KClO3, NaBrO3 и NaBr), а также хлора, часто приводит к протеканию целого ряда побочных процессов (окисление и хлорирование субстрата и продукта реакции). В связи с этим бромирование, как правило, ведут молекулярным бромом, а выделяющийся бромид водорода улавливают и окисляют до брома. Б) Регенерацию брома осуществляют по двум основным схемам: 1.Окисление растворов бромида натрия хлором  Выделяющийся бромистый водород поглощается раствором гидроксида натрия. Сюда же присоединяют бромные воды, образующиеся после отделения и промывки водой растворов целевых продуктов. Водные растворы солей брома подкисляют до рН 33,5, нагревают до 80-85°С и подают сверху в насадочную колонну. В нижнюю часть колонны поступает газообразный хлор и острый пар. Отогнанные пары воды, брома и не прореагировавший хлор поступают в холодильник, где пары воды и брома конденсируются и самотеком поступают в водоотделитель. После отделения воды бром через гидрозатвор сливают в сборник и возвращают на бромирование. Хлор из водоотделителя направляют в скруббер и поглощают раствором едкого натра. Для дополнительной очистки бром перегоняют на ректификационной колонне. Выход брома составляет 80-85%. 2.Взаимодействие бромида натрия с гипохлоритом натрия: Предварительно упаренные растворы NaBr загружают в типовой реактор, выполненном из кислотоупорной стали, подкисляют соляной кислотой, нагревают до 60-65°С, и в течение 1 часа приливают раствор гипохлорита натрия. Затем бром отгоняют в сборник. Выход брома 85%. Преимущества метода - простота аппаратурного оформления, меньшая опасность при работе. 2.4. Йодирование ароматических соединенийЙодирование ароматических соединений ведут растворами йода (обычно в органических растворителях), при нагреваниив присутствии окислителей (азотной кислоты, серного ангидрида и др.): 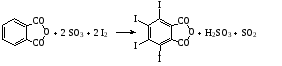 - В связи с трудностью прямого йодирования в химфарм. промышленности широко используется йодирование аренов хлоридом йода. Обычно используют более дешевый комплекс IСl.KCl, который получают при барботировании газообразного хлора через водный раствор йодистого калия и хлористого калия: 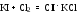 Избыток хлора нежелателен, а небольшое количество свободного йода катализирует процесс йодирования. Йодирование проводят в водной среде при умеренном нагревании и избытке кодирующего агента (до 50%). Продукты реакции отделяют фильтрованием. - Регенерация йода из водных растворов является серьезной проблемой. Купоросный метод считается наиболее предпочтительный. По этому методу свободный йод переводят в иодид раствором сульфита натрия, затем прибавляют раствор медного купороса и осаждают иодид меди: Отфильтрованный и отжатый осадок CuI2 обрабатывают окисью железа в концентрированной серной кислоте: Кристаллы йода, осевшие на дно, отфильтровывают и отправляют на очистку. Выход йода по этому методу составляет 90-95% от его общего содержания в исходном растворе. 3. Галогенирование производных ареновГомологи бензола галогенируются легче. Каталитическое бромирова- ние, хлорирование, йодирование приводит к о- и n-замещенным в ядре. 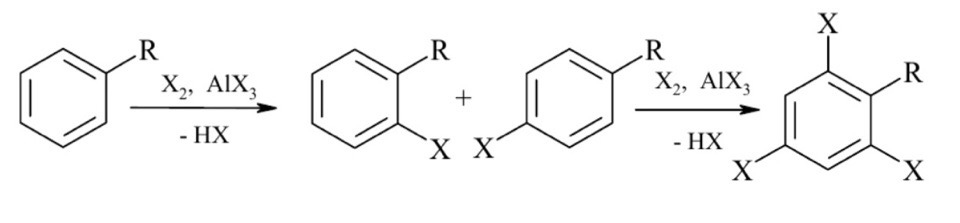 Без катализаторов при освещении и нагревании замещение идет в бо- Без катализаторов при освещении и нагревании замещение идет в бо-ковую цепь: 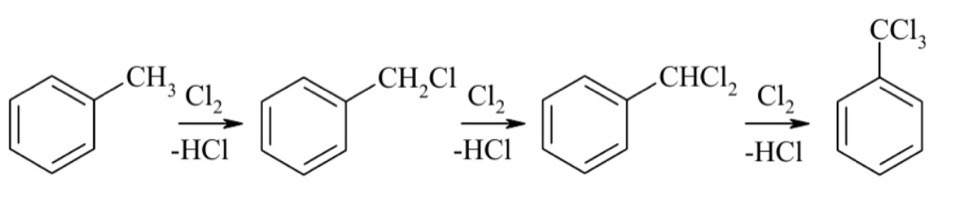 Нафталин вступает в реакции замещения легче, чем бензол. При этом заместитель почти всегда становится в α-положение, так как в этом случае возникает энергетически более выгодный σ-комплекс, чем при замещении в β-положении. При галогенировании нафталина при комнатной темпера- туре без катализаторов получаются α-галогенонафталины с примесью не- больших количеств (около 5 %) β-изомеров. 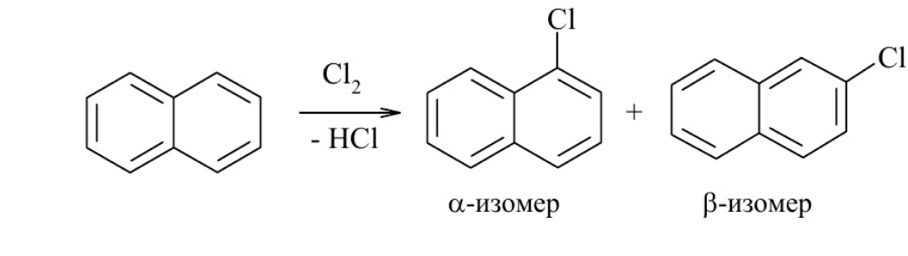 Бромирование при 500 оС дает смесь равных количеств α- и β- Бромирование при 500 оС дает смесь равных количеств α- и β-изомеров. В присутствии катализаторов можно заместить все восемь ато- мов водорода хлором. Для антрацена характерна большая непредельность, чем для нафтали- на, поэтому он склонен к реакциям присоединения, особенно по положе- ниям 9 и 10 Поэтому взаимодействие с галогенами для него протекает че- рез стадию присоединения, с образованием дигалогенпроизводных, кото- рые могут быть выделены, а затем образуется 9-замещенный продукт при отщепление молекулы галогеноводорода: 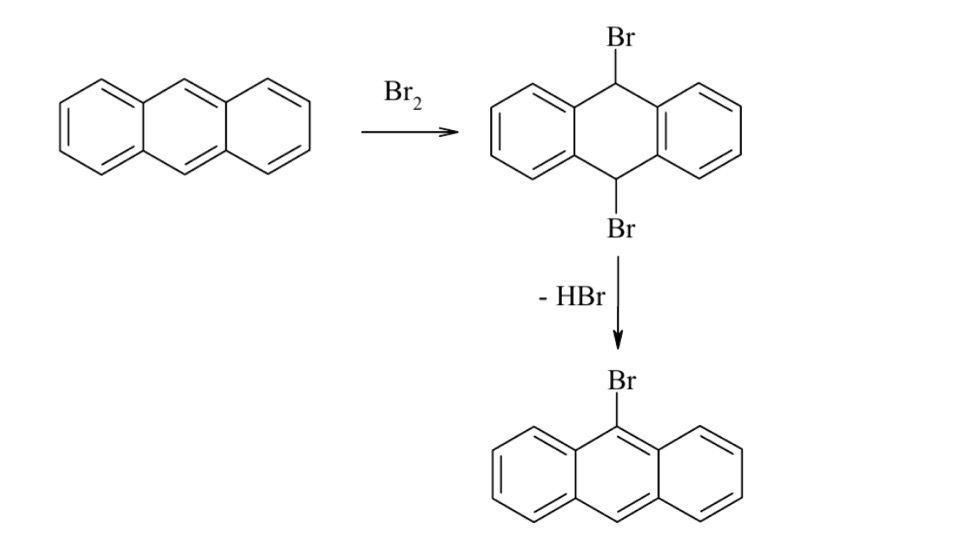 Наличие сильных донорных заместителей в бензольном ядре заметно Наличие сильных донорных заместителей в бензольном ядре заметнооблегчает введение галогенов: из фенола и анилина получаются 2,4,6- трибромиды при взаимодействии с бромной водой без катализатора и по- вышения температуры:  Если в бензольном ядре в качестве заместителя имеется атом галоге- на, он осуществляет о-, n- ориентацию вновь входящей группы как замес- титель I рода, но в отличие от других заместителей затрудняет процесс электрофильного замещения. Эта особенность объясняется конкурентным действием 2-х электронных эффектов: отрицательным индуктивным и по- ложительным мезомерным. 4. Методы получения органических галогенидовМетодов получения органических галогенидов много. Кроме собственно «галогенирования» - процесса замены атома водорода в молекуле органического соединения на галоген (Hlg) – используются много других методов, которые приводят к образованию связи C-Hlg. Выбор метода и условий проведения реакции зависит как от природы субстрата, так и от природы вводимого галогена (фтор, хлор, бром, иод). Органические галогениды, благодаря высокой химической активности, широко используются в синтезе новых соединений, в том числе и БАВ. Это реакции нуклеофильной замены атома галогена, элиминирования, образования металлорганических соединений, и т.д. Все они биологически активны: галогениды алифатического ряда обладают наркотическими свойствами, а арилгалогениды часто проявляют антимикробные свойства. В связи с этим, в состав молекулы многих лекарственных соединений входит один или несколько атомов галогена (хлороформ, хлоралгидрат, бромизовал, дииодтирозин, левомицетин, фторурацил и т.д.). Биологическую активность галогенидов связывают, с одной стороны, с их высокой растворимостью в жировых тканях и липидах и, с другой стороны, с высокой химической активностью (в частности, алкилирующей). ЗаключениеМы рассмотрели галогенирование алканов и их производных, исходя их этого можно сделать вывод для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SЕ. В них участвует как само бензольное ядро, так и связанная с ним боковая цепь. π-система обладает повышеной устойчивостью, поэтому для бензольного кольца характерны реакции замещения. Реакции замещения у аренов протекают легче, чем у предельных углеводородов. Литератураhttp://himija-online.ru/organicheskaya-ximiya/areny/ximicheskie-svojstva-arenov.html https://clck.ru/EqsZK Методы получения органических галогенидов в химической технологии БАВ Л.В. Моисеева, Л.Ф. Пономарева. Учебно-методическое пособие для вузов: МЕТОДЫ ОРГАНИЧЕСКОГО СИНТЕЗА: ГАЛОГЕНИРОВАНИЕ, СУЛЬФИРОВАНИЕ Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. Учебник для студентов химических специальностей и аспирантов, часть 2, 5-е издание, 464 с.. |
