занятие 13 как надо. Газовые законы. Уравнение состояния идеального газа
 Скачать 88.25 Kb. Скачать 88.25 Kb.
|
ОГАПОУ «Белгородский индустриальный колледж»План занятия № 13 Тема занятия: Газовые законы. Уравнение состояния идеального газа. Вид занятия - смешанный. Тип занятия комбинированный. Учебные цели занятия: Установить зависимость между параметрами, определяющими состояние газа. Сформулировать законы для изопроцессов в газе. Задачи занятия: Обучающая: Установить зависимость между параметрами, определяющими состояние газа. Сформулировать законы для изопроцессов в газе. Развивающая: Развитие мыслительной деятельности учащихся с помощью анализа и сравнения типов соединений, обобщения изучаемых фактов. Развитие устной речи студентов. Воспитательная: показать важность знаний о соединениях источников и законах тока для повседневной жизни. Планируемые образовательные результаты: В результате изучения темы обучающиеся должны знать: зависимость между параметрами, определяющими состояние газа, законы для изопроцессов в газе. уметь: Решать задачи на газовые законы Ход занятия: Организация начала урока. (2 минуты). Приветствие. Постановка цели: I. Организация учебной деятельности учащихся на уроке. Сообщение темы, цели, задач урока. Стимулирование мотивации учебной деятельности при обучении. II. Проверка знаний и умений. Организация самостоятельной работы. III. Изучение нового материала. Изложение нового материала сопровождается показом фрагментов изопроцессов [3] Учитель: (вопросы для повторения) 1. Основное уравнение МКТ имеет вид: 2. Температура - мера средней кинетической энергии. Почему? 3. Как связана абсолютная шкала и шкала Цельсия? Задача урока: охарактеризовать состояние идеального газа через макропараметры (p, V, T) Учитель: Запишем зависимость давления газа от концентрации молекул и температуры Из данного уравнения вытекает связь между давлением, объемом и температурой идеального газа, который может находиться в двух любых состояниях. Рассмотрим систему , находящуюся в двух состояниях, с параметрами p, V, T. 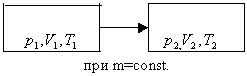 Запишем уравнения для двух состояний. (Учащиеся самостоятельно делают вывод и формулируют определение). Определение: при фиксированной массе отношение произведения давления и объема на температуру есть величина постоянная. Учитель: С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех параметров – давление, объем или температура – остаются неизменными. Определение: количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессамия). Рассмотрим каждый из процессов Изотермический процесс (процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре) [3] сформулируем определение. (учащиеся формулируют самостоятельно) определение: для газа данной массы произведение давления на объем постоянна, если температура газа не меняется.- закон Бойля – Мариотта. 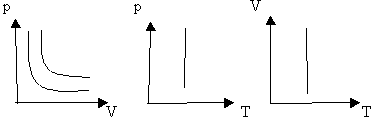 Рис 1. Вывод: (учащиеся самостоятельно по первому рисунку) изотерма соответствующая более высокой температуре Изобарный процесс. (процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении). [3] 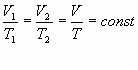 сформулируем определение. Определение: для газа данной массы отношение объема к температуре постоянно, если давление не изменяется. 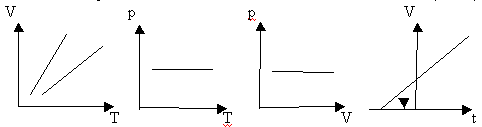 Рис. 2 Вывод: (самостоятельно по рисунку 2) изобара соответствующая более высокому давлению Изохорный процесс (процесс изменения состояния термодинамической системы при постоянном объеме). [1] сформулируем определение. Определение: при данной массе газа отношение давление газа к температуре постоянно, если объем газа не изменяется.- закон Шарля (1787г.) 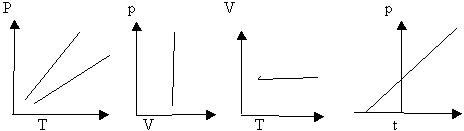 Вывод: изохора соответствующая большему объему Конспект в тетради: Закон Бойля-Мариотта (изотермический закон) Для газа данной массы произведение давления газа на его объем постоянно, если его температура газа не меняется.
Графики изотермы 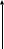 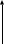 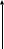 Р v T Р v T     Т T v Закон Гей-Люссака (1802 г) Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
Графики изобары Объем газа при температуре Объем газа при 0оС Температурный коэффициент объемного расширения Закон Шарля (1787 г.) Для газа данной массы отношение давления к температуре постоянна, если объем газа не меняется.
Давление газа при температуре Давление газа при 00С (273К) Температурный коэффициент давления газа Графики изохоры: Самостоятельная работа: В-1 1. Дать определение макроскопического тела 2. Дать определение количества вещества. Формула. Единицы измерения. 3. Оценка размеров молекул. 4. Определить массу одной молекулы кислорода О2. 5. Выразить массу молекулы воды Н2О в килограммах. 6. Определить относительную молекулярную массу и молярную массу меди (№29), циркония (№40), осмия (№76). 7. Какой объем занимают 100 моль ртути. 8. Сколько атомов содержится в гелии массой 250 г? В-2. 1. Основные положения молекулярно-кинетической теории. Примеры. 2. Определение теплового движения молекул. Определение тепловых явлений. Примеры тепловых явлений. 3. Сколько атомов содержится в гелии массой 250 г? 4. Какова масса 20 моль H2SO4 кислоты? 5. Определить относительную молекулярную и молярную массу золота, серебра, железа, лития. 6. Зная постоянную Авогадро, найти массу молекулы и атома водорода. 7. Найти число атомов в алюминиевом предмете массой 135 г. 8. Определить массу молекулы азота N2 В-3. 1. Определение постоянной Авогадро. Формула. Единицы измерения. 2. Определение молярной массы. Основные положения молекулярно-кинетической теории. Примеры. 3. Выразить массу молекулы воды Н2О в килограммах. 4. Определить относительную молекулярную массу и молярную массу натрия, водорода, углерода, калия. 5. Сравнить массы и объемы двух тел, сделанных соответственно из олова и свинца, если в них содержатся равные количества вещества. 6. Найти число атомов в алюминиевом предмете массой 135 г 7. Сколько атомов содержится в гелии массой 250 г? 8. Какова масса 20 моль H2SO4 кислоты? В-4. 1.Дать определение макроскопического тела. 2.Почему тепловые явления изучаются в молекулярной физике? 3.Найти относительную молекулярную и молярную массу углерода, SO2, H2O. 4.Выразить массу молекулы воды Н2О в килограммах 5.Во сколько раз масса одной молекулы углекислого газа СО2 больше массы молекулы аммиака NH3? 6. Какой объем занимают 100 моль ртути. 7. Сколько атомов содержится в гелии массой 250 г? 8. Сравнить число атомов, из которых состоят серебряная и алюминиевая ложка равного объема. Домашнее задание: Сообщение по теме: Тепловые двигатели и их применение Преподаватель _________________________________/Деревнина О.В./ |
