Где u внутренняя энергия системы
 Скачать 0.56 Mb. Скачать 0.56 Mb.
|
|
Задание №1. Процесс перехода из жидкого или газообразного состояния в твердое, в результате чего образуется кристаллическая решетка и возникают кристаллы, называется - кристаллизацией. Чем объясняется существование при одних температурах жидкого, а при других температурах твердого состояния и почему превращение происходит при строго определенных температурах? В природе все самопроизвольно протекающие превращения, а следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладает меньшим запасом энергии. При самопроизвольной кристаллизации кристаллы зарождаются самопроизвольно, вследствие стремления вещества к более устойчивому состоянию. Энергетическое состояние системы, имеющей огромное число охваченных тепловым движением частиц (атомов, молекул), характеризуется особой термодинамической функцией (F ), называемой свободной энергией, которая определяется: F= U – TS, где U – внутренняя энергия системы; Т - абсолютная температура; S - энтропия Можно сказать, что чем больше свободная энергия системы, тем система менее устойчива, и если имеется возможность, то система переходит в состояние, где свободная энергия меньше. С изменением внешних условий, например температуры, свободная энергия системы изменяется по сложному закону, но различно для жидкого и твердого состояний.  Изменение свободной энергии жидкого и кристаллического состояний в зависимости от температуры Выше температуры Тs меньшей свободной энергией обладает вещество в жидком состоянии, ниже Ts – вещество в твердом состоянии. Следовательно, выше Ts вещество должно находиться в жидком состоянии, а ниже Ts – в твердом, кристаллическом. Очевидно, что при температуре, равной Ts свободные энергии жидкого и твердого состояний равны, металл в обоих состояниях находится в равновесии. Эта температура Ts и есть равновесная или теоретическая температура кристаллизации. Однако, при Ts Fж = Fкр, и процесс кристаллизации (плавления) не может идти, так как при равенстве свободных энергий обеих фаз плавление (кристаллизация) не будут сопровождаться уменьшением свободной энергии. Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Их кривых видно, что это возможно только тогда, когда жидкость будет охлаждена ниже точки Ts. Температура, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации. Охлаждение жидкости ниже температуры кристаллизации называется переохлаждением. Обратное превращение из кристаллического состояния в жидкое может произойти только выше температуры Ts, это явление называется перенагреванием. Величиной или степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации T = Ts - Tф. Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура.  Кривые охлаждения, полученные при кристаллизации металла Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым охлаждением, так как при этом нет качественного изменения состояния. При достижении температур кристаллизации на кривой температура – время появляются горизонтальные площадки, так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации. Одним из способов снятия внутренних напряжений при деформации материалов является рекристаллизация. Рекристаллизация, т.е. образование новых зерен, протекает при более высоких температурах, чем возврат, может начаться с заметной скоростью после нагрева выше определенной температуры. Чем выше чистота металла, тем ниже температура рекристаллизации. Между температурами рекристаллизации и плавления существует связь: Трек = а * Тпл, где а – коэффициент, зависящий от чистоты металла. Для технически чистых металлов а = 0,3 – 0,4, для сплавов а = 0,8. Температура рекристаллизации имеет важное практическое значение. Чтобы восстановить структуру и свойства наклепанного металла (например, при необходимости продолжить обработку давлением путем прокатки, протяжки, волочения и т.п.), его надо нагреть выше температуры рекристаллизации. Такая обработка называется рекристаллизационным отжигом. Процесс рекристаллизации можно разделить на два этапа: первичную рекристаллизацию или рекристаллизацию обработки, когда вытянутые вследствие пластической деформации зерна превращаются в мелкие округлой формы беспорядочно ориентированные зерна; вторичную или собирательную рекристаллизацию, заключающуюся в росте зерен и протекающую при более высокой температуре. Первичная кристаллизация заключается в образовании новых зерен. Это обычно мелкие зерна, возникающие на поверхностях раздела крупных деформированных зерен. Хотя в процессе нагрева и происходят внутризеренные процессы устранения дефектов (возврат, отдых), все же они, как правило, полностью не заканчиваются, с другой стороны, вновь образовавшееся зерно уже свободно от дефектов. К концу первой стадии рекристаллизации можно получить структуру, состоящую только из очень мелких зерен, в поперечнике имеющих размер в несколько микрон. Но в этот момент наступает процесс вторичной кристаллизации, заключающийся в росте зерна. Возможны три существенно различных механизма роста зерна: зародышевый, состоящий в том, что после первичной кристаллизации вновь возникают зародышевые центры новых кристаллов, их рост приводит к образованию новых зерен, но их меньше, чем зерен в исходном состоянии, и поэтому после завершения процесса рекристаллизации зерна в среднем станут крупнее; миграционный, состоящий в перемещении границы зерна и увеличении его размеров. Крупные зерна растут за счет «поедания» мелких; слияние зерен, состоящее в постепенном «растворении» границ зерен и объединении многих мелких зерен в одно крупное. При этом образуется разнозернистая структура с низкими механическими свойствами. Реализация одного из основных механизмов роста зависит: от температуры. При низких температурах рост идет за счет слияния зерен, при высоких – за счет миграции границ зерен; от исходного состояния ( от степени деформации). При малой степени деформации (3-8%) первичная рекристаллизация затруднена, и рост зерна идет за счет слияния зерен. В конце процесса образуются гигантские зерна. При большой степени деформации (более 10 %) слияние зерен затрудняется, и рост идет за счет миграции границ зерен. Образуются более мелкие зерна. Таким образом, после отжига получается равновесная структура, изменяются механические свойства, снимается наклеп металла, повышается пластичность. ЗАДАНИЕ 2 Диаграмма Cu–Ag 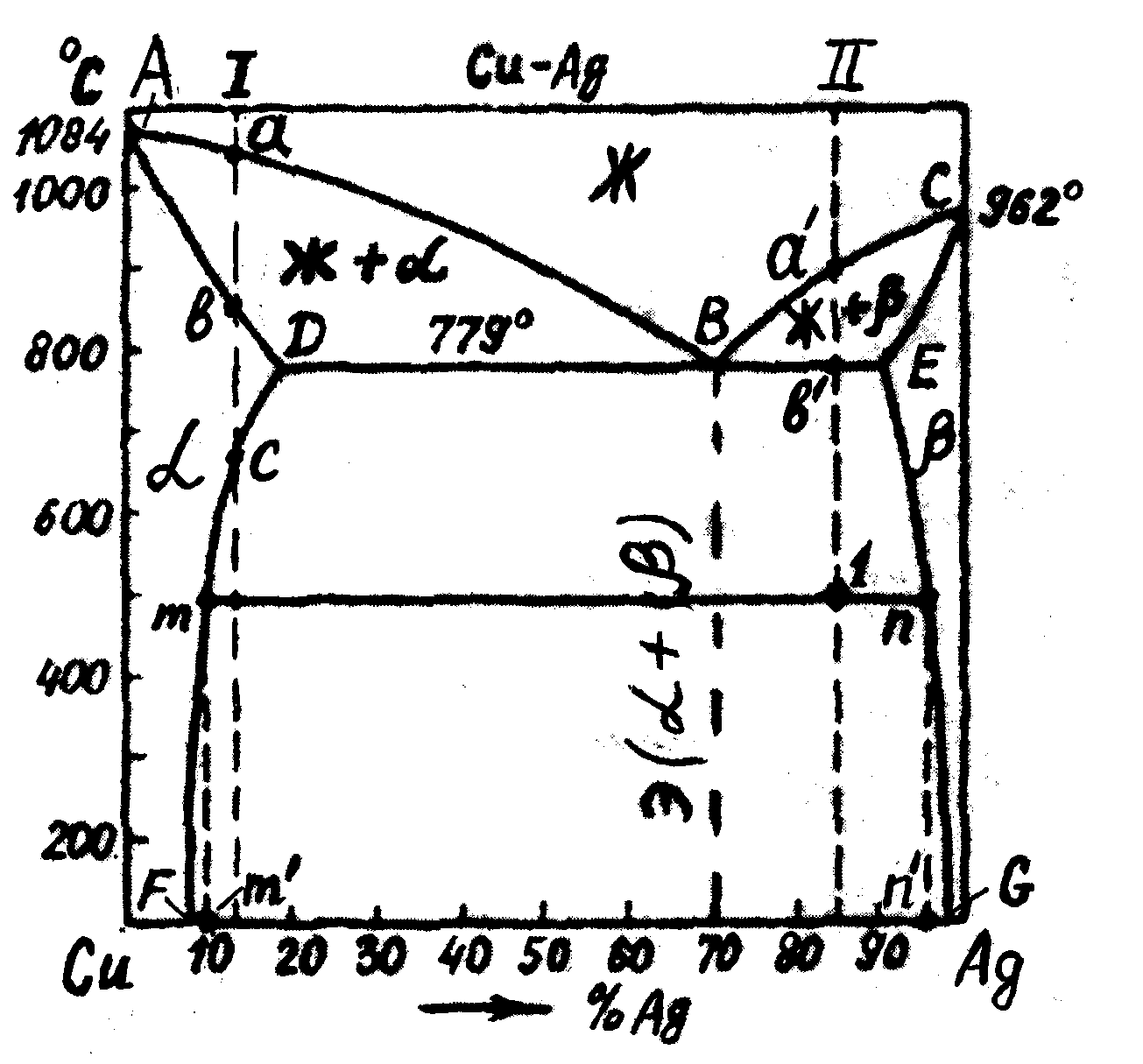 1. Компонентами данной системы являются химические элементы Cu и Ag. Из рисунка диаграммы следует, что в жидком состоянии (выше линии ликвидуса ABC) они неограниченно растворяются друг в друге, образуя фазу Ж (жидкий раствор). В твердом состоянии (ниже линии солидуса АDЕС) компоненты ограниченно растворяются друг в друге, образуя твердые растворы замещения: – твердый раствор на основе Сu, т.е. раствор Ag в Cu и – твердый раствор Cu в Ag. Причем взаимная растворимость компонентов повышается с увеличением температуры: Ag в Cu – по линии FD, Cu в Ag – по линии GE. Таким образом, в данной системе существуют следующие фазы: Ж – жидкий раствор Cu и Ag; – твердый раствор Ag в Cu; – твёрдый раствор Cu в Ag; Иных фаз в системе Cu–Ag нет. В других случаях возможно наличие таких твердых фаз, как химические элементы и химические соединения. 2. При ответе на этот вопрос следует надписать все имеющиеся на диаграмме линии и показать, какое превращение совершается на этих линиях при охлаждении и нагреве. Превращения по линиям: – линия АВ – начало кристаллизации фазы при охлаждении или конец её растворения в жидкости при нагреве; – линия ВС – начало кристаллизации фазы из жидкости при охлаждении или конец её растворения в жидкости при нагреве; – линия AD – конец кристаллизации фазы при охлаждении или начало её растворения в жидкости при нагреве; – линия СЕ – конец кристаллизации фазы при охлаждении или начало её растворения в жидкости при нагреве; – линия DBE – эвтектическое превращение: при охлаждении происходит затвердевание жидкости эвтектического состава (ЖВ) в смесь двух твердых фаз определенного состава (D и Е) – эвтектику: при нагреве происходит обратное превращение – смесь кристаллов двух фаз (эвтектика) одновременно расплавляясь, переходит в жидкую фазу; – линия DF – предельная растворимость Ag в Cu; видно, что максимально возможное содержание Ag в Cu (в твердом растворе) понижается с уменьшением температуры, поэтому при охлаждении ниже линии DF из -фазы выделяется избыток Ag в виде вторичных кристаллов (); при нагреве на этой линии заканчивается растворение кристаллов в -растворе; – линия EG аналогична DF (линия предельной растворимости Cu в Ag) начало выделения II из -фазы при охлаждении или конец растворения II в при нагреве. 3. При ответе на этот вопрос следует использовать ответ на вопрос 2. Рассмотрим превращения при охлаждении доэвтектического сплава I: в точке а на линии АВ из жидкости кристаллизуется фаза . Между линиями АВ и AD охлаждается смесь Ж+, причем количество фазы при охлаждении увеличивается. В точке b кристаллизация заканчивается, и ниже линии АD сплав состоит из одной фазы . В точке С на линии DF начинается выделение кристаллов II из фазы . Окончательная структура сплава +II, а фазовый состав сплава: +. Сплав II является заэвтектическим. При достижении точки а’ на линии BС начинается кристаллизация фазы из жидкости. Между линиями ВС и DВЕ охлаждается смесь Ж+. В точке b’ сплав состоит из жидкости состава точки В и фазы состава точки Е. При температуре, соответствующей линии DВЕ жидкость претерпевает эвтектическое превращение: ЖB→D+Е При охлаждении ниже линии DВЕ из фазы выделяются кристаллы II в соответствии с линией ограниченной растворимости ЕG, а из фазы , входящей в эвтектику, выделяются кристаллы IIв соответствии с линией DF. Окончательная структура сплава: +II + эвтектика (+) Кристаллы IIи II, выделяющиеся из фаз и , входящих в эвтектику, не различимы, т.к. они наслаиваются на кристаллы и . Фазовый состав сплава:+. Для определения химического состава фаз в двухфазной области следует через точку, выражающую состояние сплава, т.е. через точку 1, провести горизонтальную прямую (коноду) до пересечения с границами двухфазной области, в данном случае с линиями DF и ЕG и соответственно обозначить точки пересечения (например, m и n). Проекция точки m на ось концентрации – m’ соответствует составу фазы , в которой содержится 10% Ag и 90% Cu, а проекция точки n – n’ соответствует составу фазы в которой содержится 95% Ag и 5% Сu. Для определения весового соотношения фаз необходимо вспомнить правило отрезков: «количества фаз относятся как противоположные отрезки коноды». Таким образом, для сплава II, состояние которого задано точкой 1, весовое соотношение фаз Отсюда относительное количество фазы : Относительное количество фазы : 5. Это задание базируется на закономерностях, связывающих свойства сплавов с видом их диаграмм состояния (закономерности Н.С. Курнакова). Так, при образования твердых растворов зависимость свойств от химического состава сплавов в данной системе имеет криволинейный характер. В сплавах, состоящих из смеси двух различных фаз, свойства в зависимости от состава, меняются по линейному закону. Образование химического соединения приводит обычно к появлению экстремума на зависимостях состав–свойства. Хотя эти зависимости носят приближенный характер, они позволяют качественно прогнозировать свойства сплавов. В рассматриваемом примере (рис. 12) сплавы в интервале составов между точками F...G являются смесями кристаллов и , вне этого интервала – твердыми растворами ( или ), поэтому можно считать, что свойства сплавов примерно описываются закономерностями, показанными на рис. 12. Известно, что сплавы, содержащие в структуре эвтектику, обладают хорошими литейными свойствами. Поэтому сплавы из интервала точка D – точка Е могут быть отнесены по технологическим свойствам к группе литейных. Причем наилучшие литейные свойства имеют сплавы по составу близкие к эвтектическому (точка В). Твердые растворы (в отличие от химических соединений), как правило имеют высокую пластичность. Поэтому для обработки давлением лучше всего подходят сплавы с однофазной структурой твердого раствора (0...F) или (G...100). То есть по технологическим свойствам это деформируемые или обрабатываемые давлением сплавы. К ним могут быть причислены также сплавы, содержащие небольшое количество вторичных выделении, т.е. со структурой + II (F…D) и + II (Е...G).  Рисунок 12 Таким образом, знание диаграмм состояния дает возможность предусмотреть также технологию изготовления изделий из сплавов различного со- става. ЗAДАНИЕ 3 Процесс кристаллизации сплава I сталь У13:Заэвтектоидная сталь содержащая 13%С. Эвтектоидному превращению в этой стали предшествует выделение из аустенита вторичного цементита. до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1–2, начинает образовываться жидкость+аустенит. При достижении температуры соответствующей точке 2, сплав затвердевает и образуется аустенит. При достижении температуры, соответствующей точке 3, предшествует выделение из аустенита вторичного цементита. В результате при охлаждении до температуры точки 4 сталь испытывает эвтектоидное превращение. При медленном охлаждении вторичный цементит выделяется на границах аустенитных зерен. От точки 4` начинает образовываться цементит+перлит. Используемая литература: Материаловедение и технология металлов./ Под ред. П.Г. Фетисова – М.: Машиностроение, 2002. – 638 с. Богодухов С.И. Гребенок В.Ф., Синюхин А.В. Курс материаловедения в вопросах и ответах. – М.: Машиностроение, 2003. – 256 с. 1. Лахтин Ю.М., Леонтьева В.П., Материаловедение. – М.: Машиностроение, 1990. – 493 с. 2. Материаловедение. Под ред. Б.Н. Арзамасова – М.: Металлургия, 1986г. – 384 с. |
