Полимеразная цепная реакция. Генетика бактерий. Информация для второго занятия. Полимеразная цепная реакция
 Скачать 453.5 Kb. Скачать 453.5 Kb.
|
|
Генетика бактерий. Информация для второго занятия. Полимеразная цепная реакция Полимеразная цепная реакция – метод, позволяющий провести многократное увеличение (амплификацию) количества определенных молекул ДНК в анализируемом образце (в том числе в биологическом материале или чистой культуре). Главные преимущества ПЦР как диагностического метода в микробиологии – очень высокая чувствительность, позволяющая обнаружение крайне малых концентраций возбудителей в образцах, а такжерегулируемая специфичность, позволяющая обнаруживать или идентифицировать возбудителей на родовом, видовом или субвидовом уровне. Основной недостаток ПЦР вытекает из его крайне высокой чувствительности – образы очень легко загрязнить ДНК из положительного контроля, другого образца или продукта ПЦР, что приведет к ложноположительной реакции. Это накладывает жесткие ограничения на условия, в которых производится смешивание ПЦР и работа с готовыми продуктами ПЦР. Проведение ПЦР. Готовится реакционная смесь, содержащая следующие компоненты:
Затем данная реакционная смесь помещается в амплификатор, который фактически представляет собой программируемый термостат. В амплификаторе проводится 30-40 циклов смены температур. Каждый из этих циклов состоит из трех этапов (см. Рис. 1):
Детекция результатов отличается в различных вариантах постановки ПЦР и описана в разделе «Разновидности ПЦР». Динамика ПЦР На ранних циклах ПЦР количество двухцепочечных молекул ДНК, размер которых определяется расстоянием между местами посадки праймеров, удваивается с каждым циклом. Также образуется малое количество более длинных молекул ДНК, которым можно пренебречь (см. Рис 2). Таким образом, на ранних циклах количество продукта ПЦР описывается формулой m*2n, где m – исходное количество искомой ДНК в пробе, n – число циклов. Затем реакция выходит на плато. Это происходит из-за накопления продукта реакции, снижения концентрации праймеров и дезоксинуклеотидтрифосфатов, а также за счет повышения концентрации пирофосфата (см. Рис 3). Разновидности ПЦР Конвенциональная ПЦР В данном варианте постановки ПЦР реакция идет заранее выбранное число циклов (30-40), после чего анализируется, произошло ли накопление двуцепочечных молекул ДНК в реакционной смеси. Данный вариант постановки ПЦР при использовании в качестве способа диагностики является качественным методом. Положительная реакция свидетельствует о наличии хотя бы следовых количеств искомых молекул ДНК в образце. Отрицательная реакция свидетельствует об их отсутствии. Количественная оценка содержания исходных молекул ДНК в образце невозможна из-за выхода реакции на плато. Основным методом выявления наличия продукта является электрофорез в агарозном или полиакриламидном геле. Продукты ПЦР разделяются в геле под действием электрического поля в соответствии с их молекулярной массой. В гель добавляется интеркалирующий краситель (флуоресцирующий в связанном с двухцепочечной ДНК состоянии - чаще всего бромистый этидий). Таким образом, при облучении ультрафиолетом можно будет увидеть наличие или отсутствие полоски, соответствующей ДНК необходимой молекулярной массы. При проведении ПЦР в диагностических целях всегда ставятся положительный и отрицательный контроли реакции, с которыми сравниваются образцы (см. Рис. 4). ПЦР в реальном времени В данном варианте постановки ПЦР количество продукта ПЦР в реакционной смеси регистрируется постоянно в ходе протекания реакции. Это позволяет построить кривую протекания реакции (см. Рис. 3) и, исходя из неё, рассчитать количество искомых молекул ДНК в образцах. Один из видов проведения ПЦР в реальном времени – с использованием интеркалирующегокрасителя, который добавляется прямо в реакционную смесь (чаще всего используется SYBRGreen). Другой вид – с использованием одного из видов флуоресцирующих зондов, связывающихся с участком внутри ПЦР-продукта, что позволяет повысить специфичность обнаружения (см. Рис 5).Детекцияфлуоресценции происходит непосредственно в приборе в ходе протекания реакции. Помимо возможности количественного обнаружения, существуют и другие достоинства ПЦР в реальном времени по сравнению с конвенциональной. Данный вариант ПЦР более прост, быстр, а также не требует открывания пробирок с продуктами ПЦР, что уменьшает вероятность загрязнения других образцов. Основной недостаток – более высокая стоимость амплификатора со встроенной возможностью детекциифлуоресценции по сравнению с обычным. Цифровая количественная ПЦР Новый, дорогостоящий и пока малораспространенный вариант ПЦР, позволяющий более точно определять количество ДНК в образце.В данном варианте реакционная смесь, содержащая флуоресцентный краситель, разбивается на огромное число микроскопических объемов (например, капелек в эмульсии). После протекания ПЦР анализируется, в какой доле капелек реакция оказалась положительной и, соответственно, наблюдается флуоресценция. Эта доля будет пропорциональна числу искомых молекул ДНК в образце. ПЦР с обратной транскрипцией В данном случае перед тем или иным вариантом ПЦР производится реакция обратной транскрипции (РНК в ДНК) с использованием фермента ревертазы. Таким образом, этот метод позволяет проводить качественное или количественное обнаружение молекул РНК. Это может использоваться для детекции РНК-содержащих вирусов или определения уровня транскрипции (количества мРНК) того или иного гена. 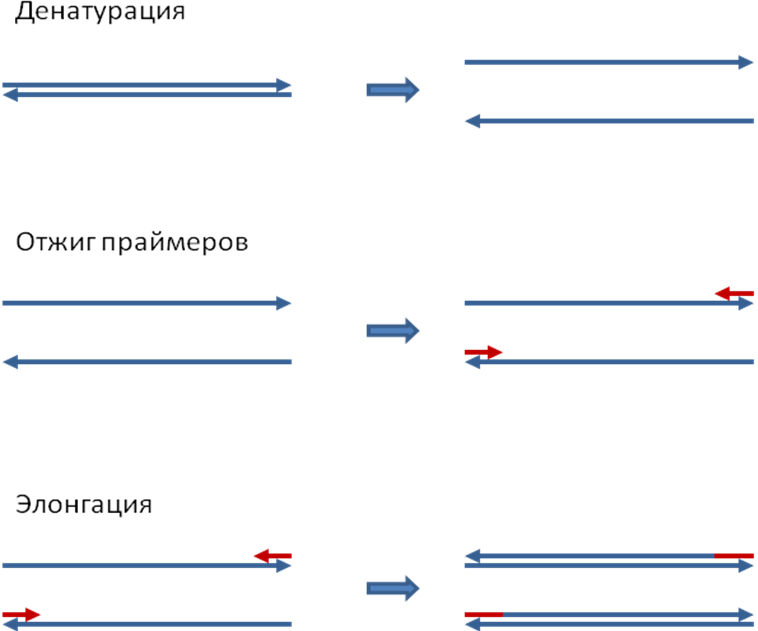 Рисунок 1. Этапы ПЦР. Красным цветом обозначены праймеры.  Рисунок 2.Накопление двуцепочечных молекул ДНК, ограниченных праймерами, в ходе ПЦР. 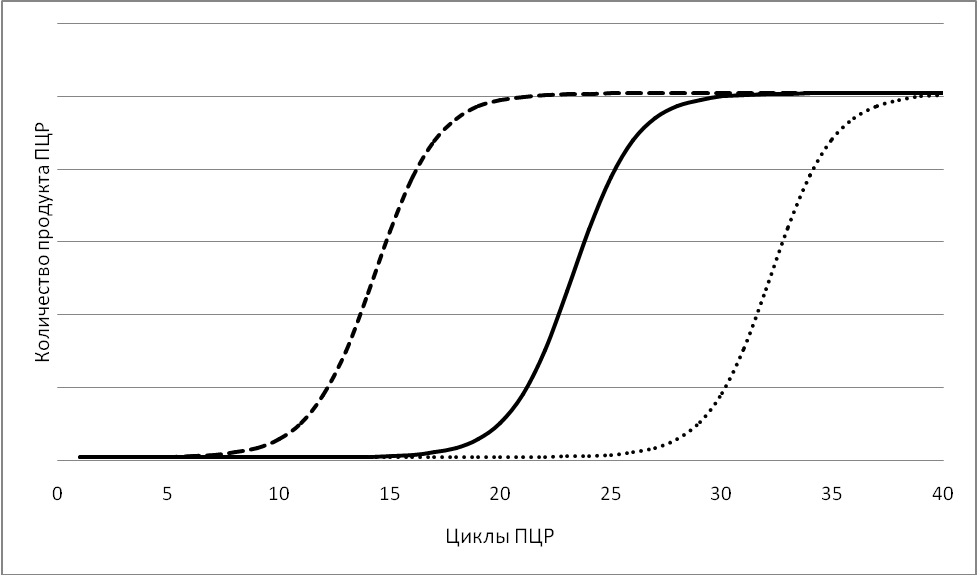 в б а Рисунок 3.Динамика реакции ПЦР при разных изначальных концентрациях искомых молекул ДНК в пробе. (а) – наибольшая концентрация (б) – промежуточная концентрация (в) – наименьшая концентрация K+ 1 2 3 4 5 6 7 K- 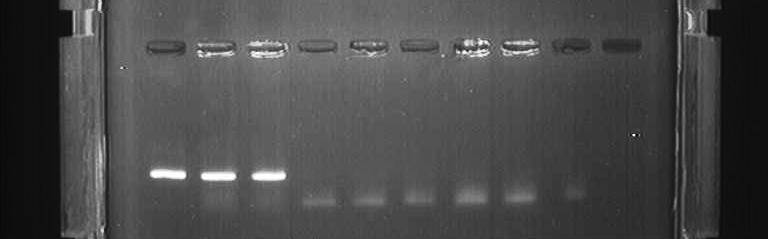 Рисунок 4.Агарозный электрофорез продуктов ПЦР. К+ – положительный контроль (заведомо присутствует искомая ДНК). 1-7 – исследуемые образцы (из них 1-2 – положительные, 3-7 – отрицательные). K- –отрицательный контроль (заведомо отсутствует искомая ДНК). Во многих случаях помимо целевого продукта видны более легкие неспецифические продукты реакции (праймер-димеры). 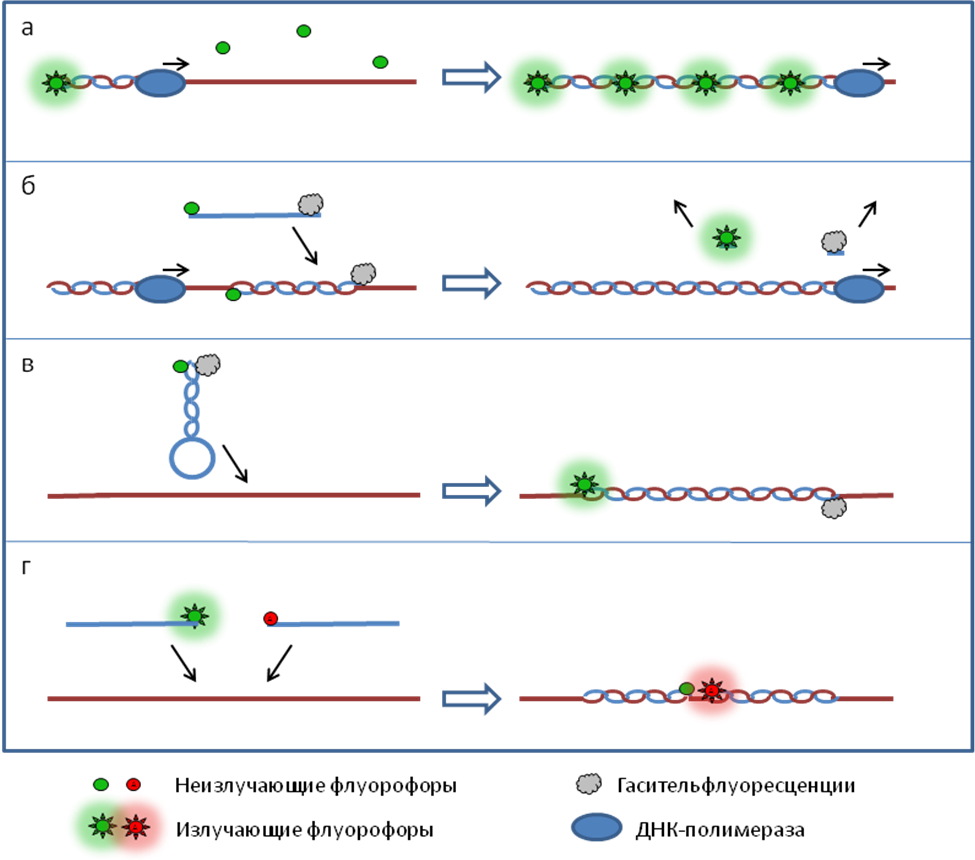 Рисунок 5. Способы детекции при использовании ПЦР в реальном времени. (а) – интеркалирующий краситель – флуоресцирует при связывании с двухцепочечной ДНК (б) – зонд Taqman – флуоресценция возникает при расщеплении зонда ДНК полимеразой с 5’-3’ эндонуклеазной активностью за счет разделения флуорофора и гасителя. (в) – зонд MolecularBeacon - флуоресценция возникает при гибридизации зонда с целевым фрагментом за счет пространственного отдаления флуорофора и гасителя (г) – зонды LightCycler - флуоресценция акцептора возникает при гибридизации зондов (содержащих акцептор и донор) с целевым фрагментом за счет резонансного переноса энергии флуоресценции (FRET). |
