лабораторная 2. Гидролиз солей
 Скачать 0.57 Mb. Скачать 0.57 Mb.
|
|
Лабораторная работа «Гидролиз солей» Цель работы. Изучить реакцию среды в растворах различных солей. Теоретическая часть. Гидролизом называют обменные химические реакции, протекающие с участием воды. Если в обменную реакцию с водой вступает соль, то взаимодействие называют гидролизом солей. Реакция гидролиза соли обратима. Признаком гидролиза соли является изменение нейтральной реакции среды водного раствора. Например, при растворении в воде нитрита калия KNO2 образуется избыток ионов ОН- и раствор подщелачивается или При растворении в воде CuCl2 образуется избыток ионов Н+ и раствор подкисляется или При взаимодействии с водой многозарядных ионов гидролиз обычно идет до образования основного или кислого иона (первая ступень гидролиза). Cтепень гидролиза (h) – отношение концентраций гидролизованных ионов (С) к их исходной концентрации в растворе (С0): h = C/C0. Константа равновесия реакции гидролиза называется константой гидролиза соли. Ее величина характеризует соотношение между равновесными концентрациями всех компонентов системы. Например, константа гидролиза по первой ступени для выше приведенной реакции: 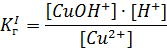 Оборудование и реактивы. 1. Пробирки. 2. Стеклянная палочка. 3. Микрошпатель. 4. Индикаторная универсальная бумага. 5. Кристаллические соли: карбонат натрия (Na2CO3), хлорид алюминия AlCl3, ацетат натрия NaCH3COO, сульфит натрия Na2SO3, хлорид натрия NaCl. 6. Дистиллированная вода. Порядок выполнения работы. Опыт 1. В пробирку с дистиллированной водой опускаем полоску индикаторной бумаги. По шкале рН определяем значение рН дистиллированной воды. Опыт 2. Проводим реакцию гидролиза карбоната натрия. Для этого вносим 1 микрошпатель кристаллов Na2CO3 в пробирку с дистиллированной водой. Перемешиваем раствор с помощью стеклянной палочки. Опускаем в приготовленный раствор полоску индикаторной бумаги и по шкале определите рН этого раствора. Практическая часть: Результаты опыта:
Молекулярные и ионные уравнения реакций гидролиза солей. 1.Na2CO3- соль сильного основания, протекает по аниону. Молекулярное уравнение: Na2CO3 + HOH ↔NaHCO3 + NaOH Полное ионное уравнение: 2Na+ + CO32- + HOH↔ Na+ + HCO3- +Na+ OH- Краткое ионное уравнение: CO32- + HOH↔ HCO3- + OH Выражение константы гидролиза: Кг = К (Н2О ) / К (Н2 СО3 ) 2.NaCH3COO – реакция по аниону Молекулярное уравнение: NaCH3COO + HOH↔ CH3COOH + NaOH Полное ионное уравнение: CH3COO- +Na+ + HOH↔ CH3COOH + Na+ + OH- Краткое ионное уравнение: CH3COO- + HOH↔ CH3COOH + OH- Выражение константы гидролиза: Кг= К (Н2О) / К (CH3COOH ) 3.AlCl3- соль слабого основания, гидролиз протекает по катиону Молекулярное уравнение: AlCl3+ HOH↔AlOHCl2 +HCl Полное ионное уравнение: Al3+ + 3Cl- + HOH↔AlOH2++ 2Cl- + H+ + Cl- Краткое ионное уравнение: Al3+ + HOH↔AlOH2+ + H+ Выражение константы гидролиза: Кг = Кс (НОН) =(AlOH2+)∙(H+)/ (Al3+). 4.KCl – гидролизу не подвергается, т.к. в составе нет «слабого иона» КСl↔ K++ Cl- Ответы на контрольные вопросы. 1. Имеются растворы солей KCl, NaCl, CuCl2, AlCl3. В каких растворах концентрация иона Н+ равна концентрации ОН-? Ответ поясните. 2. Вычислите рН 0,001 М раствора Na2S (при расчете учитывайте только первую ступень гидролиза). 1.Концентрацию Н и ОН можно определить, зная, как соль относится к гидролизу, нам надо получить нейтральную среду, следовательно, нейтральная среда будет там, где соль не подвергается гидролиза. KCl соль, образованная сильным основанием и сильной кислотой, подходит. NaCl соль образованная сильным основанием и сильной кислотой, подходит. CuCl2 соль, образованная слабым основанием и сильной кислотой, не подходит. AlCl3 соль, образованная слабым основанием и сильной кислотой, не подходит. 2. Дано: Соль: Na2S, C = 0.1M Найти: рН ? Решение: S²⁻ + 2H2O = 2OH⁻ + H2S K(гидр) = [OH⁻]²[H2S] / [S²⁻][H2O]² , домножим и разделим на H⁺ , получим: [OH⁻]²[H2S][H⁺]² / [S²⁻][H2O][H⁺] ⇒ K(гидр) = K²(H2O) / Kα₁₂(H2S) = 10^(-28)/2.5*10^(-20) = 0.4*10^(-8) [OH⁻] = √(К(гидр)*C) = √(0.4*10^(-8)*0.1) = 0.2*10^(-4) pOH = -lg[OH⁻] = -lg(0.2*10^(-4)) = 4.7 pH = 14 - pOH = 14 - 4.7 = 9.3 Ответ : Рн = 9,3. Вывод: В ходе лабораторной работы были изучены реакции среды в растворах различных солей, решены контрольные задачи, а так же молекулярные и ионные уравнения.  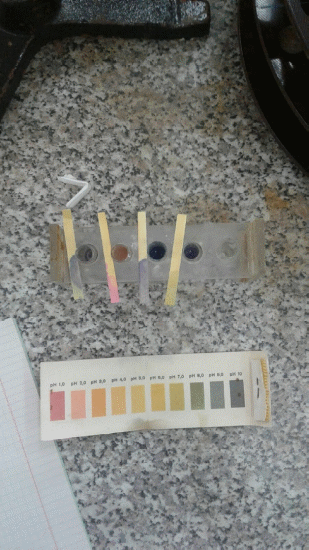 |
