патофиз. гипоксия в развитии некробиотической гибели клетки
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
Федеральное государственное бюджетное образовательное учреждение высшего образования «Оренбургский государственный медицинский университет Минздрава России» Кафедра патологической физиологии Реферат Тема: «ГИПОКСИЯ В РАЗВИТИИ НЕКРОБИОТИЧЕСКОЙ ГИБЕЛИ КЛЕТКИ» Выполнил: Студент 212 группы Лечебного факультета 2 курса Потапов Д.Г. Проверила: Ассистент кафедры патофизиологии Михайлюк К.Е. г. Оренбург, 2022 г План Введение………………………………………………………….…………………….………3 Основные нарушения метаболизма при гипоксии…………….…………………….……….4 Нарушение электролитного баланса клеток………………….…………………….………...5 Патогенетические последствия избытка Са2+ в цитоплазме.…………………….……….....7 Финальная стадия гибели клеток при гипоксии……….………………………….……….…8 Заключение….…………………………………………………………………………………9 Список литературы………………………………………………………………………….10 Введение Понятие «гипоксия» определяется как патологический процесс, причиной возникновения которого является недостаточное снабжение тканей организма кислородом или нарушение утилизации и усвоения этого газа в ходе осуществления процессов биологического окисления. Гипоксия является одним из важнейших компонентов патогенеза большинства существующих и изученных заболеваний. Для адекватного энергообеспечения процессов жизнедеятельности клетки является необходимостью соответствие эффективности биологического окисления уровню функциональной активности для каждой структуры организма. Именно подобное несоответствие лежит в основе развития патологических процессов. В нормальных условиях состояние полного соответствия биологического окисления потребностям организма обеспечивается совместной координированной деятельностью многочисленных структур и механизмов, которые призваны обеспечить синтез и транспорт необходимого количества веществ, являющихся субстратами для биологического окисления, а также кислорода к месту их конечного использования, кроме того, эти механизмы отвечают и за эффективную и своевременную утилизацию этих субстратов и удаление конечного продукта окисления, которым является двуокись углерода. Нарушение в силу каких-либо причин действия этих механизмов и приводит к возникновению гипоксии. Для изучения нарушений, к которым приводит имеющая место в организме гипоксия, используется экспериментальный метод исследования. Например, при работе с изолированными культурами клеток или тканей создаются условия аноксии, то есть отсутствия кислорода в среде исследования, что, как правило, приводит к остановке процессов биологического окисления. Однако воссоздание аноксии в целостном живом организме не является возможным. Итак, гипоксия – это состояние, способное привести клетку к гибели. Неправильное функционирование механизмов биологического окисления, заключающееся в недостатке кислорода, вызывает ряд метаболических нарушений внутри самих клеток, которые будут описаны далее. Целью данного исследования является изучение механизмов гибели клетки вследствие гипоксии. На пути к достижению цели выполняются следующие задачи: - изучить основные метаболические нарушения при гипоксии; - выявить сущность нарушений электролитного баланса; - рассмотреть обстоятельства и течение финальной гибели клетки вследствие гипоксии. Основные нарушения метаболизма при гипоксии Гипоксией является то нарушение, главной мишенью действия которой служит такой органоид как митохондрии. Одним из нарушаемых показателей при гипоксии является напряжение кислорода в клетке. При недостатке кислорода его напряжение заметно снижается, становится ниже критического уровня. Это влечет за собой остановку действия ферментов в дыхательной цепи, а также разобщение процессов окислительного фосфорилирования, приводящие к синтезу активных форм кислорода и недостатку АТФ, являющейся основным источником энергии для клетки. Такое состояние называется гипоэнергетическим. В подобных условиях запускается действие компенсаторных механизмов: активируется гликолиз, ранее находящийся под репрессирующим влиянием АТФ. Теперь стимуляция гликолиза осуществляется за счет продуктов распада молекулы АТФ (АДФ, АМФ). Однако гликолитический процесс не способен устранить дефицит АТФ, а также он является достаточно непродолжительным. Недолгое течение гликолиза обусловлено снижением кислотности среды внутри клетки вследствие накопления лактата. Изменение рН в кислую сторону является ингибирующим фактором для действия фосфофруктокиназы – центрального фермента гликолиза. Снижение эффективности действия этого фермента приводит к падению скорости гликолитического процесса, а впоследствии и к его полной остановке. Интересным фактом является то, что незрелые клетки (например, в эмбриональных тканях) характеризуются наличием изоформ фосфофруктокиназы, они, в свою очередь, более устойчивым к изменениям кислотности. Это лежит в основе менее активной их ответной реакции на гипоксию, что обеспечиваем большую жизнеспособность детей относительно взрослых при состояниях острого недостатка кислорода. Сразу за повышением эффективности гликолиза следует его угнетение, сопровождающееся ингибированием иных метаболических путей. В основе подобных нарушений лежит процесс накопления в митохондриях кофакторов НАДН, ФАДН, являющихся восстановленными, это объясняется невозможностью их перехода в окисленную форму (НАД, ФАД) в связи с бездействием электронов в дыхательной цепи. Торможение процессов в цикле Кребса, процесса β-оксиления жирных кислот влечет за собой снижение количества окисленных форм перечисленных выше кофакторов. Это связано с ингибированием действия митохондриальных дегидрогеназ, являющихся ключевыми ферментами в этих процессах. В конечном итоге происходит накопление ацетил-КоА и жирных кислот. Этот этап, именуемый «стадией ингбирования основных метаболических путей» является обратимым (Рис. 1). 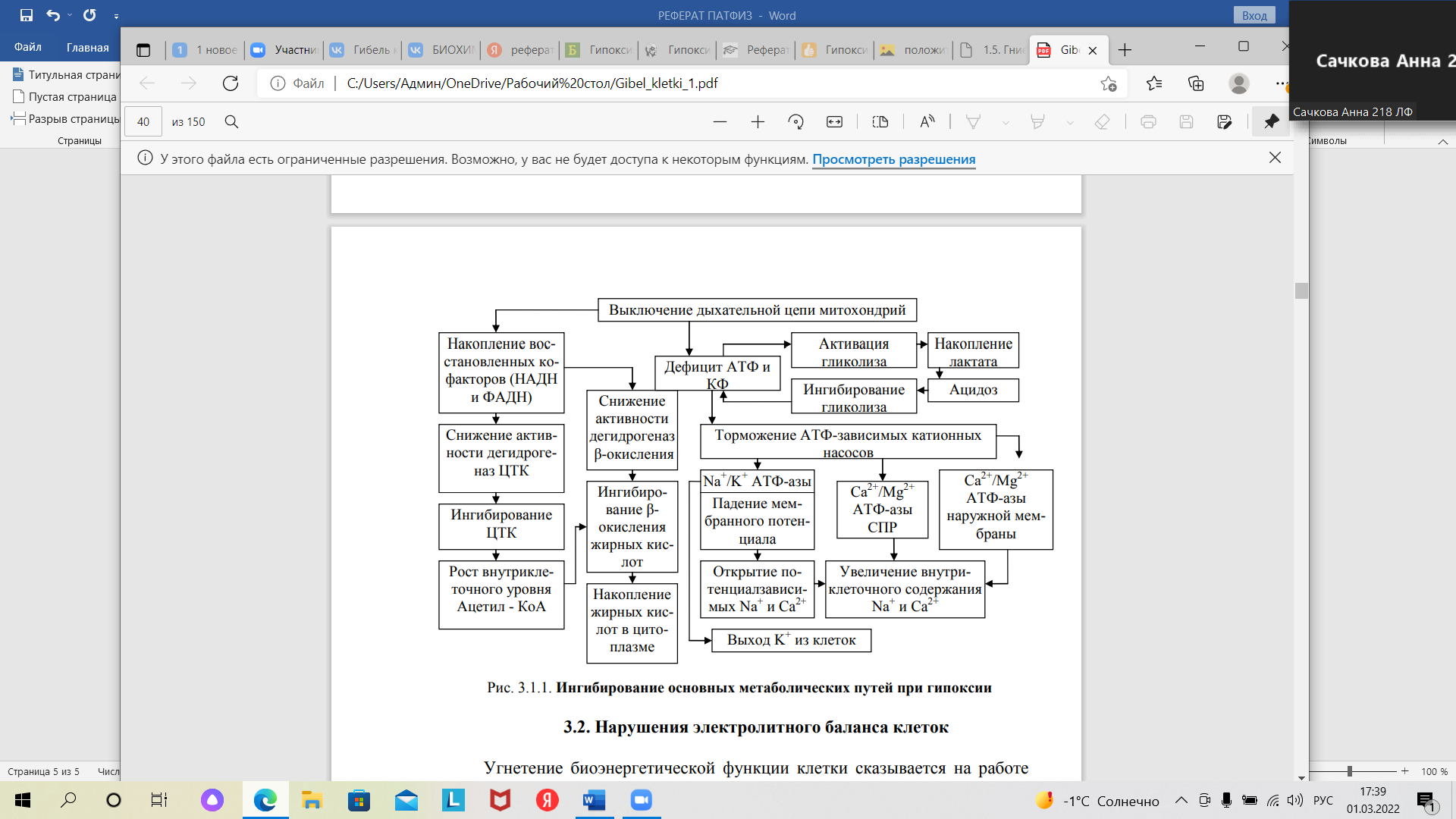 Рис. 1. Ингибирование основных метаболических путей при гипоксии. Нарушение электролитного баланса клеток Снижение скорости биоэнергетических процессов влияет на работу энергозависимых систем клетки, к ним относятся: 3Na+/2К+ АТФ-азы наружной мембраны клетки, Ca2+/Mg2+ эндоплазматической сети и наружной мембраны. В результате нарушения активности 3Na+/2К+ АТФ-азы снижается градиент концентрации ионов по обеим сторонами от мембраны, что усиливает транспорт ионов К+ из клетки в окружающую ее внеклеточную среду. Это влечет за собой падение мембранного потенциала покоя. Из этого вытекает ряд последствий: Деполяризация, т.е. снижение мембранного потенциала покоя приводит к открытию потенциалзависимых Na+ и Ca2+ каналов мембран; Следующий за открытием каналов приток ионов Na+ и Ca2+ внутрь клетки из межклеточного пространства; Увеличение концентрации ионов калия во внеклеточном пространстве достигается путем выхода этих ионов из клеток, подвергшихся действию гипоксии. Этот процесс способствует падению калиевого градиента относительно мембраны. В результате ток ионов калия снижается, потенциал покоя падает, появляется возможность создания потенциала действия в возбудимых тканях. Примером служит фибрилляция при ишемии миокарда. Долгая деполяризация мембраны служит механизмом торможения. На уровне нейронов такое торможение при глубокой гипоксии мозга приводит к коме с полной потерей сознания и утратой рефлекторной деятельности. Именно вследствие механизмов действия гипоксии комы различных видов и происхождения имеют схожие проявления. На фоне этих процессов наблюдаются нарушения баланса ионов натрия и калия на уровне клетки в виде повышения их концентрации в цитоплазме. При нормальных условиях подобный баланс поддерживается процессами поступления и сопряженного с ним выведения этих ионов из клетки (рис. 2), а также перераспределением ионов кальция в хранилища внутри клетки, в качестве которых выступает саркоплазматический ретикулум. 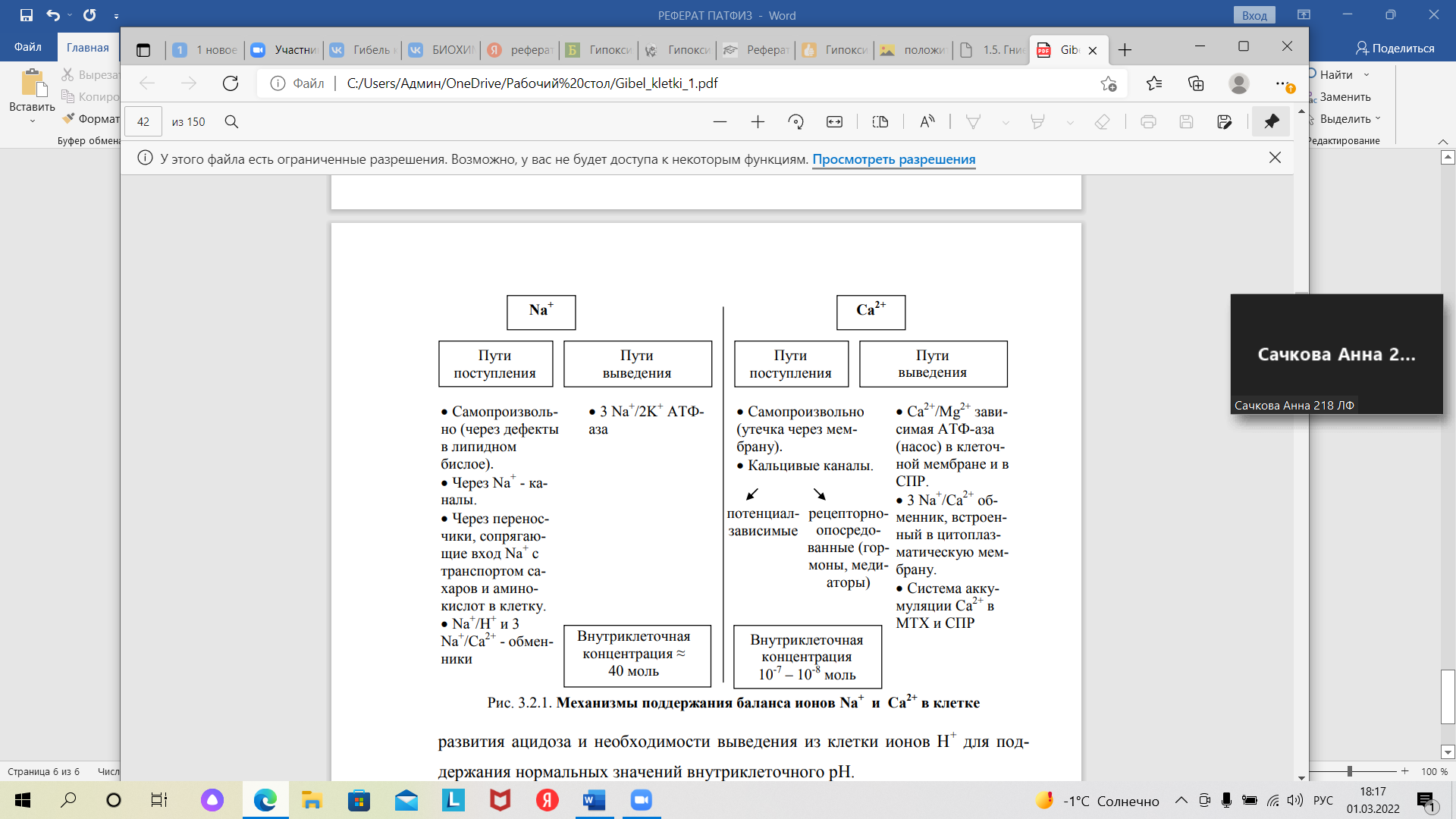 Рис. 2. Механизмы поддержания баланса ионов Na+ и Ca2+ в клетке. Рост внутриклеточной концентрации Na+ при недостатке кислорода и АТФ определяется не только падением активности 3Na+/2К+ АТФ-азы, являющейся насосом для выведения ионов натрия из клетки, а также активирование его поступления в клетку в связи с открытием потенциалзависимых каналов. К тому же, активации подвергается Na+/Н+-обменник вследствие развития ацидоза и острой нужды клетки в выведении ионов Н+ для установления нормального уровня кислотности. Также клетки из-за переизбытка ионов натрия подвергается чрезмерному поступлению в нее воды. Возникает гипергидратация клетки, ее набухание. Мембрана растягивается, и мембраносвязанные белки, располагающиеся в ней, становятся менее активными, проницаемость клетки повышается. Аналогичные процессы характерны и для транспорта калия через мембрану. Патогенетические последствия избытка Са2+ в цитоплазме Ионы кальция являются вторичными мессенджерами, которые осуществляют функции клетки путем взаимодействия с белками, например, с кальмодулинами, которые активируют ряд цитозольных ферментов после взаимодействия с Ca+. Особая роль в регуляторных механнизмах отводится кальпаинам, представляющих из себя одну из систем протеолиза в клетке. Они осуществляют протеолитическое расщепление рецепторных белков, белков цитоскелета, циклинов при митозе. Образующиеся в результате этого процесса биологически активные пептиды также способны осуществлять регуляторную функцию. Однако подобные процессы имеют место быть лишь при умеренном повышении содержания кальция в клетке, потому как дальнейшее его накопление выше 10-6 приводит к токсическому действию и повреждению структур клетки. Именно поэтому выраженный избыток кальция является одним из ключевых механизмов гибели клетки при гипоксии. Повреждающее действие избытка кальция реализуется с помощью липидной триады, к которой относятся: активация липаз и фосфолипаз, детергентное действие избытка жирных кислот и лизофосфатидов, активация перекисного окисления липидов. Активация липаз и фосфолипаз приводит к усилению распада липидов и фосфолипидов одновременно с невозможностью полной утилизации продуктов их распада. Этот процесс приводит к нарушению структуры мембран, особая роль при этом отводится фосфолипазе А2, которая является ведущим ферментом в механизме гипоксического повреждения. Образованные в результате действия фосфолипаз лизофосфолипиды и жирные кислоты оказывают на мембраны детергентное действие (уменьшают их поверхностное натяжение), нарушая при этом порядок расположения фосфолипидов в них. Это влечет за собой больший приток ионов кальция, по итогу которого порочный круг повреждения мембран замыкается. Накопление активных форм кислорода приводит к активации перекисного окисления липидов (ПОЛ). Роль ПОЛ в развитии гипоксического повреждения клетки контролируется дефицитом кислорода. Таким образом, в процессе развития повреждения клетки из-за гипоксии ключевым звеном является дезорганизация липидного слоя биологических мембран, которая осуществляется путем запуска липидной триады при увеличении концентрации кальция. Также существенным аспектом является механическое повреждение мембран, то есть их растяжение. Финальная стадия гибели клеток при гипоксии Финальные повреждения при гипоксии связаны с нарушением в структуре органоидов и цитоскелета, что приводит непосредственно к гибели. Механизм, лежащий в основе этих повреждений, тесно связан с накоплением ионов кальция. Ca+2-зависимая активация кальпаинов приводит к разрушению цитоскелета. Деструкция белков цитоплазмы вызывает изменение структуры клеток, что является причиной нарушения их взаимодействия с микроокружением и восприятия сигналов. Недостаточная эффективность действия структур цитоскелета приводит к нарушению взаимодействия компонентов надмолекулярных комплексах клетки. К примеру, рибосомы отсоединяются от мембраны щероховатой эндоплазматической сети, в результате чего происходит пресыщение цитоплазмы клетки молекулами белка, которые впоследствии будут подвергнуты деградации. Накопление ионов кальция, кроме того, активирует сократительную функцию миофибрилл с одновременной утратой ими способности к расслаблению. Это вызывает механические повреждения сократительного аппарата клетки. Накопление внутри клетки жирных кислот при условии избытка ионов кальция и натрия приводит к образования солей высших жирных кислот, именуемых мылом. Такой процесс называют омылением. Он резко увеличивает детергентную активность цитозоля, которая растворяет липидные мембраны. При этом на клетку обрушивается удар гидролаз и активных радикалов, которые до этого были изолированы в различных частях клетки. Подобный эндогенный эффект играет решающую роль в финальной стадии гибели клетки. Заключение Гибель клеток при гипоксии – закономерно следующие друг за другом события, включающие нарушение путей метаболизма, электролитный дисбаланс, активацию липидной триады и последующее необратимое повреждение внутриклеточных структур. Центральным звеном патогенеза является повышение внутриклеточной концентрации ионов Ca+, а основной мишенью – клеточные мембраны и митохондрии. Последовательность изменений при гипоксии одинакова для самых разных тканей. Об этом свидетельствуют опыты со срезами изолированных клеток и изолированных органов. Разница лишь в скорости этих процессов, эта скорость различна для разных тканей и с наибольшей быстротой эти процессы протекают в мозговой ткани, с изменениями в печени, с еще меньшей скоростью в мышечной ткани. Список литературы Фролов Б.А., Панфилова Т.В., Железнова А.Д. ГИБЕЛЬ КЛЕТКИ// Международный журнал экспериментального образования. – 2015. Патологическая физиология: учебник для студентов медвузов / под ред. член-корр. РАМН П. Ф. Литвицкого. – В 2 т. – М.: ГЭОТАР-Медиа, 2005. – Гл. 4. Гибель клетки. Апоптоз. Некроз. – С. 119-126. Патофизиология: учебник / под ред. акад. РАМН О. И. Уразовой. – М.: ГЭОТАР-Медиа, 2010. – Гл. 3.6. Повреждение клеток при гипоксии. – С. 189-194. Общая патологическая физиология: учебник для студентов медвузов / под ред. В. А. Фролова и Д. П. Билибина. – М.: Издательский дом «Высшее образование и наука», 2012. – Гл. 3. Некроз и апоптоз. – С. 74-91. Лушников, Е. Ф. Гибель клетки (Апоптоз) / Е. Ф. Лушников, А. Ю. Абросимов. – М.: Медицина, 2001. – 192 с. Интегральные механизмы гибели и повреждения клеток // Основы общей патологии: учеб. пособие / А. Ш. Зайчик, Л. П. Чурилов. – СПб.: ЭЛБИ – СПб, 1999. – Гл. 9. – С. 174-196. |
