Главный комплекс гистосовместимости. главный комплекс гистосовместимости и его основные функциии
 Скачать 232 Kb. Скачать 232 Kb.
|
Содержание Главный комплекс гистосовместимости………………………………………...3 Строение главного комплекса гистосовместимости……………………………6 Молекулы главного комплекса гистосовместимости…………………………..8 Функции Главного комплекса гистосовместимости…………………………..14 Антигены MHC: история исследований………………………………………16Список использованной литературы…………………………………………...18 Главный комплекс гистосовместимости. Главный комплекс гистосовместимости – это группа генов и кодируемых ими антигенов клеточной поверхности, которые играют важнейшую роль в распознавании чужеродного и развитии иммунного ответа.Антигены, обеспечивающие внутривидовые различия особей, обозначаются как аллоантигены, а когда они включаются в процесс отторжения аллогенных тканевых трансплантатов, то приобретают название антигенов тканевой совместимости (гистосовместимости). Эволюция закрепила единичный участок тесно сцепленных генов гистосовместимости, продукты которых на поверхности клеток обеспечивают сильный барьер при аллотрансплантации. Термины «major histocompatibility antigens» (главные антигены гистосовместимости) и «major histocompatibility gene complex» (MHC) (главный генный комплекс гистосовместимости) относятся соответственно к продуктам генов и генам этого хромосомного участка. Многочисленные минорные антигены гистосовместимости, наоборот, кодируются множественными участками генома. Им соответствуют более слабые аллоантигенные различия молекул, выполняющих разнообразные функции.Открытие MHC произошло при исследовании вопросов внутривидовой пересадки тканей. Затем, первоначально в гипотетической, на основании клеточной феноменологии, а затем в экспериментально хорошо документированной форме с использованием методов молекулярной биологии было установлено, что Т-клеточный рецептор распознает не собственно чужеродный антиген , а его комплекс с молекулами, контролируемыми генами главного комплекса гистосовместимости . При этом и молекула MHC и фрагмент антигена контактируют с Т - клеточным рецептором. MHC кодирует два набора высокополиморфных клеточных белков, названных молекулами MHC класса I и класса II. Молекулы класса I способны связывать пептиды из 8-9 аминокислотных остатков, молекулы класса II - несколько более длинные. Высокий полиморфизм молекул MHC, а также способность каждой антигенпрезентирующей клетки (АПК) экспрессировать несколько разных молекул MHC обеспечивают возможность презентации T-клеткам множества самых различных антигенных пептидов. Следует отметить, что хотя молекулы MHC и называются обычно антигенами, они проявляют антигенность только в том случае, когда распознаются иммунной системой не собственного, а генетически иного организма, например, при аллотрансплантации органов. Наличие в МНС генов, большинство из которых кодирует иммунологически значимые полипептиды, заставляет думать, что этот комплекс эволюционно возник и развивался специально для осуществления иммунных форм защиты. Существуют еще и молекулы MHC класса III , но молекулы MHC класса I и молекулы MHC класса II являются наиболее важными в иммунологическом смысле. Главный комплекс гистосовместимости характеризуется крайне выраженным полиморфизмом. Ни одна другая генетическая система организма не имеет такого количества аллельных форм как гены МНС . Долгое время биологический смысл столь выраженного полиморфизма оставался непонятным, хотя какое-то селективное значение такой аллельной изменчивости было очевидным. Впоследствии было доказано, что подобный полиморфизм прямо связан с процессом презентации антигенных детерминант Т-клеткам . С полиморфизмом антигенов МНС связано такое явление, как генетический контроль иммунного ответа. В тех случаях, когда аминокислотные остатки, образующие антигенсвязывающую щель у молекул II класса , не в состоянии связать пептидный фрагмент чужеродного антигена, T-хелперы остаются ареактивными, и их помощь В-клеткам не реализуется. Это обстоятельство и является причиной генетически детерминированного дефекта в иммунном реагировании. Основные события, которые привели к формированию разнообразия генов МНС в процессе эволюции связаны с тандемными дупликациями, точечными мутациями, рекомбинациями и конверсией генетического материала. Тандемные дупликации (процесс повторения исходного гена на той же самой хромосоме) хорошо известны для многих генетических систем, контролирующих синтез белков, например, иммуноглобулинов . Именно в результате этого процесса возникло несколько полигенных форм молекул MHC. Спонтанные замены отдельных нуклеотидов в процессе редупликации ДНК (точечные мутации) также хорошо известны, они приводят к формированию аллельных генов, которые также определяют полиморфизм белков. Рекомбинации между отдельными участками гомологичных хромосом в процессе мейоза могут привести к обмену как целых участков этих хромосом, так и отдельных генов и даже частей генов. В последнем случае процесс называется генной конверсией . Мутации, рекомбинации и конверсия генов создают многообразие их аллельных форм и определяют полиморфизм антигенов МНС. Такая высокая степень полиморфизма имеет потенциальную ценность для выживания вида, и именно благодаря ей весь вид не становится жертвой мимикрии микробов, при которой они экспрессируют структуры, близкие по конформации к продуктам MHC . T-клетки , способные распознать неповторимую индивидуальную комбинацию специфичностей собственного организма, оказываются в состоянии реагировать на продукты такой мимикрии, как на чужеродные. Кроме того, возможно, что столь высокий сбалансированный полиморфизм продуктов MHC обеспечивает более широкое разнообразие антигенов, распознаваемых иммунной системой данного вида, а также гетерозиса (гибридной силы), поскольку у гетерозигот возникает максимальная комбинаторика аллелей. Братья и сестры имеют один шанс из четырех быть идентичными по антигенам MHC. Строение главного комплекса гистосовместимости. Методом хромосомной гибридизации установлено, что система МНС локализуется на коротком плече 6 аутосомной хромосомы человека, а у мышей – на 17 хромосоме. Р 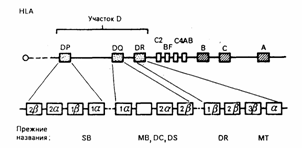 ис. 1. Схематическое изображение хромосомы 6. Главный комплекс гистосовместимости занимает значительный участок ДНК, включающий до 4*106 пар оснований или около 50 генов. Основной особенностью комплекса является значительная полигенность (наличие нескольких неаллельных близкосцепленных генов, белковые продукты которых сходны в структурном отношении и выполняют идентичные функции) и ярковыраженный полиморфизм - присутствие многих аллельных форм одного и того же гена. Все гены комплекса наследуются по кодоминантному типу. Полигенность и полиморфизм (структурная вариабельность) определяют антигенную индивидуальность особей данного вида. Все гены MHC делятся на три группы. Каждая группа включает гены, контролирующие синтез полипептидов одного из трех классов MHC (I, II и III) ( рис. 3.5 ). Между молекулами первых двух классов имеются выраженные структурные различия, но при этом по общему плану строения все они однотипны. В то же время между продуктами генов класса III, с одной стороны, и классов I и II, с другой стороны, не найдено никакого функционального или структурного сходства. Группа из более чем 20 генов класса III вообще функционально обособлена - некоторые из этих генов кодируют, например, белки системы комплемента ( C4 , C2 , фактор B ) или молекулы, участвующие в процессинге антигена . Область локализации генов, кодирующих комплекс молекул MHC мыши, обозначается как H-2 , для человека - HLA . HLA-A , HLA-B и HLA-С - локусы хромосомы, гены которых контролируют синтез "классических" молекул (антигенов) I класса MHC человека и кодируют тяжелую цепь (альфа-цепь). Область этих локусов занимает участок длиной более 1500 т.п.н. Синтез молекул (антигенов) II класса MHC человека контролируют гены области HLA-D , которые кодируют не менее шести вариантов альфа- и десяти вариантов бета-цепей ( рис.3.5 ). Эти гены занимают три локуса HLA-DP , HLA-DQ и HLA-DR . К продуктам их экспрессии относится большинство молекул II класса. Кроме того, к области HLA-D относятся гены HLA-LMP и HLA-TAP . Низкомолекулярные белки, контролируемые этими генами, принимают участие в подготовке чужеродного антигена к презентации Т-клеткам. Гены локусов человека HLA-A , HLA-B и HLA-С кодируют тяжелую цепь (альфа-цепь) "классических" молекул I класса MHC. Кроме того, найдены многочисленные дополнительные гены вне этих локусов, кодирующие "неклассические" молекулы MHC класса I и расположенные в таких локусах HLA , как HLA-X HLA-F, HLA-E, HLA-J, HLA-H, HLA-G, HLA-F. Молекулы главного комплекса гистосовместимости. Методами рентгеноструктурного анализа выяснена пространственная организация молекул MHC: 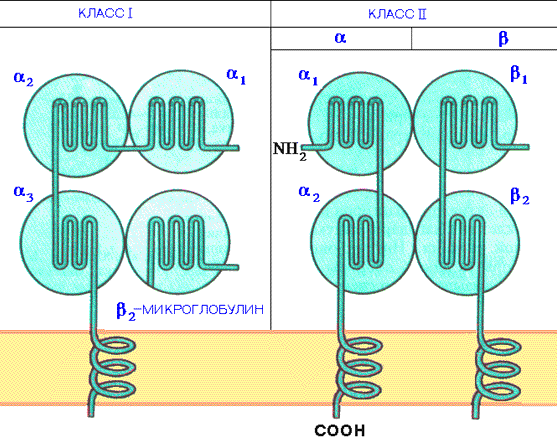 Молекулы MHC класса I (аллельные варианты HLA : HLA-A , HLA-B , HLA-С ) экспрессируются на клеточной поверхности и представляют собой гетеродимер, состоящий из одной тяжелой альфа-цепи (45 кДа), нековалентно связанной с однодоменным бета2-микроглобулином (12 кДа), который встречается также в свободной форме в сыворотке крови их называют классическими трансплатационными антигенами . Тяжелая цепь состоит из внеклеточной части (образующей три домена : альфа1-, альфа2- и альфа3-домены), трансмембранного сегмента и цитоплазматического хвостового домена. Каждый внеклеточный домен содержит примерно 90 аминокислотных остатков, и все их вместе можно отделить от клеточной поверхности путем обработки папаином. В альфа2- и альфа3-доменах имеется по одной внутрицепочечной дисульфидной связи, замыкающей в петлю 63 и 68 аминокислотных остатков, соответственно. Домен альфа3 гомологичен по аминокислотной последовательности C-доменам иммуноглобулинов , и конформация альфа3-домена напоминает складчатую структуру доменов иммуноглобулинов . Бета2-микроглобулин (бета2-m) необходим для экспрессии всех молекул MHC класса I и имеет неизменную последовательность, но у мыши встречается в двух формах, различающихся заменой одной аминокислоты в позиции 85. По структуре этот белок соответствует C-домену иммуноглобулинов . Бета2-микроглобулин способен также нековалентно взаимодействовать с неклассическими молекулами класса I , например, с продуктами генов CD1 . В зависимости от вида и гаплотипа внеклеточная часть тяжелых цепей MHC класса I в разной степени гликозилирована. Трансмембранный сегмент MHC I класса состоит из 25 преимущественно гидрофобных аминокислотных остатков и пронизывает липидный бислой, вероятнее всего, в альфа-спиральной конформации. Основное свойство молекул I класса - связывание пептидов (антигенов) и представление их в иммуногенной форме для Т-клеток - зависит от доменов альфа1 и альфа2. Эти домены имеют значительные альфа- спиральные участки, которые при взаимодействии между собой образуют удлиненную полость (щель), служащую местом связывания процессированного антигена . Образовавшийся комплекс антигена с альфа1- и альфа2-доменами и определяет его иммуногенность и возможность взаимодействовать с антигенраспознающими рецепторами Т-клеток . К классу I относятся антигены A , антигены AB и антигены AC . Антигены класса I присутствуют на поверхности всех ядросодержащих клеток и тромбоцитов. Молекулы MHC класса II являются гетеродимерами, построенными из нековалентно сцепленных тяжелой альфа- и легкой бета-цепей. Ряд фактов указывает на близкое сходство альфа- и бета-цепей по общему строению. Внеклеточная часть каждой из цепей свернута в два домена (альфа1, альфа2 и бета1, бета2, соответственно) и соединена коротким пептидом с трансмембранным сегментом (длиной примерно 30 аминокислотных остатков). Трансмембранный сегмент переходит в цитоплазматический домен, содержащий примерно 10-15 остатков. Антигенсвязывающая область молекул MHC класса II формируется альфа-спиральными участками взаимодействующих цепей подобно молекулам I класса , но при одном существенном отличии: антигенсвязывающая полость молекул MHC класса II формируется не двумя доменами одной альфа-цепи, а двумя доменами разных цепей - доменами альфа1 и бета1. Общее структурное сходство между двумя классами молекул MHC очевидно. Это - однотипность пространственной организации всей молекулы, количество доменов (четыре), конформационное строение антигенсвязывающего участка. В структуре молекул II класса антигенсвязывающая полость открыта больше, чем у молекул I класса, поэтому в ней могут поместиться более длинные пептиды. Важнейшая функция антигенов MHC (HLA) класса II - обеспечение взаимодействия между Т-лимфоцитами и макрофагами в процессе иммунного ответа. Т-хелперы распознают чужеродный антиген лишь после его переработки макрофагами , соединения с антигенами HLA класса II и появления этого комплекса на поверхности макрофага. Антигены класса II присутствуют на поверхности В-лимфоцитов , активированных Т-лимфоцитов , моноцитов , макрофагов и дендритных клеток. Гены MHC класса II кодируют связанные с мембраной трансмембранные пептиды (гликопротеины). Молекулы антигенов гистосовместимости класса II ( DR , DP , DQ ) также как и класса I являются гетеродимерными белками, состоящими из тяжелой альфа-цепи (33 кДа) и легкой бета-цепи (26 кДа), кодируемые генами HLA -комплекса. Обе цепи формируют по два домена: альфа1 и альфа2, а также бета1 и бета2. Продукты MHC класса II ассоциированы, главным образом, с B- лимфоцитами и макрофагами и служат распознаваемыми структурами для T- хелперов. Гены MHC класса III, расположенные в пределах группы генов MHC или тесно сцепленные с ней, контролируют некоторые компоненты комплемента : C4 и C2 , а также фактор B , находящиеся скорее в плазме крови, чем на поверхности клеток. И в отличие от молекул MHC классаI и класса II не не участвуют в контроле иммунного ответа. Термин MHC класса IV употребляется для описания некоторых локусов, сцепленных с MHC. Изучение экспрессии молекул I и II классов MHC на различных типах клеток выявило более широкое тканевое распространение молекул I класса в сравнении с молекулами II класса. Если молекулы I класса экспрессируются практически на всех изученных клетках, то молекулы II класса экспрессируются, в основном, на иммунокомпетентных клетках или клетках, принимающих относительно неспецифическое участие в формировании иммунного ответа, таких, как клетки эпителия. В табл. 1 представлены данные о характере тканевого распределения молекул МНС у мышей и человека. табл. 1 Тканевое распределение молекул I и II классов МНС у мышей и человека
Представительство молекул I класса почти на всех типах клеток коррелирует с доминирующей ролью этих молекул в отторжении аллогенного трансплантата. Молекулы II класса менее активны в процессе тканевого отторжения. Сравнительные данные о степени участия молекул I и II классов MHC в некоторых иммунных реакциях демонстрируют, что некоторые свойства МНС в большей степени связаны с одним из классов, тогда как другие являются характерной особенностью обоих классов(табл. 2) Табл. 2 Участие молекул I и II классов МНС в некоторых иммунных реакциях
Функции Главного комплекса гистосовместимости. Хотя молекулы MHC первоначально идентифицировали по их способности вызывать отторжение трансплантата, они выполняют в организме и другие биологически важные функции. Во-первых, они принимают непосредственное участие в инициации иммунного ответа, контролируя молекулы, представляющие антиген в иммуногенной форме для его распознавания цитотоксическими T-клетками и хелперными T-клетками. Во-вторых, в МНС локализованы гены, контролирующие синтез иммунорегуляторных и эффекторных молекул - цитокинов ФНО-альфа , ФНО-бета , а также некоторых компонентов комплемента . Следует отметить их роль в качестве поверхностных клеточных маркеров, распознаваемых цитотоксическими T- лимфоцитами и T-хелперами в комплексе с антигеном . Молекулы, кодируемые комплексом Tla (область части генов MHC), вовлечены в процессы дифференцировки , особенно у эмбриона , а возможно, и в плаценте. MHC принимает участие в самых разных неиммунологических процессах, многие из которых опосредованы гормонами , например, регуляция массы тела у мышей или яйценоскости кур. Молекулы MHC класса I могут входить в состав гормональных рецепторов. Так, связывание инсулина заметно снижается, если с поверхности клетки удалить антигены MHC класса I, но не класса II. Кроме того, описаны случаи ассоциации продуктов MHC с рецепторами глюкагона , эпидермального фактора роста и гамма-эндорфина . На рис. 3 представлены функции продуктов MHC, а основные иммунологические свойства, связанные с MHC, перечислены в табл. 3 . рис. 3 im MHC: функции 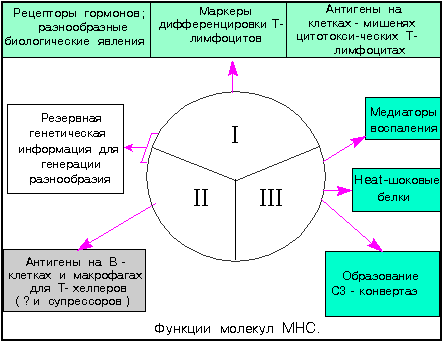 Табл. 3 Иммунологические свойства, связанные с MHC
Приведенные факты заставляют думать, что MHC эволюционно возник и развивался специально для осуществления иммунологических функций. Особое место занимает вопрос о связи молекул MHC с заболеваниями. При некоторых формах неинфекционных заболеваний частота отдельных антигенов среди больных значительно выше, чем в популяции здоровых людей. Четких механизмов подобной корреляции установить не удается. Однако ясно, что при разных формах заболевания механизмы скорее всего различны. С помощью HLA-типирования удалось подтвердить общность некоторых расстройств или по-новому подойти к вопросу их классификации. Сделан важный вывод, что в организме имеются различные группы антигенов МНС ассоциируемых с заболеваниями. Одни из них связаны с резистентностью или, наоборот, с восприимчивостью, а также со сроками возникновения болезней, другие с остротой их течения и, наконец, третьи – с продолжительностью жизни больных. В настоящее время стало очевидно, что продукты MHC класса II имеют решающее значение в патогенезе аутоиммунных заболеваний . В связи с этим неизбежно возникло стремление связать аутоиммунные заболевания с генами иммунореактивности, контролирующими ответ на соответствующий аутоантиген или на какой-либо вероятный этиологический агент. Антигены MHC: история исследований.В истории изучения антигенов гистосовместимости наиболее существенными являются следующие этапы: 1958 г. - открыт первый антиген гистосовместимости человека Mac (HLA-A2, Дж.Дассэ); 1966 г. - доказана ведущая роль HLA антигенов в развитии реакции отторжения трансплантата (Дж. ван Рууд и др.); 1972 г. - установлена корреляция между аллельными вариантами HLA антигенов и определенными заболеваниями (З.Фалчук и др.); 1973 г. - установлена структура HLA антигенов класса I (К.Накамура и др.); 1974 г. - показана роль антигенов гистосовместимости в ограничении иммунного ответа (двойное распознавание, Р.Цинкернагель, П.Доэрти); 1981 г. - осуществлено выделение и определение аминокислотной последовательности антигенов HLA класса II (Г.Кратцин и др.); 1983 г. - продемонстрирован биохимический полиморфизм HLA антигенов (Р.Василов и др.); 1987 г. - определена пространственная структура HLA-A2 антигена (П.Бeркман и др.); 1991-1993 г. - установлен характер распределения HLA антигенов в большинстве этнических групп планеты Список использованной литературы. Иммунология, под ред. Е. С. Воронина, М.: Колос –Пресс, 2002 Я. Кольман, К.- Г. Рем, Наглядная биохимия, М.: Мир 2000 Сочнев А.М. ,Алексеев Л.П. ,Тананов А.Т. Антигены системы HLA при различных заболеваниях и трансплантации. – Рига, 1987 www.humbio.ru www.rusmedserver.ru/med/haris/60.html | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
