Гидролиз солей. Гобпоу коньколодезский аграрный техникум гидролиз солей
 Скачать 251.27 Kb. Скачать 251.27 Kb.
|
|
ГОБПОУ «КОНЬ-КОЛОДЕЗСКИЙ АГРАРНЫЙ ТЕХНИКУМ» ГИДРОЛИЗ СОЛЕЙ Согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греч. hydro — вода, lysis — разложение, распад). Гидролиз — это реакция обменного разложения веществ водой. Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды. Реакции гидролиза могут протекать обратимо и необратимо. Обратимый и необратимый гидролиз Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом. Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей. Например, полному гидролизу подвергается сульфид алюминия: Al2S3+ 6H2O= 2AL(OH)3↓ + 3H2S↑ Необратимый гидролиз имеет место и в органической химии. Например, полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен: CaC2+ 2H2O= Ca(OH)2+ C2H2↑ Гидролиз органических веществ 1. Гидролиз галогеналканов используют для получения спиртов. 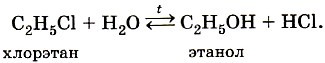 Присутствие щелочи (ОН-) позволяет связать получающуюся кислоту и сместить равновесие в сторону образования спирта. 2. Гидролиз сложных эфиров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты: 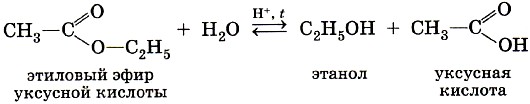 Для смещения химического равновесия в сторону продуктов реакции гидролиз проводят в присутствии щелочи. Исторически первым примером такой реакции было щелочное расщепление сложных эфиров высших жирных кислот, что привело к получению мыла. Это произошло в 1811 г., когда французский ученый Э. Шеврёль, нагревая жиры с водой в щелочной среде, получил глицерин и мыла — соли высших карбоновых кислот. На основании этого эксперимента был установлен состав жиров, они оказались сложными эфирами, но только «трижды сложными», производными трехатомного спирта глицерина — триглицеридами. А процесс гидролиза сложных эфиров в щелочной среде до сих пор называют омылением. Например, омыление эфира, образованного глицерином, пальмитиновой и стеариновой кислотами: 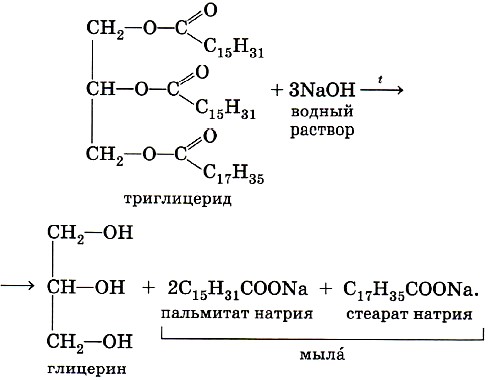 Натриевые соли высших карбоновых кислот — основные компоненты твердого мыла, калиевые соли — жидкого мыла. Французский химик М. Бертло в 1854 г. впервые синтезировал жир. Следовательно, гидролиз жиров (как и других сложных эфиров) протекает обратимо. Уравнение реакции можно упрощенно записать так: 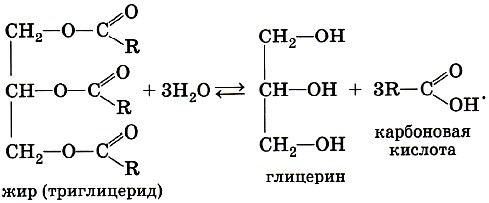 В живых организмах происходит ферментативный гидролиз жиров. В кишечнике под влиянием фермента липазы жиры пищи гидролизуются на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые, свойственные ему жиры. Они по лимфатической системе поступают в кровь, а затем в жировую ткань. Отсюда жиры поступают в другие органы и ткани организма, где в процессе обмена веществ в клетках опять гидролизуются и затем постепенно окисляются до оксида углерода и воды с выделением энергии, необходимой для жизнедеятельности. 3. Углеводы являются важнейшими компонентами нашей пищи. Причем дисахариды (сахароза, лактоза, мальтоза) и полисахариды (крахмал, гликоген) непосредственно не усваиваются организмом. Они, так же, как и жиры, сначала подвергаются гидролизу. Гидролиз дисахаридов, например, сахарозы, можно представить следующим уравнением: Гидролиз крахмала идет ступенчато, схематически его можно изобразить так: 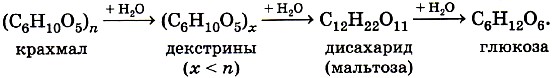 Превращение углеводов в живых организмах – схема 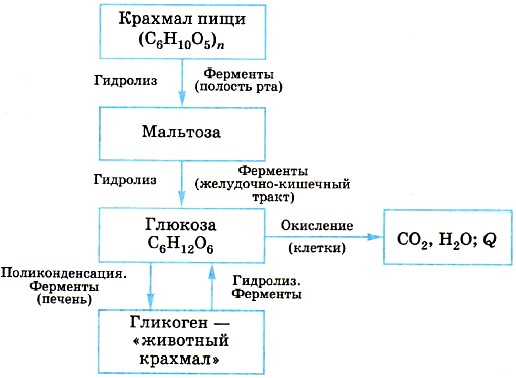 или более кратко: В лабораторных и промышленных условиях в качестве катализатора этих процессов используют кислоту. Реакции осуществляют при нагревании. Реакцию гидролиза крахмала до глюкозы при каталитическом действии серной кислоты осуществил в 1811 г. русский ученый К. С. Кирхгоф. В организме человека и животных гидролиз углеводов происходит под действием ферментов. Промышленным гидролизом крахмала получают глюкозу и патоку (смесь декстринов, мальтозы и глюкозы). Патоку применяют в кондитерском деле. Декстрины как продукт частичного гидролиза крахмала обладают клеящим действием: с ними связано появление корочки на хлебе и жареном картофеле, а также образование плотной пленки на накрахмаленном белье под действием горячего утюга. Еще один известный полисахарид — целлюлоза. Целлюлоза также может гидролизоваться до глюкозы при длительном нагревании с минеральными кислотами. Процесс идет ступенчато, но кратко его можно записать так: 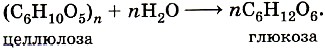 Этот процесс лежит в основе многих гидролизных производств. Они служат для получения пищевых, кормовых и технических продуктов из непищевого растительного сырья — отходов лесозаготовок, деревообработки (опилки, стружка, щепа), переработки сельскохозяйственных культур (соломы, шелухи семян, кочерыжек кукурузы и т. д.). Техническими продуктами таких производств являются глицерин, этиленгликоль, органические кислоты, кормовые дрожжи, этиловый спирт, сорбит (шестиатомный спирт). 4. Белки – это биополимеры, они основа жизни всех живых организмов (от вируса до человека) и состоят главным образом из аминокислот. Установление последовательности расположения остатков аминокислот, составляющих молекулу белка, является первоначальной целью при исследовании его структуры. И установить ее помогает ступенчатый гидролиз белка, который осуществляют при нагревании с кислотами или щелочами, а также при действии ферментов. Так как все белки являются полипептидами, то полный гидролиз, например, трипептида можно представить так: 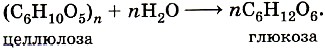 Можно представить себе и обратный процесс — процесс образования трипептида из аминокислот: 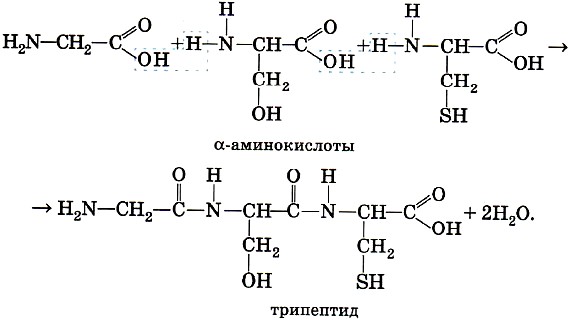 Процесс образования полипептида относится к реакциям поликонденсации. Аналогичные реакции гидролиза и поликонденсации осуществляются и в организме. Превращение белков в живых организмах - схема 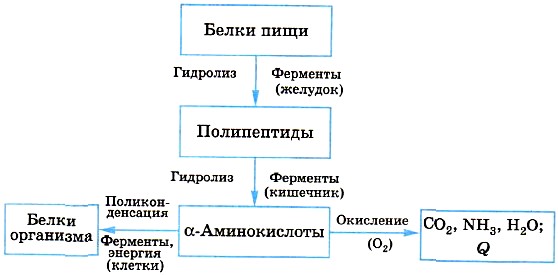 Известна обширная группа ферментов (гидролаз), катализирующих гидролиз молекул природных соединений. На таких процессах основано большинство методов изучения строения биополимеров. 5. Неизмеримо важную роль в организме играет процесс гидролиза аденозинтрифосфорной кислоты (АТФ). Это вещество служит источником энергии для всевозможных биохимических реакций (построения белка, сокращения мышц и др.). При гидролизе АТФ до адено-зиндифосфорной кислоты (АДФ) энергия высвобождается: Обратный процесс образования АТФ из АДФ протекает с поглощением энергии. Следовательно, АТФ — это универсальное энергетическое вещество клетки, своего рода энергетический запас, который клетка использует по мере надобности. Водные растворы солей имеют разные значения ph и различные типы сред: кислотную (рН < 7), щелочную (рН > 7), нейтральную (рН - 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу. Виды гидролиза В составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза. Соль с сильным основанием и сильной кислотой Гидролиз отсутствует. При наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д. Среда водного раствора — нейтральная, т. е. pH = 7. Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным). Соль со слабым основанием и сильной кислотой Гидролиз по катиону. Гидролизация происходит только при наличии слабого иона, в данном случае — иона гидроксида. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH−. В итоге образуется раствор с избытком ионов водорода H+. Среда водного раствора — кислая, pH меньше 7. Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют. Пример: Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4+ связывает ионы воды OH−. Соль с сильным основанием и слабой кислотой Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H+ в молекуле воды. В итоге получается раствор с повышенным содержанием OH−. Среда водного раствора — щелочная, pH больше 7. Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет. Пример: Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2− связывает ионы воды H+. Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH−, а анион кислоты связывает ионы H+ Среда водного раствора: нейтральная. Реакция индикаторов: могут не изменить свой цвет. Пример: Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN. Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN Ступенчатый гидролиз Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз. Определение количества ступеней: если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты; если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания. Например, гидролиз карбоната калия K2CO3. Есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени. I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3). II ступень: KHCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3). Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
|
