Роль гормонов вилочковой железы. вилка. Гормоны вилочковой железы, их физиологическая роль
 Скачать 55.54 Kb. Скачать 55.54 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Биологический факультет Кафедра чего-то там Курсовая работа на тему: «Гормоны вилочковой железы, их физиологическая роль» Выполнил: студентка 3 курса Группы 3-Б Биологического факультета Сякаев Р. С. Проверил: проф., д.х.н. Вакулин И. В. Уфа-2021 Содержание: Введение. Гистология вилочковой железы Гормоны вилочковой железы Тимозины Тимулин Тимусный гуморальный фактор Тимопоэтин Заключение Литература Введение. Тимус – лимфоэпителиальный орган лимфопоэза человека и многих видов животных, в котором происходит созревание, дифференцировка и иммунологическое «обучение» Т-клеток иммунной системы. Тимус контролирует развитие и распределение лимфоцитов, участвующих в иммунологических реакциях. Эта функция осуществляется либо путем насыщения лимфоидной ткани лимфоцитами, либо за счет выработки гормонов, стимулирующих развитие этих клеток крови, необходимых для обеспечения защитных иммунологических реакций. Изучение деятельности тимуса и вырабатываемых им гормонов представляет интерес, так как они напрямую влияют на иммунитет, и их применение, а также их аналогов, может помочь в лечении многих болезней, а также в иммуномодулировании. Гистология вилочковой железы. Тимус расположен в грудной полости в области переднего средостения. Снаружи покрыт соединительнотканной капсулой, которая проходит внутрь железы перегородками и разделяет её на доли (у большинства млекопитающих 2–3) мелкие дольки. В каждой дольке различают корковое и мозговое вещество. Корковое вещество представлено эпителиальной тканью сетчатого строения. В нём происходит процесс дифференцировки стволовых кроветворных клеток в Т-лимфоциты. Корковое вещество содержит клетки: эпителиального происхождения: - опорные клетки: формируют «каркас» ткани, образуют гемато-тимусный барьер; - звездчатые клетки: секретируют растворимые тимические (или тимусные) гормоны; - клетки-«няньки»: имеют инвагинации, в которых развиваются лимфоциты; 2) гематопоэтические клетки: - лимфоидного ряда: созревающие T-лимфоциты; - макрофагального ряда: типичные макрофаги, дендритные и интердигитирующие клетки. Непосредственно под капсулой в клеточном составе преобладают делящиеся Т-лимфобласты. Глубже находятся созревающие Т-лимфоциты, постепенно мигрирующие к мозговому веществу. В мозговом веществе лимфоцитов меньше, в основном содержатся дозревающие Т-лимфоциты. Отсюда они мигрируют в кровоток венул с высоким эндотелием и расселяются по организму. Предполагается также наличие здесь зрелых рециркулирующих Т-лимфоцитов. В средней его части расположены слоистые эпителиальные тельца (тельца Гассаля) – наиболее характерные структуры Т., образованные концентрически расположенными клетками эпителия [1]. Гормоны вилочковой железы. Вилочковая железа образует несколько гормонов: тимозины, тимопоэтин, тимулин и тимусный гуморальный фактор. Все они являются полипептидами. Гормоны тимуса регулируют выработку защитных клеток крови – лимфоцитов. Они созревают и дифференцируются в зависимости от их будущих функций под влиянием веществ, секретируемых вилочковой железой. Это позволяет формировать иммунный ответ. По сути именно от работы тимуса зависит способность организма противостоять инфекциям и токсинам. Остановимся на каждом гормоне подробнее. Тимозины. Тимозины представляют группу из 20 пептидов с молекулярной массой от 1 тыс. до 14 тыс., которые в зависимости от их изоэлектрических точек делят на α, β и γ тимозины. Шесть из них - α1, α7, β3, β4, β8, β9 -проявляют наибольшую активность. Почти для всех тимозинов, кроме α7 (молекулярная масса около 2200) и β3 (молекулярная масса около 5500), известна первичная структура. 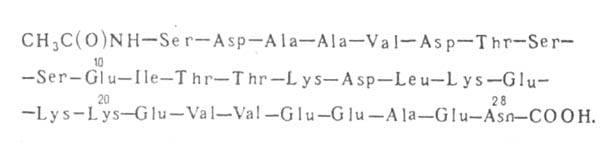 Рис.1. Первичная структура тимозина-α1 Тимозин α1 (Tα1), природный пептид тимуса, впервые описанный и охарактеризованный Алланом Голдштейном в 1972 году, влияет на адаптивные иммунные ответы посредством модуляции эффекторных и регуляторных Th-клеток путем модуляции сигналов, доставляемых через рецепторы врожденного иммунитета на дендритные клетки Tα1 продемонстрировал иммуномодулирующую функцию в отношении клеток врожденной иммунной системы, включая способность активировать митоген-активируемые протеинкиназы (MAPK) и экспрессию генов на макрофагах. Таким образом, механически Tα1, по-видимому, имеет действие, выходящее за рамки своего воздействия на Т-лимфоциты, и включает способность действовать как эндогенный регулятор как врожденной, так и адаптивной иммунной систем. [3] Tα1 сильно повышал экспрессию Toll-подобных рецепторов ( TLR2 ) и TLR9 мышиными DC (дендтритные клетки) и активировал пути NF- k B и JNK / p38 / AP-1. Исследования с человеческими DC подтвердили это открытие и дополнительно показали, что Tα1 усиливает экспрессию TLR2 миелоидными или обычными DC (cDC) и TLR9 плазматическими дендритными клетками (pDC). Индукция экспрессии TLR2 или TLR9 с помощью DC с помощью Tα1 была связана с отдельной программой активации как у мышей, так и у человеческих субпопуляций DC. Tα1 индуцировал продукцию IL-12p70 в cDC и IL-10 в pDC. Производство IL-12p70 было снижено в TLR2 - / -мышей, тогда как уровень IL-10 у мышей TLR9 - / - был снижен. Продукция обоих цитокинов была сильно снижена в DC без миелоидного фактора дифференцировки 88 (MyD88), адапторного белка, необходимого для продукции цитокинов при передаче сигналов всеми членами семейства TLR. Следовательно, в соответствии с открытием, показывающим, что Tα1 непосредственно передает сигналы через TLR9 и усиливает индуцированную лигандом передачу сигналов TLR2 посредством TLR-трансфицированных клеток HEK293, эти данные показывают, что Tα1 активирует подмножества DC через отдельные TLR и включает MyD88. Иммуномодулирующие эффекты Tα1 на DC коррелировали с терапевтическим эффектом пептида при экспериментальных грибковых или вирусных инфекциях. Введение Tα1 мышам с Aspergillus fumigatus привело к состоянию полной защиты от грибка, о чем свидетельствует повышение выживаемости после инфекции, которое параллельно уменьшению роста грибов, стимулирование продуцирующих IFN-γ клеток Th1 и ингибирование Клетки Th2, продуцирующие IL-4. Несмотря на то, что Tα1 увеличивал восстановление и функциональную активность эффекторных макрофагов и нейтрофилов, восстановление функции миелоида perse не могло учитывать эффективность Tα1. Фактически, выздоровления от нейтропении одного, например, путем лечения гранулоцитарным колониестимулирующим фактором, было недостаточно для опосредования степени устойчивости к противогрибковым препаратам, сравнимой с таковой, полученной с Tα1. Следовательно, для достижения состояния полной защиты гриба требовалось скоординированное действие врожденных эффекторных клеток и защитные ответы Th1, активность, успешно продвигаемая Tα1. В соответствии с данными in vitro по экспрессии TLR, терапевтическая эффективность Tα1 in vivo зависела от передачи сигналов MyD88, активируемой TLR2 и частично TLR9. Следовательно, несмотря на степень избыточности использования TLR, MyD88-зависимый сигнальный путь важен для противогрибковой активности Tα1 in vitro и in vivo . Способность Tα1 модулировать функционирование DC через TLR9 коррелировала с влиянием DC на восприятие цитомегаловируса in vitro и in vivo . Противовирусный эффект Tα1 приводил к активации IRF7 и стимулированию IFN-α / IFN-γ-зависимого эффекторного пути в pDC посредством TLR9-зависимого распознавания вирусного распознавания. При инфекции Tα1 снижал вирусную нагрузку как у восприимчивых, так и у устойчивых мышей с первичной инфекцией MCMV и индуцировал размножение цитолитических клеток NK1.1 + , продуцирующих IFN-γ Т-клеток CD8 + или CD4 + , а также продукцию IL-12p70. , IFN-α, IFN-γ и IL-10. Вместе эти данные указывают на то, что Tα1 влияет как на врожденный, так и на адаптивный противомикробный иммунный ответ in vivo [4]. Семейство β-тимозина человека состоит из трех основных групп, тимозина β4, β10 и β15 Эти белки представляют собой небольшие мономерные актин-связывающие белки из 40–44 аминокислотных остатков с консервативными α-спиралями. Белки тимозина β4 и тимозина β10 человека хорошо изучены, тогда как тимозин β15 менее изучен [5]. Тимозин-β4 , самый распространенный член этого семейства, экспрессируется в большинстве типов клеток млекопитающих и считается основным внутриклеточным пептидом, секвестрирующим G-актин. В дополнение к этой важной внутриклеточной функции этому пептиду приписывают несколько других активностей. Тимозин-β4 высвобождается из тромбоцитов человека и перекрестно связывается с фибрином после активации тромбоцитов тромбином. Тимозин-β4 рассматривается в качестве основного внутриклеточного G-актин секвестрирующего пептида в большинстве клеток млекопитающих. Этот 43-аминокислотный олигопептид образуют комплексы с G-актином в соотношении 1:1, и тем самым ингибируют соль-индуцированную полимеризация с F-актином. Идентифицированы также иные члены семьи β-тимозинов, и эти пептиды обладают сходными свойствами. Tβ4 присутствует в очень высоких концентрациях в лейкоцитах, но, поскольку пептид не обладает сигнальной последовательностью для секреции, его концентрация в плазме мала. Однако если происходит свертывание крови, уровни Tβ4 в сыворотке могут значительно увеличиться. Этот внеклеточный Tβ 4 может вносить вклад в несколько физиологических процессов, включая ангиогенез, заживление ран и регуляцию воспаления. Например, этот пептид увеличивает скорость прикрепления и распространения эндотелиальных клеток по компонентам матрикса, он стимулирует миграцию эндотелиальных клеток пупочной вены человека, он индуцирует металлопротеиназы, способствует заживлению ран роговицы и модулирует медиаторы воспаления. В большинстве исследованных к настоящему времени тканей млекопитающих экспрессировались два члена этого семейства пептидов, при этом в большинстве случаев Tβ4 является основным пептидом, который составляет более 80% от общего содержания β-тимозина. Одним из известных исключений является ткань кролика, где Tβ4Ala и Tβ10 обнаруживаются в сопоставимых количествах. Было установлено, что Tβ4Ala обладает более высоким сродством к G-актину, чем Tβ4 [6,7]. Кроме того обнаружено, что G-актин-секвестрирующий пептид тимозин β4 способствует миграции миокардиальных и эндотелиальных клеток в эмбриональном сердце и сохраняет это свойство в постнатальных кардиомиоцитах. Выживаемость эмбриональных и постнатальных кардиомиоцитов в культуре также увеличивалась с введением тимозина-β4. Мы обнаружили, что тимозин-β4 образует функциональный комплекс с PINCH и интегрин-связанной киназой (ILK), что приводит к активации киназы выживания Akt/PKB, которая необходима для воздействия тимозина-β4 на кардиомиоциты. После перевязки коронарной артерии у мышей, лечение тимозином-β4 приводило к усилению активности ILK и Akt в сердце, увеличивало раннюю выживаемость миоцитов и улучшало сердечную функцию. Эти данные свидетельствуют о том, что тимозин-β4 способствует миграции, выживанию и восстановлению кардиомиоцитов и эндотелия и может быть новой терапевтической мишенью в условиях острого повреждения миокарда [8]. Другой член семейства тимозинов - тимозин-β15 связывает актин аналогично другим членам семейства β-тимозина. Как и в случае с другими β-тимозинами, актин-связывающая активность обеспечивается всей молекулой, а не только классическим глобулярным (G)-актин-связывающим доменом. Временная сверхэкспрессия тимозина-β15 приводит к изменению клеточного цитоскелета со снижением уровня фибриллярного актина. Этот эффект на стабильность цитоскелета, вероятно, участвует в ингибировании миграции опухолевых клеток, когда уровень тимозина-β15 снижается с помощью антисмысловой сверхэкспрессии. Повышенная экспрессия тимозина наблюдается при многих раковых заболеваниях. Тимозин-β4 связан с метастазами в почечной, легких и колоректального рака, и избыточная экспрессия непосредственно усиливает метастазирование. Экспрессия тимозина-β10 увеличивается при раке груди, меланоме и ряде различных карцином. Это говорит о том, что данные вещества можно использовать в качестве маркеров различных онкологических заболеваний [5]. Тимулин. Тимулин - гормон тимуса, вырабатываемый исключительно эпителиальными клетками тимуса. Он состоит из нонапептидного компонента, связанного с ионом цинка, который придает молекуле биологическую активность. После открытия в начале 1970-х годов тимулин был охарактеризован как гормон тимуса, участвующий в нескольких аспектах дифференцировки Т-клеток внутри и вне тимуса. Впоследствии было продемонстрировано, что на выработку и секрецию тимулина сильно влияет нейроэндокринная система. Напротив, имеется информация, которая указывает на тимулин как на гипофизотропный пептид. В последние годы возник интерес к возможному использованию тимулина в качестве терапевтического средства. Было показано, что тимулин обладает противовоспалительными и обезболивающими свойствами в отношении мозга. Более того, аденовирусный вектор, несущий синтетический ген тимулина, стереотаксически вводимый в мозг крысы, достиг гораздо более длительной экспрессии, чем аденовирусно-опосредованная экспрессия в мозге других генов, что позволяет предположить, что противовоспалительная активность тимулина предотвращает разрушение иммунной системы клетки мозга, трансдуцированные вирусом. Другие исследования показывают, что генная терапия тимулина также может быть подходящей терапевтической стратегией для предотвращения некоторых эндокринных и метаболических изменений, которые обычно появляются на моделях животных с дефицитом тимуса [9]. Более свежие данные указывают на важную роль тимулина как сигнальной молекулы для взаимодействия между иммунной, эндокринной и нервной системами. Иммуногистохимические методы показали присутствие этого пептида в астроцитарных глиальных клетках головного мозга и базальных кератиноцитах кожи. В нескольких исследованиях описана двунаправленная связь между эпителием тимуса и осью гипоталамус-гипофиз. Например, было показано, что тимулин попадает в кровь с циркадным ритмом, совпадающим с активностью гипоталамус-гипофизарной оси. Более того, адренокортикотропный гормон (АКТГ) на физиологическом уровне, вводимый крысам, повышает уровень тимулина в плазме, тогда как АКТГ, вводимый in vitro стимулирует высвобождение тимулина из культивируемых фрагментов тимуса. Другие гормоны, включая пролактин, гормоны роста и щитовидной железы, также оказывают регулирующее влияние на высвобождение тимулина. Все эти наблюдения подтверждают существование двунаправленной связи между иммунной и нервной системой, которая, как полагают, представляет собой важный гомеостатический механизм. Известно, что цитокины и другие продукты иммунокомпетентных клеток играют решающую роль в качестве сигнальных молекул в этих взаимодействиях. Тимулин, по-видимому, играет защитную роль против воспаления в ЦНС, аналогичную ранее описанному действию против воспалительных эффектов внутрибрюшинной инъекции ЕТ. Этот защитный эффект, по-видимому, проявляется непосредственно на уровне ЦНС. Эти результаты обеспечивают поведенческую и иммунохимическую характеристику модели внутримозгового воспаления. Кроме того, это демонстрирует нейропротекторную роль тимулина в ЦНС, что проявляется во время воспалительных состояний. Хотя механизм действия этой молекулы в головном мозге полностью не выяснен, эти результаты указывают на потенциальное терапевтическое использование тимулина в качестве обезболивающего и противовоспалительного препарата [10]. Тимусный гуморальный фактор. Тимический гуморальный фактор – пептидный гормон, состоящий из 31 аминокислоты, индуцирует миграцию Т-лимфоцитов из селезенки в лимфатические узлы, где способствуют образованию хелперов. Есть данные о том, что этот фактор способствует превращению кортикальных лимфоцитов в медулярные (в тимусе). Впервые он испытан в клинике у больных с опухолями. Было обнаружено, что лимфоидные клетки, полученные из массы средостения и костного мозга, а также периферической крови пациента с плохо дифференцированной диффузной злокачественной лимфомой, имеют рецепторы как Е, так и комплемента. Добавление лимфобластов костного мозга к нормальным Т-лимфоцитам человека индуцировало подавление нормальной функциональной активности Т, измеряемой с помощью местного ксеногенного трансплантата, относительно реакции хозяина. Инкубация тех же клеток с гуморальным фактором тимуса (ТГФ), гормоном тимуса, изменила их функциональную активность с подавления на помощь. Контрольные исследования с нормальными Т-супрессорными лимфоцитами также показали изменение функции на вспомогательную активность при инкубации с ТГФ. В исследованиях нормальных Т-лимфоцитов с моноклональными антителами инкубация с ТГФ не вызывала изменений фенотипа ни в теофиллин-чувствительных (супрессорных) клетках, ни в теофиллин-резистентных (хелперных) клетках. Способность ТГФ модулировать вспомогательную и супрессорную активности предполагает, что этот или аналогичные агенты могут быть полезными средствами терапии нарушений иммунорегуляции [11]. Тимопоэтин. Белковый гормон, вырабатываемый тимусом и участвующий в контроле дифференцировки Т-лимфоцитов. Существуют две формы тимопоэтина человека, каждая из которых состоит из 49 аминокислот и они различаются по 2 аминокислотам. Первоначально было охарактеризовано влияние тимопоэтинов на нервно-мышечную проводимость (свойственна в большей степени тимопоэтину I) и дифференцировку Т-клеток (сильнее проявляется у тимопоэтина II). Тимопоэтины усиливают экспрессию проопиомеланокортина, секрецию продуктов его процессинга – АКТГ, β-эндорфина и β-липотропина, а также СТГ и кортизола. Некоторые пептиды, продуцируемые секреторными клетками тимуса, обладают свойствами нейротрансмиттеров. К этой группе веществ, помимо известных нейропептидов и гормонов (АКТГ, пролактин, вазопрессин, соматостатин, нейрофизин, эндорфины, окситоцин), относится тимопоэтин, подавляющий передачу импульсов от нервов к мышцам. Снижение уровня этого гормона при старении, после тимэктомии, при ряде заболеваний и действии неблагоприятных факторов окружающей среды, сопровождающееся ослаблением функций Т-лимфоцитов, может служить основой развития иммунодефицитного состояния, а также проявлений аутоагрессии. К другим эффектам тимопоэтина относится подавление индукции ранней дифференцировки В-лимфоцитов, которая осуществляется при участии цАМФ, и активация поздней дифференцировки В-лимфоцитов, которая происходит через цГМФ. Установлено, что in vivo тимопоэтин контролирует Т-зависимый иммунитет [12]. Заключение. Таким образом, можно сделать вывод, что гормоны вилочковой железы, по сути, определяют общую сопротивляемость к различным возбудителям, таким как грибки, вирусы, бактерии. Но, кроме того, они принимают участие и в таких процессах как гомеостаз, нейрогуморальная регуляция, регенерация. Непосредственное изучение этих гормонов, их взаимодействие с организмом, синтез их аналогов, представляет большой интерес для борьбы с вирусными, бактериальными, сердечно-сосудистыми, раковыми заболеваниями. Список литературы: 1. Анатомия человека / Под ред. М. Р. Сапина. 5-е изд. М., 2001. Т. 2. 2. https://himya.ru/gormony-timusa.html 3. Romani, L., Bistoni, F., Montagnoli, C., Gaziano, R., Bozza, S., Bonifazi, P., Zelante, T., Moretti, S., Rasi, G., Garaci, E. And Puccetti, P. (2007), Thymosin Α1. Annals Of The New York Academy Of Sciences, 1112: 326-338. 4. Pierluigi, B., D’Angelo, C., Fallarino, F., Moretti, S., Zelante, T., Bozza, S., De Luca, A., Bistoni, F., Garaci, E. and Romani, L. (2010), Thymosin α1: the regulator of regulators?. Annals of the New York Academy of Sciences, 1194: 1-5. 5. Banyard, J., Hutchinson, L.M. And Zetter, B.R. (2007), Thymosin β-NB Is the Human Isoform of Rat Thymosin β15. Annals of the New York Academy of Sciences, 1112: 286-296. 6. Huff, T., Müller, C.S.G. And Hannappel, E. (2007), Thymosin β4 Is Not Always the Main β-Thymosin in Mammalian Platelets. Annals of the New York Academy of Sciences, 1112: 451-457. 7. Huff, T., D. Zerzawy & E. Hannappel. 1995. Interactions of β-thymosins, thymosin β4-sulfoxide, and N-terminally truncated thymosin β4 with actin studied by equilibrium centrifugation, chemical cross-linking and viscometry. Eur. J. Biochem. 230: 650–657. 8. Srivastava, D., Saxena, A., Michael Dimaio, J. And Bock-Marquette, I. (2007), Thymosin β4 Is Cardioprotective after Myocardial Infarction. Annals of the New York Academy of Sciences, 1112: 161-170. 9. Reggiani, P.C., Morel, G.R., Cónsole, G.M., Barbeito, C.G., Rodriguez, S.S., Brown, O.A., Bellini, M.J., Pléau, J.-M., Dardenne, M. and Goya, R.G. (2009), The Thymus–Neuroendocrine Axis. Annals of the New York Academy of Sciences, 1153: 98-106. 10. Dardenne, M., Saade, N. And Safieh-Garabedian, B. (2006), Role of Thymulin or Its Analogue as a New Analgesic Molecule. Annals of the New York Academy of Sciences, 1088: 153-163. 11. Shohat, B., Shaklai, M., Nemes, L. and Trainin, N. (1984), Immune modulation of a T-Suppressor cell lymphoma by thymic humoral factor, a thymic hormone. Cancer, 54: 2122-2126. 12. https://www.biochemmack.ru/ |
