ГПОУ «Сыктывкарский медицинский колледж им. И.П. Морозова»
ДНЕВНИК
производственной практики по профилю специальности
по ПМ. 04 Проведение лабораторных микробиологических и иммунологических исследований, в том числе:
МДК 01.01. Теория и практика микробиологических и иммунологических лабораторных исследований
обучающегося (ейся) группы _______________ специальности _______________________
______________________________________________________________________________
(ФИО)
Место прохождения практики (медицинская организация, отделение):
_____________________________________________________________________________
_____________________________________________________________________________
Руководители производственной практики:
Общий руководитель _______________________________________________
Непосредственный руководитель _____________________________________
Методический руководитель_____________________________________________
Инструктаж по ТБ ________________________
МП
Движение по производственной практике
№п/п
|
наименование места производственной практики
| сроки практики |
подпись
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
М.печати _____________________________
(подпись)
Лист ежедневной работы обучающегося на производственной практике
дата
|
содержание и объем проделанной работы обучающегося
|
оценка
подпись руководителя
|
11.12
|
Поступила на практику ГБУЗ «ЭГП» в качестве помощника лаборанта на базе бактериологической лаборатории.
Данное лабораторное отделение состоит из лабораторных комнат:
комната заведующего лабораторным отделением;
комната для отдыха;
комната для приготовления питательных сред;
моечная;
стерилизационная;
чистая автоклавная;
комната для проведения на кишечные и воздушно-капельные инфекции;
комната для смывов материалов на стерильность;
термостатная;
комната для паразитологических исследований;
(отделение подразделяется на чистую и грязную зоны)
В течение дня была ознакомлена со следующими регламентирующими документами:
- «Инструкцией по безопасности работы с микроорганизмами и возбудителями паразитарных болезней»;
- ФЗ «О санитарно-эпидемиологическом благополучии населения» от 30.03.1999 № 52-ФЗ (ред.от 02.04.2014);
-«Организация внутреннего контроля качества санитарно-микробиологических исследований»;
В конце первого дня практики была ознакомлена с документацией по 3 видам стерилизационного контроля: бактериологического, химического, термического.
|
|
12.12
|
Манипуляция 1
Первичный посев кала (на бакпосев)
Посев осуществляем на 2-е плотные питательные среды: Плоскирева и Левина, а для детских посевов добавляем чашку со средой Эндо, для дальнейшего исследования на энтеропатогенные кишечные палочки. Нанесение материала начинают со среды Плоскирева, Левина, Эндо. После нанесения материала начинаем его втирать в среду шпателем. Сначала делаем площадку 1-2 см и далее не касаясь этой площадки штрихами распределяем нанесённый материал. Распределив материал по поверхности агара на одной чашке, переносим шпатель, не обжигая его, на вторую, а затем на третью чашку. Втирание шпателем начинаем со среды Эндо, Левина, Плоскирева.
При таком посеве получается рост изолированных колоний. Полученные изолированные колонии служат для пересева и получения чистой культуры изучаемого микроба. При высокой степени обсеменённости легко выявить патогенные микроорганизмы с прямого посева. После прямого посева испражнения заливаем средой обогащения (селенитовый бульон) в соотношении 1:5. Все посевы помещаем в термостат при температуре 37 градусов на 24 часа. Через сутки со среды обогащения делаем высев на дифференциально-диагностическую среду Висмут-сульфит агар (для выделения сальмонелл).
|
|
13.12
|
Манипуляция 2
Приготовление питательных сред: ЭНДО, МПА.
Среда Эндо - среда синтетическая, твердая, элективная. Имеет следующий состав, г: пептон – 10, лактоза – 10, K2HPO4 – 3,5, NaHSO3 – 2,5, агар-агар – 15,0, вода дистиллированная – 1000 мл. К среде добавляют 4 мл 10 %-ного спиртового раствора основного фуксина, поэтому она окрашивается в розово-кремовый цвет. Среду стерилизуют в автоклаве и сохраняют в темноте. Используют для выращивания кишечной палочки. Бактерии из рода Escherichia на этой среде образуют малиновые колонии с металлическим блеском.
Мясопептонный агар (МПА) – среда искусственная, твёрдая, общего назначения. Представляет собой плотную студнеобразную массу. Эта питательная среда широко применяется в лабораторной практике для выращивания микроорганизмов. Для её приготовления используют сухой агар-агар – полисахарид с низким содержанием азотистых веществ и не представляющий питательной ценности для микроорганизмов. Агар-агар имеет вид серых листовидных пластинок. Отличное гелеобразующее вещество, обладающее способностью набухать и растворяться при нагревании, а после застывания образовывать плотную студенистую массу. Для приготовления этой среды к 1 л МПБ добавляют 15-20 г агар-агара. Замачивают несколько часов для набухания агара, кипятят на слабом огне до полного его растворения, после этого доводят объём жидкости до первоначального дистиллированной водой, фильтруют через марлевый фильтр, смоченный предварительно горячей водой. Среду в горячем виде разливают в стеклянные колбы и стерилизуют в автоклаве. Готовый МПА имеет точку плавления 96-100 ºС и температуру застывания около 40 ºС, т. е. при комнатной температуре он всегда представляет собой твердую питательную среду.
|
|
14.12
|
Манипуляция 3
В четвертый день практики выполняла разлив сред.
Разлив сред в чашки Петри:
расплавить на водяной бане, остудить до 45-50ºС с МПА
поставить чашку крышкой вверх
сосуд до средой взять в правую руку, держа его у огня
левой рукой вынуть пробку, зажав ее мизинцем и ладонью
обжечь горлышко бутылки со средой и двумя пальцами левой руки слегка приоткрыть крышку
ввести под нее горлышко бутыли, не касаясь им края чашки и налить 15-20 мл. среды.
Если посев проводят в день разлива среды, то её необходимо подсушить в термостате 20-30 минут в разобранном виде, открыто стороной вниз. Если посев проводят на следующий день, то чашки не подсушивая заворачивают в ту же бумагу, в которой их стерилизовали и помещают в холодильник.
Разлив сред в пробирки:
взять сосуд с расплавленной и остуженной до 45ºС средой
левой рукой взять пробирку
правой рукой извлечь пробку из пробирки, а левой рукой из сосуда со средой, зажав ее мизинцем и ладонью
обжечь края пробирки и сосуда со средой, внести в пробирку 3-5 мл среды
вновь обжечь горлышки емкостей, закрыть из пробками
Среды могут застывать в пробирках в виде:
Скошенного столбика
Комбинированного столбика
Столбика
Для получения скошенного и комбинированного столбика, пробирки с расплавленной агаровой массой укладывают в наклонном положении на специальную подставку, чтобы среда не заходила на 2/3 пробирки, не смачивала пробку. После застывания среды, пробирки ставят вертикально в штатив, дают стечь конденсату вниз. Пользоваться средой без конденсата нельзя. Ее следует снова растопить на водяной бане и скосить.
|
|
15.12
|
Манипуляция 4
Окрашивание по Граму и Циль – Нильсену
Метод Грама. Относится к сложным методам окраски и позволяет дифференцировать грамположительные и грамотрицательные бактерии, что является важным таксономическим признаком. Результат окраски определяется особенностями строения клеточной стенки бактерий.
Этапы окраски
|
Цвет бактерий
|
На фиксированный мазок поместить фильтровальную бумажку, пропитанную генцианвиолетом, смочить водой, 2-3 минуты
|
Все бактерии окрашиваются в фиолетовый цвет
|
Снять бумажку, слить с препарата оставшуюся краску и налить раствор Люголя на 1 минуту
|
Все бактерии остаются фиолетовыми
|
Для дифференцирования нанести на мазок этиловый спирт и обесцветить в течение 30-60 с, промыть водой
|
Грамположительные бактерии остаются фиолетовыми, грамотрицательные обесцвечиваются
|
Нанести фуксин Пффейфера (водный раствор фуксина) и докрасить 1-2 мин, промыть водой, высушить
|
Грамположительные остаются фиолетовыми, грамотрицательные окрашиваются в красный цвет
|
Метод Циля-Нильсена.Относится к сложным методам окраски и позволяет дифференцировать кислотоустойчивые и некислотоустойчивые бактерии.
Этапы окраски
|
Цвет бактерий
|
На фиксированный мазок нанести карболовый раствор фуксина Циля через полоску фильтровальной бумаги и подогреть препарат в пламени горелки до появления паров (повторить 3-4 раза)
|
Все бактерии окрашиваются в красный цвет
|
Снять бумагу, промыть мазок водой
|
Все бактерии остаются красными
|
Для дифференцирования нанести 5% раствор серной кислоты на 1-2 минуты
|
Кислотоустойчивые бактерии остаются красными, некислотоустойчивые обесцвечиваются
|
Нанести водный раствор метиленового синего и докрасить 3-5 мин, промыть водой, высушить
|
Кислотоустойчивые остаются красными, некислотоустойчивые окрашиваются в синий цвет
|
|
|
16.12
|
Манипуляция 5
Культуральные свойства бактерий на плотных и жидких питательных средах
При описании колоний учитывают следующие признаки на плотных питательных средах учитывают:
форму колонии – округлая, амебовидная, ризоидная, неправильная и т.д.;
размер (диаметр) колонии – очень мелкие (точечные) (0,1-0,5 мм), мелкие (0,5-3 мм), средних размеров (3-5 мм) и крупные (более 5 мм в диаметре);
поверхность колонии – гладкая, шероховатая, складчатая, морщинистая, с концентрическими кругами или радиально исчерченная;
профиль колонии – плоский, выпуклый, конусовидный, кратерообразный и т.д.;
прозрачность – тусклая, матовая, блестящая, прозрачная, мучнистая;
цвет колонии (пигмент) – бесцветная или пигментированная (белая, желтая, золотистая, красная, черная), особо отмечают выделение пигмента в среду с ее окрашиванием;
край колонии – ровный, волнистый, зубчатый, бахромчатый и т.д.;
структура колонии – однородная, мелко или крупнозернистая, струйчатая; край и структуру колонии определяют с помощью лупы или на малом увеличении микроскопа, поместив чашку Петри с посевом на столик микроскопа крышкой вниз;
консистенция колонии – определяют прикасаясь к поверхности петлей, колония может быть плотной, мягкой, врастающей в агар, слизистой (тянется за петлей), хрупкой (легко ломается при соприкосновении с петлей).
В жидких питательных средах при росте микроорганизмов наблюдается помутнение среды, образование пленки или осадка.
Рост бактерий с равномерным помутнением среды, что характерно для факультативных анаэробов. Степень помутнения может быть слабая, умеренная, сильная.
Придонный рост бактерий характеризуется образованием осадка: скудного, обильного, рыхлого, слизистого, хлопьевидного, зернистого. Питательная среда может быть прозрачной или мутной.
Пристеночный рост – образование зерен, рыхлых хлопьев на внутренней поверхности стенок сосуда. Питательная среда при этом остается прозрачной.
Поверхностный рост бактерий характеризуется появлением на поверхности среды пленки: тонкой, плотной, рыхлой, гладкой, складчатой, влажной, сухой, кольцеобразной, сплошной. Такой рост наблюдается при культивировании аэробных бактерий.
При росте на полужидких (0,5-0,7% агара) питательных средах подвижные микробы вызывают выраженное помутнение, неподвижные формы растут только по ходу посева уколом в среду.
Культуральные свойства
Чаша №1
Форма колоний – округлая,
Размер – мелкие 0,5 – 3 мм.,
Поверхность колоний – гладкая,
Профиль колоний – выпуклый,
Прозрачность – матовая,
Цвет колоний – белого цвета,
Край колоний – ровный,
Структура колоний – однородная,
Консистенция колоний – мягкая.
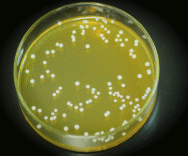
Чаша №2
Форма колоний – округлая,
Размер – мелкие 0,5 – 3 мм.,
Поверхность колоний – гладкая,
Профиль колоний – выпуклый,
Прозрачность – матовая,
Цвет колоний – желтого цвета,
Край колоний – ровный,
Структура колоний – однородная,
Консистенция колоний – мягкая.
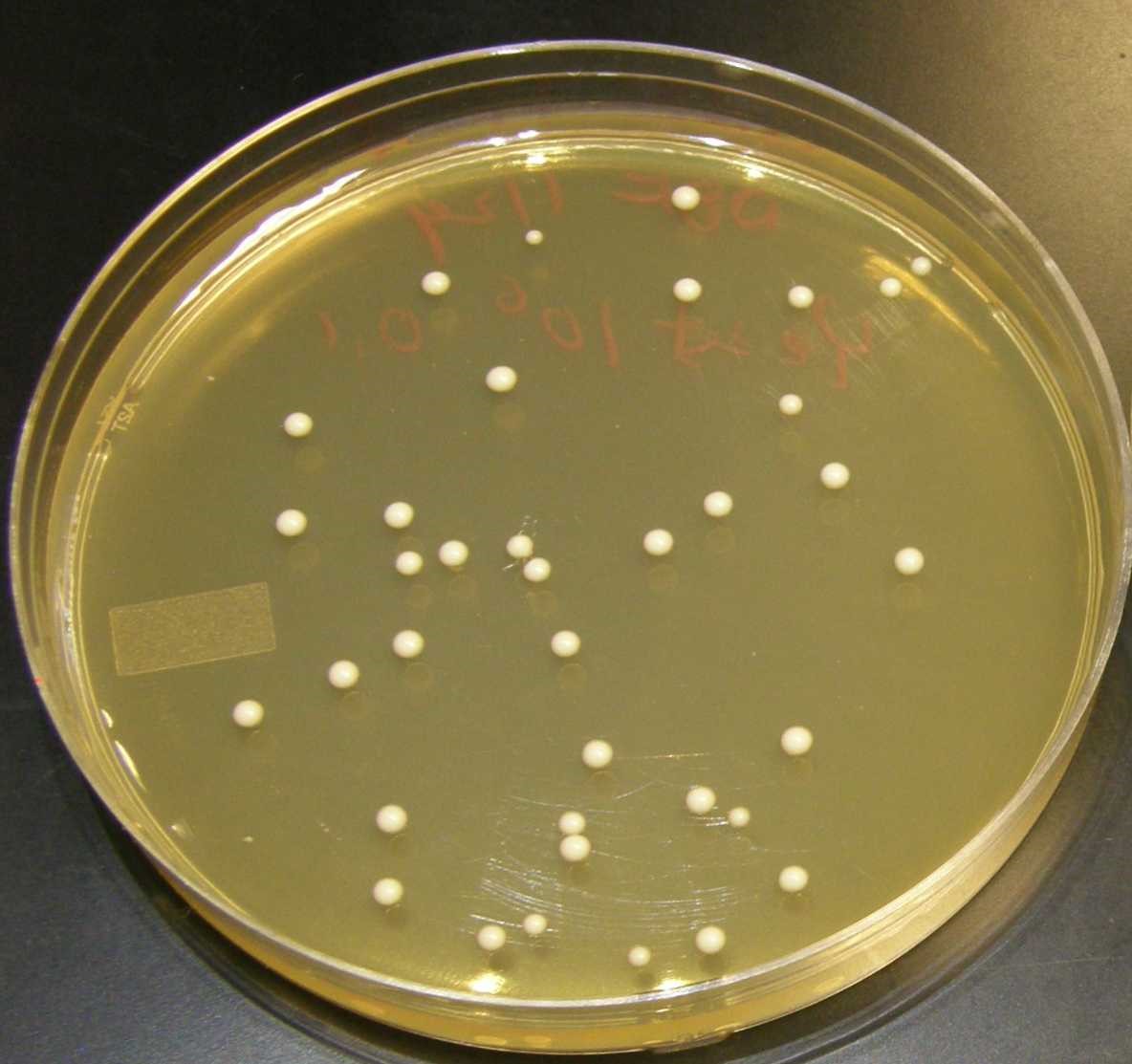
|
|
17.12
|
Манипуляция 6
Посев петлей на плотные среды в чашках Петри, скошенные среды, полужидкие среды
Посев на жидкую питательную среду.
Пробирку с исследуемым материалом и пробирку с питательной средой держат слегка наклонно в левой руке между большим и указательным пальцами так, чтобы края пробирок были на одном уровне (пробирка с исследуемым материалом должна быть первой по отношению к работающему).
В правую руку берут бактериологическую петлю (иглу или пипетку) как писчее перо.
Пробки от пробирок прижимают мизинцем к ладонной поверхности правой кисти, в зоне пламени горелки пробирки открывают, края пробирок обжигают.
Петлю вертикально прокаливают в пламени горелки.
Простерилизованную петлю (иглу, пипетку) вводят через пламя горелки в пробирку с посевным материалом.
Петлю охлаждают, забирают небольшое количество материала, переносят в пробирку со стерильной питательной средой.
Материал стряхивают в среду или, слегка погружая в жидкость петлю, растирают посевной материал по стенке пробирки не касаясь среды держателем, после чего смывают его средой.
Края пробирок и пробки вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив или стакан.
При посеве материала с помощью пипетки использованную пипетку опускают вниз концом в банку с дезинфицирующим раствором.
Посев в пробирку.
Материал, забранный петлей, опускают до дна пробирки со скошенным агаром, погружают в конденсационную жидкость и зигзагообразными движением петли проводят снизу вверх, слегка касаясь поверхности среды (посев штрихом).
При посеве материала уколом в столбик среды, петлей с материалом или иглой прокалывают вертикально центру пробирки питательную среду, петлю или иглу вынимают, прожигают. (Правила работы с пробирками и петлей при посеве в пробирку с плотной средой аналогичны правилам при посеве на жидкие питательные среды).
Посев на чашку Петри.
Чашку берут в левую руку, большим пальцем левой руки слег приподнимают крышку, чтобы в образовавшуюся щель свободно проходили петля или шпатель.
Обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли.
Посев петлей.
Посев штрихом. Посевной материал втирают петлей в поверхность среды у края чаш избыток снимают, проколов агар. Оставшийся материал растирают параллельными штрихами по поверхности среды.
Посев петлей на секторы: дно чашки расчерчивают на секторы, посев производят зигзагообразными движениями от края чашки к центру так, чтобы штрихи с одного сектора не переходили на другой.
Дробный посев: бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри, петлю прожигают в пламени горелки, дают остыть и часть материала из первого сектора (А) распределяют во втором секторе (В) аналогичным способом, затем в третьем (С) и четвертом (Д) секторах.
Посев шпателем.
Материал наносят на поверхность среды петлей или пипеткой, затем стеклянным или металлическим шпателем тщательно втирают по всей поверхности агара, вращая полуоткрытую чашку. После посева стеклянный шпатель помещают в дезинфицирующий раствор, металлический — прокаливают в пламени горелки.
Посев тампоном.
Тампон с исследуемым материалом вносят в чашку и круговыми движениями втирают его содержимое в поверхность среды, одновременно вращая тампон и чашку.
Посев газоном.
1 мл исследуемого материала (жидкая бульонная культура или взвесь микробов в физиологическом растворе) наносят пипеткой на поверхность среды и тщательно распределяют жидкость по всей поверхности чашки. Избыток материала отсасывают пипеткой и вместе с ней помещают в дезинфицирующий раствор.
Посев уколом.
Посев уколом в агар столбиком (прямой агар) применяется для выращивания анаэробов или выявления характерного признака микроба, так как рост по уколу типичен для ряда бактерий. Посев уколом в полужидкий агар практикуется также с целью длительного хранения культур. При посеве уколом в столбик желатина наблюдается разжижение ее бактериями, обладающими протеолитическим ферментом. Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку, как обычно, вынимают пробку и обжигают край пробирки, и в центре столбика питательной среды сверху вниз почти до самого дна пробирки вкалывают петлю с находящимся на ней материалом.
|
|
19.12
| Манипуляция 7 Приготовление фиксированных препаратов из культур микроорганизмов
Приготовление окрашенного препарата из культуры микроорганизмов включает:
приготовление мазка,
высушивание мазка,
фиксацию,
окраску.
Приготовление мазка.
на обезжиренное предметное стекло наносят петлёй небольшую каплю физиологического раствора, располагая её в центре круга, нарисованного с обратной стороны карандашом по стеклу. При работе спиртовка должна находиться прямо перед вами, на удобном для работы расстоянии.
Предметное стекло должно находиться в чашке Петри или лотке: категорически запрещается готовить мазки на предметном стекле, лежащем на столе!
В правую руку берут бактериологическую петлю, в левую - пробирку с культурой.
Петлю стерилизуют, внося её в пламя горелки в вертикальном положении.
После того как петля накалится докрасна, проводят конец петледержателя через пламя.
После этого из пробирки вынимают пробку, удерживая её мизинцем правой руки.
После обжигания на спиртовке края пробирки в неё вносят петлю, которую охлаждают, прикасаясь к стенкам пробирки.
Затем петлёй с поверхности среды снимают небольшое количество культуры. Не касаясь стенок пробирки, вынимают петлю и закрывают пробирку пробкой над спиртовкой.
После этого пробирку с культурой помещают в штатив, а культуру на петле вносят в приготовленную заранее каплю физиологического раствора, хорошо размешивают и равномерно распределяют по стеклу в виде небольшого круга или овала 1–1,5 см в диаметре. По окончании приготовления мазка петлю вновь стерилизуют в пламени спиртовки.
Для приготовления мазка из бульонной культуры на предметное стекло наносят 1–2 петли исследуемого материала, стерилизуя петлю перед каждым погружением в бульонную культуру микроорганизма, как описано выше, и равномерно распределяют по стеклу (в этом случае не требуется предварительного нанесения на стекло физиологического раствора).
Высушивание мазка.
Высушивание мазка производится на воздухе. Для ускорения высушивания предметное стекло с мазком, обращённым кверху, можно подержать в струе тёплого воздуха высоко над пламенем спиртовки, не внося препарат в пламя.
Фиксация мазка.
Для этого используют физический и химический методы. Физический метод заключается в фиксации мазка над пламенем спиртовки в течение нескольких секунд мазком вверх (троекратно по 1 секунде). Эту операцию проводят достаточно быстро, стараясь не перегреть мазок, так как при перегревании могут произойти необратимые изменения в клетке. Химический метод фиксации является более мягким по сравнению с фиксацией на пламени. В качестве фиксаторов используют этанол, ацетон, смесь Никифорова (эквивалентное соотношение этанола и эфира), метанол, формалин. После фиксации мазок можно окрашивать.
Окраска мазка.
Для окраски мазка следуют предписаниям для каждой методики окраски. При окраске простым способом на мазок наносят несколько капель раствора красителя так, чтобы весь мазок был покрыт им. Краситель оставляют на определённое время. Затем препарат промывают водой и просушивают фильтровальной бумагой.
|
|
20.12
| Манипуляция 8 Принять участие в исследовании дизбактериоза
1 г нативных фекалий растирают с 9 мл физиологического раствора (10-1). Из этого разведения делают посев на плотные питательные среды, обычно применяемые для выделения патогенных энтеробактерий (среды Плоскирева или Левина). Одновременно делают массивный посев из нативного кала на жидкие среды обогащения (магниевую).
Из основного разведения 1:10 делают дополнительные 100-кратные разведения в физиологическом растворе до 10-3 - 10-5, затем из пробирки, в которой фекалии разведены до 10-5, вносят по 0,1 мл на поверхность среды Эндо, Левина, Сабуро, и 0,01 мл на 3 - 5 % кровяной агар. Для посева на бифидобактерии делают дополнительно еще 2 - 3 разведения до 10-7 -10-9 - 10-11.
В первую пробирку с 9 - 10 мл среды Блаурокк вносят 1 мл из разведения фекалий 10-7, во вторую - 0,1 мл из этого же разведения, в третью и четвертую пробирку вносят соответственно по 1,0 и 0,1 мл из разведения 10-9, а в пятую и шестую по 1,0 и 0,1 мл из разведения 10-11. Все среды, за исключением среды Сабуро, помещают в термостат при температуре 37°.
Через 20 - 22 часа на среде Эндо подсчитывают число и процент лактозонегативных (бесцветных) колоний по отношению ко всему числу выросших колоний. Колонии со слабовыраженными ферментативными свойствами (слабое разложение лактозы - розовые колонии) подсчитывают по отношению к общему числу колоний кишечной палочки. Например: на среде Эндо выросли 50 лактозонегативных колоний при посеве 0,1 мл фекалий из разведения 1:100000. При расчете следует 50 умножить на 10, а затем на 100000 (степень разведения). Следовательно, в 1 г фекалий будет 50000000 лактозонегативных энтеробактерий.
С чашек со средами Эндо, Левина, Плоскирева выделяют не менее 4 - 5 колоний, отличающихся по морфологии, окраске на среды Рессела с мочевиной и солью Мора или на среду Олькеницкого, а также в пробирку с бульоном, под пробку которой подвешена индикаторная бумажка для определения индола.
Рост микробов рода Протея характеризуется разложением мочевины и окрашиванием среды Рессела в фиолетово-коричневый цвет при индикаторе тимоловый синий + кислый фуксин или оранжевый при индикаторе ВР, на среде Олькеницкого - в оранжевый цвет.
На 3 - 5 % кровяном агаре учитывают процентные соотношения колоний кишечной палочки, обладающих и не обладающих гемолизирующими свойствами; соотношения колоний кишечной палочки и кокковых форм; соотношения гемолизирующих и негемолизирующих кокков. Количество в 1 г фекалий указанных групп микробов учитывают, как это было указано, на среде Эндо
С 5 % кровяного агара пересевают колонии разного вида на скошенную поверхность слабощелочного агара. После 20 - 22-часовой инкубации в термостате при 37°. проводят микроскопию окрашенных по Граму мазков.
|
|
21.12
|
Манипуляция 9
Проведение контроля качества приготовленных питательных сред
В лаборатории должен осуществляться качественный и количественный контроль качества питательных сред.
Качественный контроль основан на оценке характера роста тестовых культур. Для этого суточную агаровую культуру тестового штамма пересевают в контролируемые питательные среды. Среду считают пригодной, если по истечении срока инкубации тестовый штамм дает хорошо различимый рост со всеми типичными для него признаками, которые предполагается выявлять на данной среде.
Количественный контроль питательных сред проводится по следующим показателям:
Влияние питательной среды на типичность микроорганизмов - оценку проводят по культурально - морфологическим и биохимическим признакам;
Ингибирующие свойства среды - оценивают как степень подавления прочей микрофлоры по величине посевной дозы в КОЕ (колониеобразующие единицы), полностью подавляемой на среде, или по отношению количества выросших колоний бактерий к расчетному количеству посеянных бактерий, а также величиной отношения среднего числа сформировавшихся колоний тест-штамма на "неингибиторной" среде (среда выращивания) к среднему числу колоний на испытуемой "ингибиторной" среде (показатель ингибиции) с учетом разведения;
Эффективность среды - выход микробных клеток из 1 мл питательной среды (в млрд./мл) и прирост числа микроорганизмов относительно засеянного (показатель эффективности);
Показатель чувствительности среды - максимальное разведение культуры, обеспечивающее визуально обнаруживаемый рост колоний искомого штамма при культивировании в течение определенного времени и определенной температуре на всех засеянных чашках (пробирках) с питательной средой.
Внутрилабораторный контроль качества питательных сред обеспечивает гарантию достоверных результатов. |
|
ОТЧЕТ ПО ПРОИЗВОДСТВЕННОЙ ПРАКТИКЕ
Обучающегося (щейся) ______________________________________________
(ФИО)
Группы ________________ Специальности 31.02.03 Лабораторная диагностика
Проходившего (шей) производственную практику с _____ по_____ 201__г.
На базе медицинской организации (МО):
__________________________________________________________________
ПМ.04 Проведение лабораторных микробиологических исследований
МДК.04.01. Теория и практика проведения лабораторных микробиологических исследований
За время прохождения производственной практики мной выполнены следующие объемы работ:
А. Текстовой отчет
__________________________________________________________________
__________________________________________________________________
Руководитель практики от ГПОУ «СМК» : ________________________
Руководитель практики от медицинской организации (ФИО, должность): ____________________________________________________________________
М.П. МО
Перечень манипуляций, выполняемых на производственной практике.
ПМ. 04. Проведение лабораторных микробиологических и иммунологических исследований.
МДК 04.01. Теория и практика лабораторных микробиологических и иммунологических исследований.
Манипуляции по выполнению профессионального модуля ПМ.04.
|
Да
|
Нет
|
1. ПК 4.1. Готовить рабочее место для проведения лабораторных микробиологических исследований
|
|
|
Приготовление питательных сред в соответствии с рецептурой.
|
|
|
Разлив питательных сред, подготовка их к стерилизации.
|
|
|
Проведение контроля качества приготовленных питательных сред.
|
|
|
Приготовление реактивов, красителей в соответствии с рецептурой, их маркировка, приготовление этикеток.
|
|
|
Приготовление дезинфицирующих растворов по сертификационной инструкции к ним.
|
|
|
Приготовление разных видов тампонов, ватно-марлевых пробок заправка лабораторной посуды и подготовка её к стерилизации.
|
|
|
2. ПК 4.2. Проводить лабораторные микробиологические и иммунологические исследования.
|
|
|
Подготовка исследуемого материала и анализов с объектов внешней среды к бактериологическому или серологическому исследованию
|
|
|
Выполнение посевов исследуемого материала разными методами (тампоном, бактериальной петлей, бактериальным шпателем) на плотные жидкие, полужидкие и скошенные среды.
|
|
|
Приготовление фиксированных микропрепаратов из культур микроорганизмов.
|
|
|
Проведение окраски микропрепаратов разными методами (по Граму, простым методом, по Цилю-Нильсену и другими методами по требованию).
|
|
|
Проведение микроскопии микропрепаратов и оценка микрокартины.
|
|
|
Определение чувствительности к антибиотикам методом дисков (постановка и учет результатов).
|
|
|
Изучение культуральных свойств бактерий с оформлением записей в дневнике (не менее двух чашек Петри по Вашему выбору).
|
|
|
Изучение результатов постановки биохимических тестов с оформлением записей в дневнике (не менее двух исследований по Вашему выбору).
|
|
|
Принять участие в постановке серологических и иммунологических реакций РА, РП, РПГА, ИФА и других исследований по возможности лаборатории.
Принять участие в исследовании на стафилококки (стрептококки) менингококки, эшерихии, шигеллы, сальмонеллы, коринебактерии, бордетеллы, дисбактериоз, пищевые отравления, исследования объектов внешней среды, хламидиоз, микоплазмоз. Оформить записи в дневнике, в каких исследованиях принимали участие.
|
|
|
3.ПК 4.3. Регистрировать результаты проведенных исследований
|
|
|
Оформление лабораторной документации по результатам проведенных исследований
|
|
|
Оформление лабораторной документации по приготовлению питательных сред.
|
|
|
Оформление документации по работе в стерилизационном блоке.
|
|
|
Оформление документации по приему, регистрации, маркировки клинического материала, анализов с объектов внешней среды
|
|
|
Знакомство с нормативной, отчетной, учетной, текущей документацией лаборатории.
|
|
|
4.ПК 4.4. Проводить утилизацию отработанного материала, дезинфекцию и стерилизацию использованной посуды, инструментария, средств защиты.
|
|
|
Проводить дезинфекцию отработанного материала, использованной посуды, инструментария.
|
|
|
Проводить уборку и дезинфекцию рабочего места по инструкции в зависимости от возбудителей заболеваний.
|
|
|
Принять участие в работе стерилизационного блока. Оформить записи в дневнике о режимах стерилизации сред, инструментария, посуды, уничтожения микробных культур, биологического материала
|
|
|
Место печати Подпись
ХАРАКТЕРИСТИКА СТУДЕНТА
Студент(ка)_______________ группы ____ специальности 31.02.03 «Лабораторная диагностика» проходил (а) производственную практику с « » _____ 201 г. по « » ______ 201 г.
на базе ___________________________________________________________________________
Наименование ПП ПМ.04. Проведение лабораторных микробиологических и иммунологических исследований МДК 04.01 Теория и практика лабораторных микробиологических и иммунологических исследований
2. Внешний вид студента ___________________________________________________________
3. Дисциплинированность, прилежание _____________________________________________
4. Теоретическая подготовка, умение применять теорию на практике _____________________
_________________________________________________________________________________
5. Проявление интереса к специальности _____________________________________________
6. Ведение и заполнение дневника ___________________________________________________
7. Какими умениями и навыками овладел (а) хорошо? ___________________________________
_________________________________________________________________________________
8. Какими умениями и навыками не владеет или владеет плохо?__________________________
_________________________________________________________________________________
9. Умеет ли заполнять медицинскую документацию? _______________________________
10. Индивидуальные особенности студента: инициативность, уравновешенность, аккуратность, отношение к выполняемой работе, коммуникабельность,
_________________________________________________________________________________
11. Умение контактировать с пациентами, сотрудниками________________________________
_________________________________________________________________________________
12. Участие в санпросветработе, общественной жизни лечебного учреждения ______________
_________________________________________________________________________________
13. Общее впечатление о работе студента во время прохождения практики_________________
_________________________________________________________________________________
14. Замечания студенту_____________________________________________________________________
15. Оценка за теоретические знания ____________________
Оценка за практические навыки ___________________
Практику прошел с оценкой _____________________________________________________
(неудовлетворительно, удовлетворительно, хорошо, отлично)
16.Заключение о готовности к самостоятельной работе _________________________________
Общий руководитель практики______________________________________
Непосредственный руководитель практики____________________________
М.П
|
 Скачать 322.04 Kb.
Скачать 322.04 Kb.

