Кинетика. Химическая кинетика Понятие химической кинетики Кинетика
 Скачать 36.5 Kb. Скачать 36.5 Kb.
|
|
Химическая кинетика 1. Понятие химической кинетики Кинетика – наука о скоростях химических реакций. Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности (гетерогенные). Истинная скорость реакции: 2. Факторы, влияющие на скорость химической реакции Для гомогенных, гетерогенных реакций: 1) концентрация реагирующих веществ; 2) температура; 3) катализатор; 4) ингибитор. Только для гетерогенных: 1) скорость подвода реагирующих веществ к поверхности раздела фаз; 2) площадь поверхности. Главный фактор – природа реагирующих веществ – характер связи между атомами в молекулах реагентов. Пример: NO2 – оксид азота (IV) – лисий хвост, СО – угарный газ, монооксид углерода. Если их окислить кислородом, то в первом случае реакция пойдет мгновенно, стоит приоткрыть пробку сосуда, во втором случае реакция растянута во времени. Концентрация реагирующих веществ будет рассмотрена ниже. Пример: 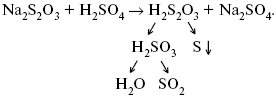 Голубая опалесценция свидетельствует о моменте выпадения серы, чем выше концентрация, тем скорость выше. 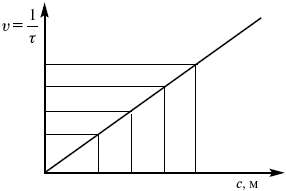 Рис. 10 Чем больше концентрации Na2S2O3, тем меньше времени идет реакция. На графике (рис. 10) изображена прямо пропорциональная зависимость. Количественная зависимость скорости реакции от концент-рации реагирующих веществ выражается ЗДМ (законом действующих масс), который гласит: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Итак, основным законом кинетики является установленный опытным путем закон: скорость реакции пропорциональна концентрации реагирующих веществ, пример: (т.е. для реакции) 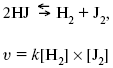 Для этой реакции Н2 + J2 = 2НJ – скорость можно выразить через изменение концентрации любого из веществ. Если реакция протекает слева направо, то концентрация Н2 и J2 будет уменьшаться, концентрация НJ – увеличиваться по ходу реакции. Для мгновенной скорости реакций можно записать выражение: квадратными скобками обозначается концентрация. Физический смысл k– молекулы находятся в непрерывном движении, сталкиваются, разлетаются, ударяются о стенки сосуда. Для того, чтобы произошла химическая реакция образования НJ, молекулам Н2 и J2 надо столкнуться. Число же таких столкновений будет тем больше, чем больше молекул H2 и J2 содержится в объеме, т. е. тем больше будут величины [Н2] и [J2]. Но молекулы движутся с разными скоростями, и суммарная кинетическая энергия двух сталкивающихся молекул будет различной. Если столкнутся самые быстрые молекулы Н2 и J2, энергия их может быть такой большой, что молекулы разобьются на атомы йода и водорода, разлетающиеся и взаимодействующие затем с другими молекулами Н2 + J2 >2H+2J, далее будет H + J2 >HJ + J. Если энергия сталкивающихся молекул меньше, но достаточно велика для ослабления связей H – H и J – J, произойдет реакция образования йодоводорода: 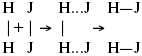 У большинства же сталкивающихся молекул энергия меньше необходимой для ослабления связей в Н2 и J2. Такие молекулы «тихо» столкнутся и также «тихо» разойдутся, оставшись тем, чем они были, Н2 и J2. Таким образом, не все, а лишь часть столкновений приводит к химической реакции. Коэффициент пропорциональности (k) показывает число результативных, приводящих к реакции соударений при концентрациях [Н2] = [J2] = 1моль. Величина k– const скорости. Как же скорость может быть постоянной? Да, скоростью равномерного прямолинейного движения называют постоянную векторную величину, равную отношению перемещения тела за любой промежуток времени к значению этого промежутка. Но молекулы движутся хаотически, тогда как же может быть скорость – const? Но постоянная скорость может быть только при постоянной температуре. С ростом температуры увеличивается доля быстрых молекул, столкновения которых приводят к реакции, т. е. увеличивается константа скорости. Но увеличение константы скорости не безгранично. При какой-то температуре энергия молекул станет столь большой, что практически все соударения реагентов будут результативными. При столкновении двух быстрых молекул будет происходить обратная реакция.  Настанет такой момент, когда скорости образования 2НJ из Н2 и J2 и разложения будут равны, но это уже химическое равновесие. Зависимость скорости реакции от концентрации реагирующих веществ можно проследить, пользуясь традиционной реакцией взаимодействия раствора тиосульфата натрия с раствором серной кислоты. Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3, (1) H2S2O3 = Sv+H2O+SO2^. (2) Реакция (1) протекает практически мгновенно. Скорость реакции (2) зависит при постоянной температуре от концентрации реагирующего вещества H2S2O3. Именно эту реакцию мы наблюдали – в этом случае скорость измеряется временем от начала сливания растворов до появления опалесценции. В статье Л. М. Кузнецовой описана реакция взаимодействия тиосульфата натрия с соляной кислотой. Она пишет, что при сливании растворов происходит опалесценция (помутнение). Но данное утверждение Л. М. Кузнецовой ошибочно так как опалесценция и помутнение – это разные вещи. Опалесценция (от опал и латинского escentia – суффикс, означающий слабое действие) – рассеяние света мутными средами, обусловленное их оптической неоднородностью. Рассеяние света – отклонение световых лучей, распространяющихся в среде во все стороны от первоначального направления. Коллоидные частицы способны рассеивать свет (эффект Тиндаля – Фарадея) – этим объясняется опалесценция, легкая мутноватость коллоидного раствора. При проведении этого опыта надо учитывать голубую опалесценцию, а затем коагуляцию коллоидной суспензии серы. Одинаковую плотность суспензии отмечают по видимому исчезновению какого-либо рисунка (например, сетки на дне стаканчика), наблюдаемого сверху через слой раствора. Время отсчитывают по секундомеру с момента сливания. Растворы Na2S2O3 x 5H2O и H2SO4. Первый готовят путем растворения 7,5 г соли в 100 мл H2O, что соответствует 0,3 М концентрации. Для приготовления раствора H2SO4 той же концентрации отмерить надо 1,8 мл H2SO4(к), ? = = 1,84 г/см3 и растворить ее в 120 мл H2O. Приготовленный раствор Na2S2O3 разлить в три стакана: в первый – 60 мл, во второй – 30 мл, в третий – 10 мл. Во второй стакан добавить 30 мл H2O дистиллированной, а в третий – 50 мл. Таким образом, во всех трех стаканах окажется по 60 мл жидкости, но в первом концентрация соли условно = 1, во втором – Ѕ, а в третьем – 1/6. После того, как будут подготовлены растворы, в первый стакан с раствором соли прилейте 60 мл раствора H2SO4 и включите секундомер, и т. д. Учитывая, что скорость реакции падает с разбавлением раствора Na2S2O3, ее можно определить как величину, обратно пропорциональную времени v = 1/? и построить график, отложив на оси абсцисс концентрацию, а на оси ординат – скорость реакции. Из этого вывод – скорость реакции зависит от концентрации веществ. Полученные данные занесены в таблицу 3. Можно этот опыт выполнить с помощью бюреток, но это требует от выполняющего большой практики, потому что график бывает неправильным. Таблица 3 Скорость и время реакции  Подтверждается закон Гульдберга-Вааге – профессора химии Гульдерга и молодого ученого Вааге). Рассмотрим следующий фактор – температуру. При увеличении температуры скорость большинства химических реакций повышается. Эта зависимость описана правилом Вант-Гоффа: «При повышении температуры на каждые 10 °C скорость химических реакций увеличивается в 2 – 4 раза». где ? – температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °C; v1 – скорость реакции при температуре t1; v2 – скорость реакции при температуре t2. Например, реакция при 50 °С протекает за две минуты, за сколько времени закончится процесс при 70 °С, если температурный коэффициент ?= 2? Решение: 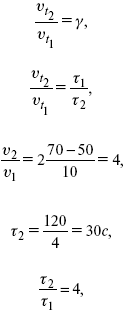 t1 = 120 с = 2 мин; t1 = 50 °С; t2 = 70 °С. Даже небольшое повышение температуры вызывает резкое увеличение скорости реакции активных соударений молекулы. Согласно теории активации, в процессе участвуют только те молекулы, энергия которых больше средней энергии молекул на определенную величину. Эта избыточная энергия – энергия активации. Физический смысл ее – это та энергия, которая необходима для активного столкновения молекул (перестройки орбиталей). Число активных частиц, а следовательно, скорость реакции возрастает с температурой по экспоненциальному закону, согласно уравнению Аррениуса, отражающему зависимость константы скорости от температуры где А – коэффициент пропорциональности Аррениуса; k– постоянная Больцмана; ЕА – энергия активации; R – газовая постоянная; Т– температура. Катализатор – вещество, ускоряющее скорость реакции, которое само при этом не расходуется. Катализ – явление изменения скорости реакции в присутствии катализатора. Различают гомогенный и гетерогенный катализ. Гомогенный – если реагенты и катализатор находятся в одном агрегатном состоянии. Гетерогенный – если реагенты и катализатор в различных агрегатных состояниях. Про катализ см. отдельно (дальше). Ингибитор – вещество, замедляющее скорость реакции. Следующий фактор – площадь поверхности. Чем больше поверхность реагирующего вещества, тем больше скорость. Рассмотрим на примере влияние степени дисперсности на скорость реакции. CaCO3 – мрамор. Плиточный мрамор опустим в соляную кислоту HCl, подождем пять минут, он растворится полностью. Порошкообразный мрамор – с ним проделаем ту же процедуру, он растворился через тридцать секунд. Уравнение обоих процессов одинаково. CaCO3(тв) + HCl(г) = CaCl2(тв) + H2O(ж) + CO2(г) ^. Итак, при добавлении порошкообразного мрамора время меньше, чем при добавлении плиточного мрамора, при одинаковой массе. С увеличением поверхности раздела фаз скорость гетерогенных реакций увеличивается. |
