Кинетика. Химическая кинетика
 Скачать 72 Kb. Скачать 72 Kb.
|
 Министерство образования Российской Федерации Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет) Кафедра общей и физической химии Отчет по лабораторной работе №6Тема: «Химическая кинетика» Выполнил: студент гр. ЭП-03 Леонов А В. Проверил: преподаватель Дубровская Н. Я. Санкт-Петербург 2005 Цель работы – определить константу скорости реакции окисления иодида персульфатом аммония при заданных начальных концентрациях реагентов. Сущность работы Реакция окисления иодида калия персульфатом аммония протекает с выделением йода по суммарному второму порядку. Образование йода можно увидеть по посинению раствора крахмала. Крахмал является очень чувствительным реагентом на молекулярный йод. Поэтому даже при самой малой скорости реакции при сливании компонентов раствор окрасится в синий цвет. Чтобы задержать появление окраски, в систему добавляется строго определенное количество тиосульфата натрия, которое реагирует с выделяющимся йодом. Когда весь тиосульфат израсходуется, появляется синяя окраска крахмала. Время, необходимое для реакции тиосульфата может быть измерено по секундомеру. Приборы и реактивы Бюретка; Мерная пипетка объемом 5 мл; Секундомер; Колба круглая объемом 100-250 мл; Химический стакан объемом 50 мл; Иодид калия (KI), 0,2 М раствор; Тиосульфат натрия (Na2S2O3), 0,02 М раствор; Крахмал, 1 % раствор; Персульфат натрия (Na2S2O8), 0,2 М раствор. Выполнение работы В каждую из 5 колб отмерить порции растворов иодида калия, тиосульфата натрия, крахмала и дистиллированную воду в количествах, указанных в таблице 1. В стаканчик отмерить указанный объем персульфата натрия, вылить в колбу с приготовленной реакционной смесью и одновременно включить секундомер. При появлении синего окрашивания секундомер останавливают и записывают время опыта. П.п. 2 и 3 выполнить для всех колб. Таблица 1
Реакции взаимодействия Реакция окисления йодида калия персульфатом натрия в водном растворе: 2KI + Na2S2O8 → I2 + K2SO4 + Na2SO4 Реакция выделяющегося йода с тиосульфатом натрия: I2 + 2Na2S2O3 → Na2S4O6 + 2 NaI Определение константы скорости реакции окисления йодида калия персульфатом натрия в водном растворе (табл. 2): где x – число молей прореагировавшего йода в момент времени τ: Таблица 2
Пример расчета: Абсолютная ошибка определения средней константы 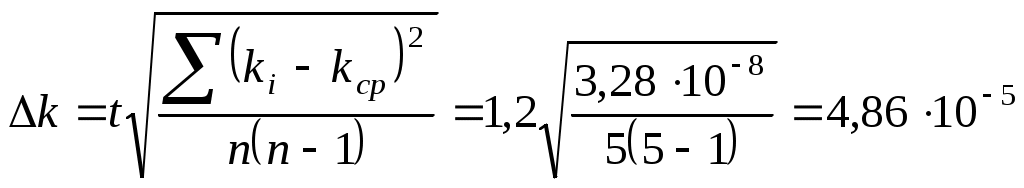 , ,где t – коэффициент Стьюдента, зависящий от числа измерений n. Относительная ошибка: Вывод В результате данной лабораторной работы определена константа скорости реакции окисления йодида калия персульфатом натрия в водном растворе: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
