|
Авторские права принадлежат Калиничевой А.А. ©
Химические свойства алкинов.
-
1. Галогенирование.
а) При комнатных температурах галогенирование ( c любым галогеном ) обычно проводят в тетрахлорметане ( CCl4 - растворитель ).
Алкины, в отличие от алкенов, способны присоединять 2 моля галогена.
|
ССl4
CH C CH3 + Сl2 CH = C CH3
1 моль
Сl Cl
Сl Cl
ССl4
CH C CH3 + 2 Сl2 CH C CH3
2 моль
Сl Cl
|
Общий смысл реакции галогенирования ( хлорирования или бромирования ) можно показать схемой.
|
 ССl4 ССl4
CH C CH3 + Сl Сl CH = C CH3
Сl Cl
|
б) При нагревании ( 500 С ) только при хлорировании происходит реакция замещения атома водорода у атома углерода соседнего с тройной связью.
Такие реакции характерны для алкинов с 3-мя атомами углерода и более.
|
500 С
СН С СН3 + Cl2 СН С СН2 + HCl
Cl
Только пропин при хлорировании образует 1 продукт. Алкины с числом углеродных атомов в цепи 4 и более образуют смесь хлорпроизводных ( см. механизм ).
|
Общий смысл реакции радикального хлорирования можно показать схемой.
|

H
500 С
СН С СН2 + Cl Cl СН С СН2 + HCl
Сl
|
2. Гидрирование.
При нагревании алкенов с водородом в присутствии никелевого катализатора ( каталитическое гидрирование ) происходит реакция присоединения.
Алкины, в отличие от алкенов, способны присоединять 2 моля водорода.
|
Ni,t
CH C CH3 + 2 H2 CH3 CH2 CH3
2 моля
Присоединение 1 моля водорода проводят на палладиевом катализаторе отравленном соединениями свинца:
Pd/Pb,t
CH C CH3 + H2 CH2 = CH CH3
1 моль
|
Общий смысл реакции гидрирования можно показать схемой.
|
 H H H H
Ni,t
CH C CH3 + 2 Н Н CH C CH3
Н Н
|
-
3. Гидрогалогенирование.
Реакция с любым галогеноводородом ( гидрогалогенирование ) происходит в условиях комнатных температур.
Алкины, в отличие от алкенов, способны присоединять 2 моля галогеноводорода.
|
CH C CH3 + HBr CH2 = C CH3
1 моль
Br
Br
CH C CH3 + 2 HBr CH3 C CH3
2 моля
Br
При этом молекула галогеноводорода присоединяется по правилу Марковникова В.В. ( см. алкены).
|
Общий смысл реакции гидрогалогенирования можно показать схемой.
|
 - + + - - + + -
CH C CH3 + H Br CH = C CH3
Н Br
наиболее гидрированный атом углерода
при тройной связи
|
|
|
|
Если эту реакцию проводить в присутствии перекисного соединения, то присоединение молекулы бромоводорода (только его ) происходит против правила Марковникова. Это связано с другим механизмом присоединения - радикальным присоединением ( АR )
Алкины, в отличие от алкенов, способны присоединять 2 моля бромоводорода.
|
Н2О2
CH C CH3 + HBr CH = CH CH3
Br
Br
Н2О2
CH C CH3 + 2 HBr CH CH2 CH3
Br
Впервые такую особенность присоединения обнаружил американский химик-органик Караш М.С. ( перекисный эффект Караша ).
|
Общий смысл реакции гидробромирования в присутствии перекиси можно показать схемой.
|
 Н2О2 Н2О2
CH C CH3 + H Br CH = C CH3
Br H
|
-
   4. Гидратация. 4. Гидратация.
Реакция с водой ( гидратация ) происходит в присутствии сильной неорганической кислоты ( обычно серной - H2SO4 ) и катализатора - сульфата ртути (II) -
HgSO4.
Механизм этой реакции до сих пор научно не доказан, но существует версия объяснения такой реакции.
|
В отличие от алкенов, алкины присоединяют воду с образованием альдегида или кетона. Впервые такую особенность присоединения открыл в 1881 году русский химик-органик Кучеров М.Г.
Только ацетилен, присоединяя воду, образует альдегид:
O
H2SO4,HgSO4 //
CH CH + Н2О CH3 C
\
H
этаналь ( уксусный альдегид )
Любой другой алкин, присоединяя воду, образует кетон:
H2SO4,HgSO4
CH C CH3 + Н2О CH3 C CH3
O
пропанон ( ацетон )
|
Общий смысл реакции Кучерова ( гидратации алкинов ) можно показать схемой.
Присоединение воды на первом этапе реакции согласуется с правилом Марковникова.
На втором этапе реакции получившееся нестабильное соединение изомеризуется ( внутримолекулярная перегруппировка ) как показано на схеме.
|
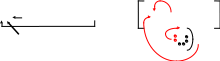 - + + - - - + + - -
CH C CH3 + HОН CH = C CH3
наиболее гидрированный атом Н О Н
углерода при тройной связи +
нестабильное переходное
соединение ( двойная связь
соединена с ОН-группой)
ЕНОЛ
H СH C CH3
Н O
|
5. Отношение к растворам окислителей ( перманганату калия ).
Реакция с раствором перманганата калия происходит в разных условиях по разному.
|
CH C CH3 + 2 KMnO4
О
\\ 1 2 3
C C CH3 + 2 MnO2 + KOH
/
KO O
|
В условиях комнатных температур в щелочной среде тройная связь между атомами превращается в одинарную, а атомы углерода при двойной связи превращаются в карбоксильную группу СООН ( если первичный атом углерода ) или кето-группу С = О ( если вторичный атом углерода ).
Атомы углерода, соединенные тройной связью, окисляются по-разному. Проанализируем примеры образования продуктов в таких реакциях на схемах:
|
-
Пример 1:
Первичный атом углерода ( концевой ) превращается всегда в группу СООН
Вторичный атом превращается в кето группу
С=О
|
Исходный алкин: Продукт мягкого окисления:

О
\\
CH C CH3 С С СН3
/
HO О
|
Пример 2:
Вторичный атом превращается в кето-группу — С
O
|
Исходный алкин: Продукт мягкого окисления:

CH3 C C CH3 СH3 C С СН3
O O
|
При нагревании алкина в кислой среде с раствором перманганата калия происходит полный разрыв тройной связи ( деструктивное окисление - разрушительное окисление). При этом из 1 молекулы алкена образуется два соединения.
Атомы углерода, соединенные тройной связью, окисляются по-разному. Проанализируем примеры образования продуктов в таких реакциях на схемах:
|
-
            Пример 1: Пример 1:
Первичный атом углерода ( концевой ) превращается всегда в молекулы СО2
Вторичный атом превращается в карбоксильную группу
СООН
|
Исходный алкин: Продукты деструктивного окисления:
О
\\
CH C CH3 СО2 + С СН3
/
HO
|
           Пример 2: Пример 2:
Вторичный атом превращается в карбоксильную группу
— СООН
|
Исходный алкин: Продукты деструктивного окисления:
О О
// \\
CH3 C C CH3 СH3 C + С СН3
\ /
OH HO
|
Из приведённых примеров можно сделать вывод, что продукты деструкции зависят от того какими атомами углерода образована двойная связь:
|
Первичный атом углерода:
|
Вторичный атом углерода:
|
Превращается в СО2
|
O
//
Превращается в С
\
OH
|
Полностью реакция полного (деструктивного) окисления выглядит так:
|
t
5 CH C CH3 + 8 KMnO4 + 12 H2SO4
O
\\
5 CO2 + 5 C CH3 + 8 MnSO4 + 4 K2SO4 + 12 H2O
/
HO
|
 
По обесцвечиванию слабомалинового раствора перманганата калия определяют тройную или тройную связь в молекуле непредельного соединения.
|
6. Отношение к нагреванию.
а) При сильном нагревании ( выше 1000 С ) без доступа кислорода алкины разлагаются на углерод ( сажа ) и водород.
|
t
CH СН 2 С + H2
|
б) При нагревании алкинов в присутствии кислорода они сгорают с образованием углекислого газа и воды.
|
t
C4H6 + 5,5 O2 4 CO2 + 3 H2O
t
CnH2n-2 + (1,5 n-0,5) O2 n CO2 + (n-1) H2O
|
7. Полимеризация.
В присутствии специальных катализаторов алкины вступают в реакцию полимеризации.
|
полимеризация
n CH3 C C СН3 ( C = C )n
СН3 СН3
|
Общий смысл реакции полимеризации можно показать схемой.
|

полимеризация
n C C ( C = C )n
СН3 СН3 СН3 СН3
|
-
8. СН кислотные свойства алкинов с концевой тройной связью.
Алкины с концевой тройной связью реагируют с амидом натрия. Реакцию проводят в жидком аммиаке:
|
NH3 (жидк.)
СН3 С СН + NaNH2
CН3 С C Na + NH3
|
-
Общий смысл реакции можно показать схемой.
|

+ _ NH3 (жидк.)
СН3 С С : Н + Na : NH2
_ +
CН3 С C : Na + NH3
|
-
  Алкины с концевой тройной связью реагируют с аммиачным раствором оксида серебра - Алкины с концевой тройной связью реагируют с аммиачным раствором оксида серебра -
гидроксидом диамминсеребра (I): [Ag(NH3)2 ]OH .
Качественная реакция (реакция для определения) тройной концевой связи.
|
 t t
CН СН + 2 [Ag(NH3)2 ]OH
Ag C С Ag + 4 NH3 + 2 H2O
ацетиленид серебра
 t t
CН С СН3 + [Ag(NH3)2 ]OH
Ag C С СH3 + 2 NH3 + H2O
пропинилид серебра
|
-
  Алкины с концевой тройной связью реагируют с аммиачным раствором оксида меди (I) - Алкины с концевой тройной связью реагируют с аммиачным раствором оксида меди (I) -
гидроксидом диамминмеди (I): [Сu(NH3)2 ]OH .
Качественная реакция (реакция для определения) тройной концевой связи.
|
 t t
CН СН + 2 [Cu(NH3)2 ]OH
Cu C С Cu + 4 NH3 + 2 H2O
ацетиленид меди (I)
 t t
CН С СН3 + [Cu(NH3)2 ]OH
Cu C С СH3 + 2 NH3 + H2O
пропинилид меди (I)
|
-
9. Тримеризация ацетилена
В особых условиях из ацетилена путём объединения трёх молекул (тримеризации) образуется бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
|
 t, p, С t, p, С
3 СHСН
 t, p, С H3C CH3 t, p, С H3C CH3
3 СH3 - С СН
CH3
|
-
10. Димеризация ацетилена
В растворе из ацетилена путём объединения двух молекул (димеризации) образуется винилацетилен.
|
CuCl, NH4Cl
2 СH СН СH2 = CH – СH СН
винилацетилен.
|
Способы получения алкинов
а) Лабораторные способы получения.
-
1. Дегидрогалогенирование алкилдигалогенидов .
Отщепление молекулы любого галогеноводорода ( дегидрогалогенирование ) происходит в реакции алкилдигалогенида со щёлочью в спиртовом растворе.
При этом отщепление молекулы галогеноводорода происходит по правилу Зайцева А.М. (см. алкены).
В реакцию дегидрогалогенирования вступают алкилдигалогениды, которые имеют атомы галогена, присоединенные к одному атому углерода, либо к разным соседним атомам углерода.
|
Br
спирт,t
CH3 C CH2 CH3 + 2 КОН
Br
CH3 C C CH3 + 2 H2О + 2 KBr
спирт,t
CH3 CH CH CH3 + 2 КОН
Br Br
CH3 C C CH3 + 2 H2О + 2 KBr
|
-
Общий смысл реакции дегидрогалогенирования можно показать схемой.
|
Атом водорода отщепляется от атома углерода соседнего с атомом, содержащим атом галогена, и имеющим меньшее число атомов водорода. В данном примере атомы углерода C1 и С3 - соседние с связью С Br. Атом С1 имеет 3 атома водорода ( Н ), а атом С3 имеет 2 атома водорода. Поэтому, атом водорода отщепляется от атома С3.
|
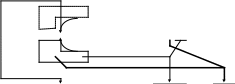
Br H
1 2 3 4 спирт,t
CH2 C C CH3 + 2 КОН
Н Br Н
CH3 C C CH3 + 2 H ОН + 2 KBr
|
-
    2. Дегалогенирование. 2. Дегалогенирование.
Отщепление молекулы любого галогена ( дегалогенирование ) проводят при нагревании с цинковой пылью или порошком магния:
|
Br Br
t
CH C CH3 + 2 Zn CH C CH3 + 2 ZnBr2
Br Br
|
-
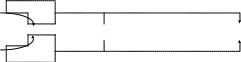 Общий смысл реакции дегалогенирования можно показать схемой. Общий смысл реакции дегалогенирования можно показать схемой.
|
Схема реакции:
Br Br
t
CH C CH3 + 2 Zn CH2 = CH CH3 + 2 ZnBr2
Br Br
|
3. Карбидный способ.
Карбиды пол учают присплавлении оксидов металлов с избытком углерода.
При действии на карбиды кальция и магния воды они полностью гидролизуются с образованием ацетилена и пропина соответственно.
|
2500 C
3 С + СаО CaC2 + СО
карбид кальция
CaC2 + 2 Н2О Ca(OH)2 + CH CH
карбид кальция ацетилен
Mg2C3 + 4 Н2О 2 Mg(OH)2 + HC C CH3
карбид магния пропин
|
4. Реакции алкилирования.
Реакция происходит между металлорганическим производным алкина и алкилгалогенидом.
Реакции алкилирования в настоящее время самый передовой способ получения несимметричных алкинов.
Он основан на способности алкинов с концевой тройной связью образовывать ионные соединения с металлами.
|
 _ + _ +
CH3 C C : Na + CH3 CH CH3
Br
CH3 C C CH CH3 + NaBr
CH3
Алкилирование - введение алкильной группы ( углеводородного радикала ) в молекулу органического соединения.
|
б) Промышленные способы получения.
-
1. Каталитическое дегидрирование алканов и алкенов.
Отщепление двух молекул водорода ( дегидрирование ) от молекулы алкана или отщепление одной молекулы водорода от алкена приводит к образованию смеси непредельных соединений во всех случаях кроме этана и пропана.
|
Ni,t
CH3 CН3 CH CH + 2 H2
Схема реакции:

H H
Ni,t
CH CН CH CH + 2 H Н
H H
Ni,t
CH2 = CН СН3 CH C СН3 + H2
|
2. Гидрирование угля.
Способ Бертло. Этим способом можно получить только ацетилен. Выход этой реакции очень маленький, поэтому, в настоящее время промышленного значения не имеет.
Реакция проводится при высокой температуре и высоком давлении.
|
3000 C
2 С + Н2 CH CH
р
|
  3. Неполное сгорание метана. 3. Неполное сгорание метана.
|
Реакция длится доли секунды:
t
4 СН4 + O2 CH CH + 2 CO + 7 H2
синтез газ
|
4. Электрокрекинг метана.
Очень важный промышленный способ, которым получают только ацетилен. Реакция происходит в электропечах.
|
Реакция длится доли секунды:
1600 C
2 CH4 CH CH + 3 H2
|
в) ОСОБЫЕ способы получения.
-
1. Реакции алкилирования
с реактивом Йоцича
Аналогичную реакцию можно провести, используя магнийорганическое производное алкина с концевой тройной связью ( реактив Йоцича ).
|
Алкилирование - введение алкильной группы ( углеводородного радикала ) в молекулу органического соединения.
1) Сначала получают магнийорганическое производное –
реактив Йоцича
 _ + диэтиловый эфир _ + диэтиловый эфир
CH3 C CH + CH3 CH2 : МgBr
_ +
CH3 C C : МgBr + CH3 CH2 H
реактив Йоцича
2) Затем проводят реакцию алкилирования:
_ +
CH3 C C : МgBr + CH3 CH CH CH3
Br CH3
CH3 C C CH CH CH3 + MgBr2
CH3 CH3
| |
 Скачать 197 Kb.
Скачать 197 Kb.