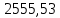контрольная работа. ТОХТ конт работа. Решение Уравнение реакции образования ацетилена CaC 2 2H 2 ОCa(OH) 2 c 2 h 2
 Скачать 31.27 Kb. Скачать 31.27 Kb.
|
|
1. Рассчитать материальный баланс процесса производства ацетилена из карбида кальция. Исходные данные: - производительность по ацетилену – 50 т/сут; - конверсия карбида кальция – 0,7; - конверсия воды – 0,8; - содержание примесей в карбиде кальция – 30%; - содержание примесей в воде – 5%. Решение: Уравнение реакции образования ацетилена CaC2+ 2H2О⟶Ca(OH)2+ C2H2↑ Молекулярные массы компонентов: Карбид кальция: CaC2= 64, г\моль Вода: H2О = 18, г\моль Гидроксид кальция: Ca(OH)2 = 74, г\моль Ацетилен: C2H2 = 26, г\моль Проверяем соответствие баланса М(СаС2)+2*М(Н2О)=М(Са(ОН)+м(С2Н2) 64+2*18=74+26 100=100 Рассчитываем производительность установки 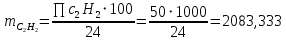 (кг\ч) (кг\ч)Расчитываем стехиометрическое количество СаС2 , необходимое для получения C2H2 массой 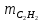 : :CaC2 + 2H2О⟶ Ca(OH)2 + C2H2↑ 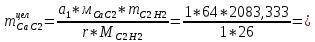 5128,204 (кг/час) 5128,204 (кг/час)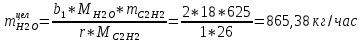 Находим массу чистого CaC2 с учетом его конвексии, которое должно находиться в техническом CaC2: 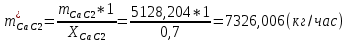 Где  - масса СаС2 с учетом конверсии, - масса СаС2 с учетом конверсии,ХСас2 -конверсия СаС2, выраженная в долях. Рассчитываем массу непревращеного остатка 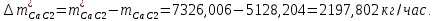 Найдем массу технического реагента CaC2 с учетом его состава: 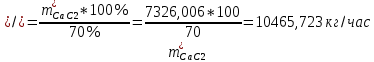 Масса примесей технического реагента CaC2 равна: 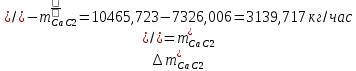 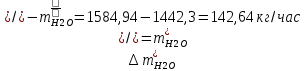 Находим стехиометическую массу Н2О, необходимую для получения заданного количества С2Н2: 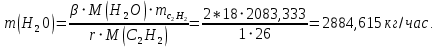 Находим массу чистого Н2О с учетом его конвекции: 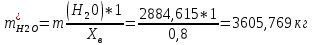 /час /часНаходим массу непреращенного остатка Н2О после оканчания процесса : 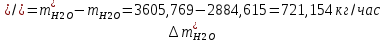 Находим массу технического Н2О с учетом его состава: 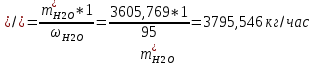 Масса примесей Н2О равна : 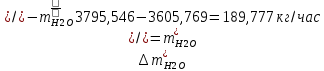 Рассчитываем массу Са(ОН)2 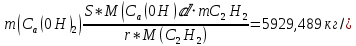 час часСоставляем уравнение материального баланса: 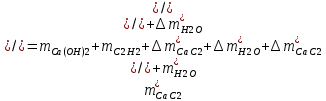 10465,723+3795,546=2083,333+5929,486+2197,802+721,154+313,717+189,777 14261,269=14261,269 Составляем таблицу материального баланса:
2. Составить материальный баланс процесса производства хлорбензола (процесс сложный необратимый параллельный). Рассчитать расходные коэффициенты по сырью, селективность процесса, выход целевого продукта. Исходные данные: - производительность по техническому хлорбензолу – 30 т/сут; - содержание хлорбензола в целевом продукте – 75%; - содержание дихлорбензола в целевом продукте – 25%; - содержание примесей в бензоле – 16%; - содержание примесей в хлоре – 15%; - конверсия бензола – 0,7; - конверсия хлора – 0,9. Решение: Основная реакция C6H6 + Cl2 → C6H5Cl + HCl (1) Побочная реакции C6H6 + 2Cl2 → C6H4Cl2 + 2HCl (2) Молекулярные массы компонентов: Бензол: С6Н6= 78, Хлорбензол: С6Н5Cl = 112,5, Дихлорбензол: С6Н4Cl2 = 147 Хлор: Cl2 = 71, Хлороводород: HCl = 36,5. По условию задачи производительность по техническому хлорбензолу – 30 (т/сут) или 1250 (кг/час). Технический хлорбензол содержит 70% масс. хлорбензола и 30% масс. дихлорбензола. Определим массу каждого продукта в составе реакционной массы после протекания процесса (в техническом хлорбензоле): 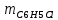 = 1250 · 0,75 = 937,5 (кг/час) = 1250 · 0,75 = 937,5 (кг/час)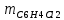 = 1250 · 0,25 = 312,5 (кг/час) = 1250 · 0,25 = 312,5 (кг/час)Проверяем правильность расчета: 937,5кг/час + 312,5кг/час = 1250 кг/час По массе целевого продукта C6H5Clcогласно стехиометрии определяем расход чистых реагентов С6Н6 и Сl2 на целевую реакцию: 78 71 112,5 36 C6H6 + Cl2 → C6H5Cl + HCl 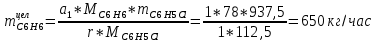 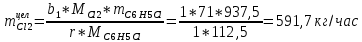 Помимо хлорбензола, образовался хлороводород: 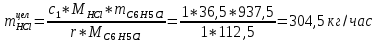 Определяем расход чистых реагентов С6Н6 и Сl2 на побочную реакцию: 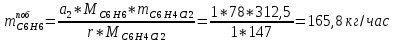 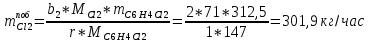 Помимо хлорбензола, образовался хлороводород: 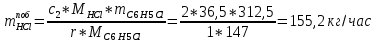 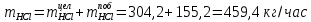 Суммируем массы каждого из реагентов, израсходованных на целевую и побочные реакции: 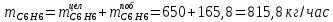 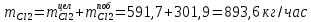 Учитываем конверсию реагентов: 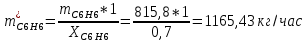 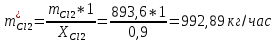 Определяем непревращенный остаток для каждого из реагентов, 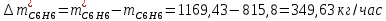 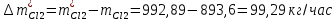 Найдем массу технического реагента С6Н6 с учетом его состава: 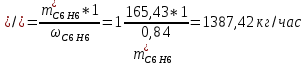 Рассчитаем массу технического реагента Сl2 с учетом его состава: 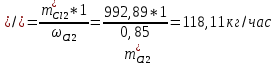 Масса примесей технического реагента С6Н6и Сl2равна: 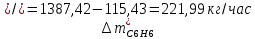 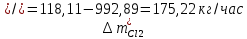 Составляем уравнение материального баланса 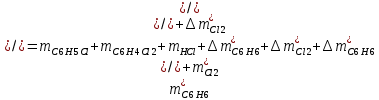 1387,42+1168,11=937,5+312,5+459,4+349,63+99,29+221,99+175,22 2555,53=2555,53 Составляем таблицу материального баланса:
Рассчитаем селективность процесса по реагентам: 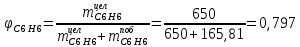 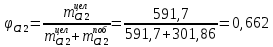 Выход на подданное сырье: 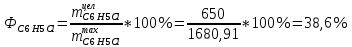 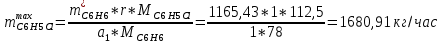 Выход на превращенное сырье: 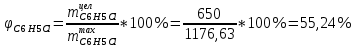 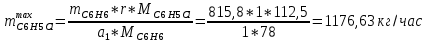 Расходные коэффициенты по сырью: - фактические: 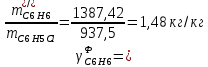 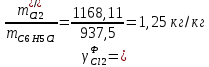 Теоретические 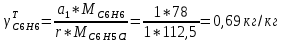 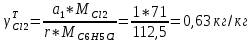 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||