Орг химия. Химические свойства диеновых углеводородов с сопряженными связями. Напишите характерные реакции для изопрена (2метилбутадиена1,3) и какое практическое применение имеют продукты реакции. Ответ
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
СодержаниеВопрос 9. 1 Вопрос 13. 4 Вопрос 22. 6 Вопрос 33. 8 Вопрос 50. 8 Вопрос 55. 10 Вопрос 62. 12 Вопрос 72. 13 Список литературы 18 Вопрос 9.Химические свойства диеновых углеводородов с сопряженными связями. Напишите характерные реакции для изопрена (2-метилбутадиена-1,3) и какое практическое применение имеют продукты реакции. Ответ. Для диеновых углеводородов (алкадиенов) с сопряженными связями характерны реакции присоединения и полимеризации, свойственные алкенам. Однако в химическом поведении 1,3-алкадиенов имеются и некоторые особенности. Во-первых, по сравнению с алкенами сопряженные диены проявляют более высокую реакционную способность. Во-вторых, в реакциях электрофильного присоединения чаще всего образуется два продукта, из которых один является результатом присоединения по месту двойной связи (1,2-присоединение), а второй – по концам сопряженной системы (1,4-присоединение). Соотношение этих продуктов зависит от условий проведения реакции (температуры, растворителя), а также природы электрофильного реагента. Водород в момент выделения образует с 1,3-алкадиенами обычно продукты 1,4-присоединения: 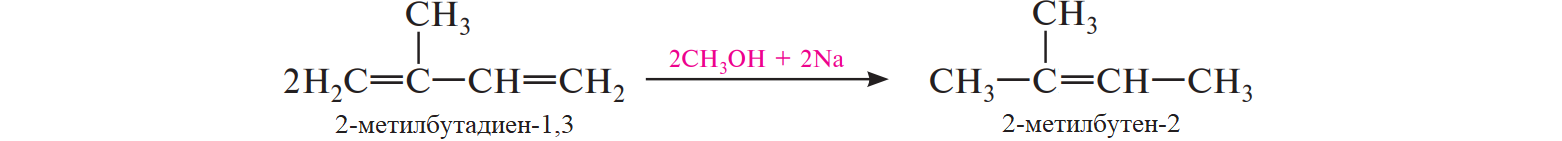 В присутствии катализаторов (Ni, Рt) 1,3-алкадиены присоединяют водород в 1,2- и 1,4-положения с образованием соответствующих алкенов, которые подвергаются дальнейшему гидрированию до алканов:  Присоединение галогенов к сопряженным диенам приводит к образованию смеси продуктов 1,2- и 1,4-присоединения, состав которой зависит от природы галогена, структуры диенового углеводорода и условий проведения реакции. Как правило, при повышении температуры и переходе от хлора к йоду возрастает выход продукта 1,4-присоединения. В процессе бромирования 1,3-бутадиена при температуре –80°С образуется преимущественно продукт 1,2-присоединения, а при 40°С – продукт 1,4-присоединения:  Как и в случае галогенирования, присоединение к сопряженным диенам галогеноводородов происходит с образованием продуктов 1,2- и 1,4-присоединения:  Важным свойством алкадиенов с сопряженными связями является их склонность к полимеризации. В качестве инициаторов чаще применяют органические и неорганические пероксиды, металлорганические соединения, щелочные металлы. Образование полимера происходит преимущественно по типу 1,4-присоединения. При полимеризации замещенных диенов 1,4-присоединение осуществляется по принципу "голова к хвосту": 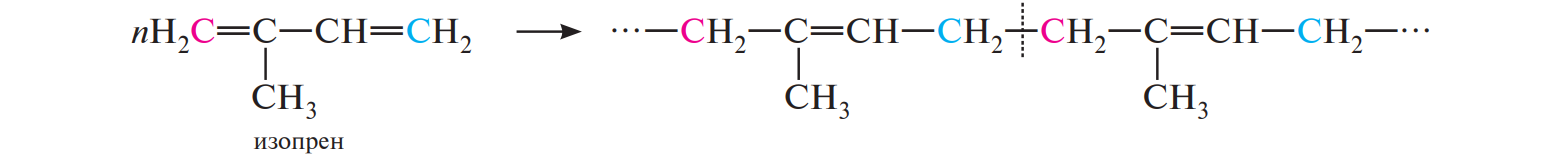 Реакции полимеризации сопряженных диенов широко используют в производстве синтетического каучука. Изопрен является основой многих природных соединений, таких как натуральный каучук, терпены, стероиды. Широко применяется в промышленности для получения изопренового каучука, душистых веществ, лекарственных средств. Вопрос 13.Химические свойства двухатомных и трехатомных спиртов. Напишите качественную реакцию. Какие из них имеют широкое распространение, используются в промышленности, медицине и ветеринарии. Ответ. Двухатомные спирты (содержат две гидроксильные группы) называют диолами, или гликолями. Трехатомные спирты (содержат три гидроксильные группы) называют триолами, или глицеринами. Многоатомные спирты вступают в те же реакции, что и одноатомные, с той лишь разницей, что они могут протекать с участием одной или нескольких гидроксильных групп. Основное различие химических свойств заключается в том, что многоатомные спирты являются более сильными OH-кислотами, чем одноатомные спирты, поэтому они образуют алкоголяты не только со щелочными металлами, но и с другими активными металлами (Al, Mg и др.), а также со щелочами и гидроксидами тяжелых металлов. Повышение кислотных свойств связано с электроноакцепторным влиянием одной гидроксильной группы на другую (отрицательный индуктивный эффект). При взаимодействии с активными металлами безводные гликоли образуют неполные и полные гликоляты: 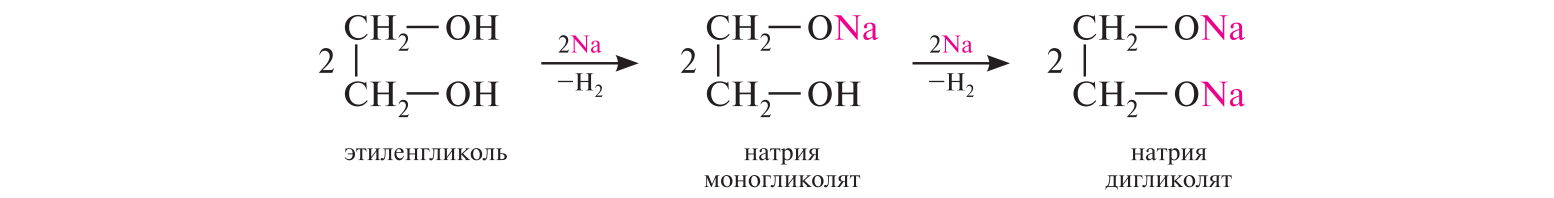 α-Гликоли реагируют с меди (II) гидроксидом с образованием меди (II) гликолята ‒ комплексного соединения синего цвета:  С увеличением числа гидроксильных групп в молекуле кислотные свойства соединения усиливаются. Так, глицерин, по сравнению с этиленгликолем, имеет более выраженные кислотные свойства. В водном растворе щелочи глицерин легко образует моноглицераты [HOCH2–CH(ONa)–CH2OH]. При взаимодействии с меди (II) гидроксидом глицерин образует меди (II) глицерат (раствор синего цвета). Хорошая растворимость глицератов в воде объясняется их комплексным строением: 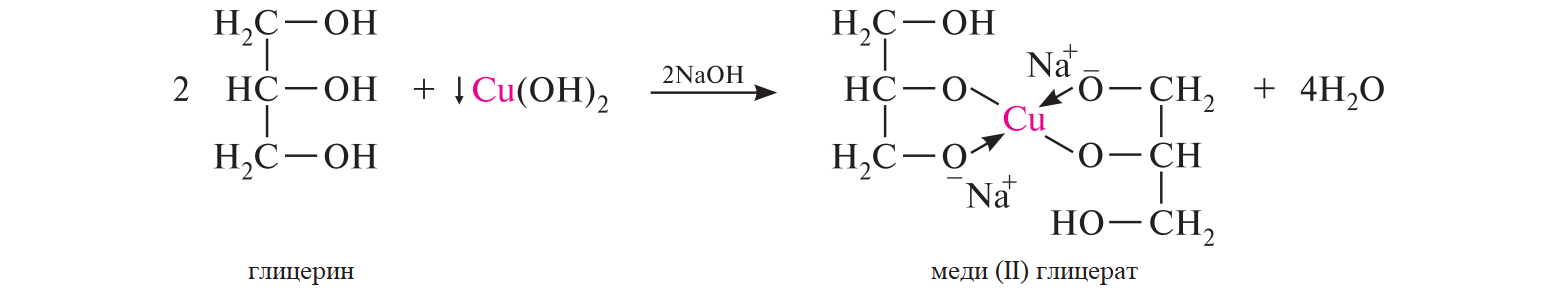 Этиленгликоль (1,2-этандиол) – бесцветная вязкая жидкость. Гигроскопичен, смешивается с водой и этанолом. Сильно понижает температуру замерзания воды и используется для приготовления антифриза. Очень токсичен. Широко используется для получения синтетических волокон. Глицерин (1,2,3-пропантриол) – бесцветная сиропообразная жидкость без запаха, со сладким вкусом. Гигроскопичен, смешивается с водой и этанолом в любых соотношениях. Применяется в качестве основы для мазей и паст, добавки к мылам. В больших количествах глицерин используется для получения нитроглицерина. Вопрос 22.Химические свойства предельных двухосновных карбоновых кислот на примере янтарной. Ответ. Представителем предельных двухосновных карбоновых кислот является янтарная (бутандиовая) кислота HOOC–CH2–CH2–COOH. Дикарбоновые кислоты за счет наличия двух карбоксильных групп диссоциируют ступенчато, образуя анион и дианион: 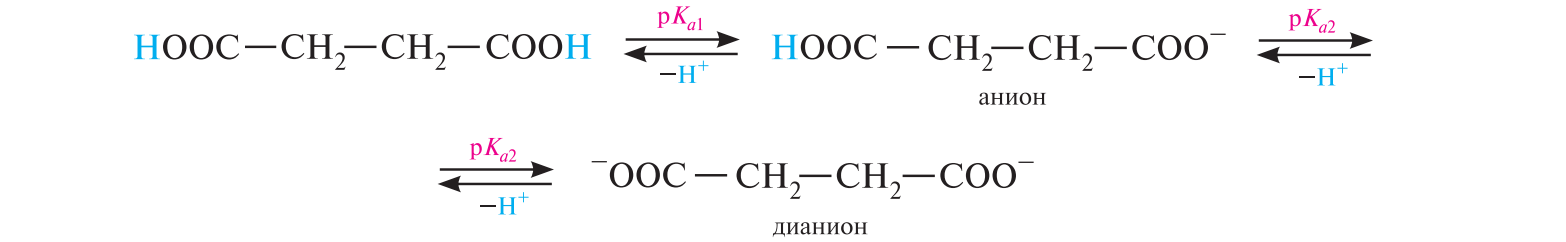 По первой ступени дикарбоновые кислоты обладают более сильными кислотными свойствами, чем монокарбоновые кислоты с аналогичным числом атомов углерода. Это обусловлено взаимным влиянием карбоксильных групп (отрицательный индуктивный эффект). Вторая карбоксильная группа, обладая электроноакцепторными свойствами, способствует делокализации заряда аниона и тем самым повышает его устойчивость. По мере удаления карбоксильных групп друг от друга их взаимное влияние ослабевает, вследствие чего кислотность по первой ступени снижается. Отрыв протона от второй карбоксильной группы происходит значительно труднее из-за низкой стабильности дианиона. Поэтому по второй ступени кислотность дикарбоновых кислот значительно ниже. По химическим свойствам дикарбоновые кислоты во многом сходны с монокарбоновыми. Они образуют нейтральные и кислые соли [MOOC–(CH2)n–COOM, HOOC–(CH2)n–COOM], полные и неполные сложные эфиры [ROOC–(CH2)n–COOR, HOOC–(CH2)n–COOR], полные и неполные галогенангидриды [HalOC–(CH2)n–COHal, HOOC–(CH2)n–COHal]. Дикарбоновые кислоты проявляют и ряд специфических свойств, в частности по-разному относятся к нагреванию, некоторые ‒ способны образовывать циклические имиды. Так, янтарная кислота при нагревании образует циклический ангидрид, а при нагревании с аммиаком – циклический амид: 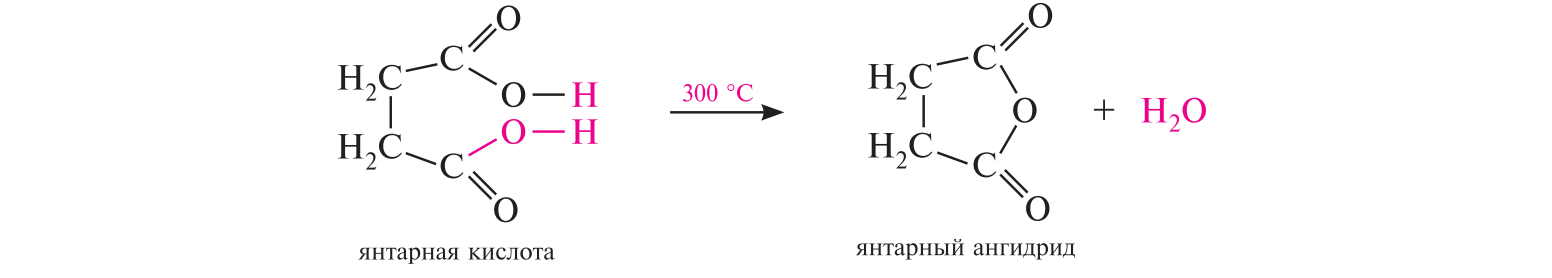 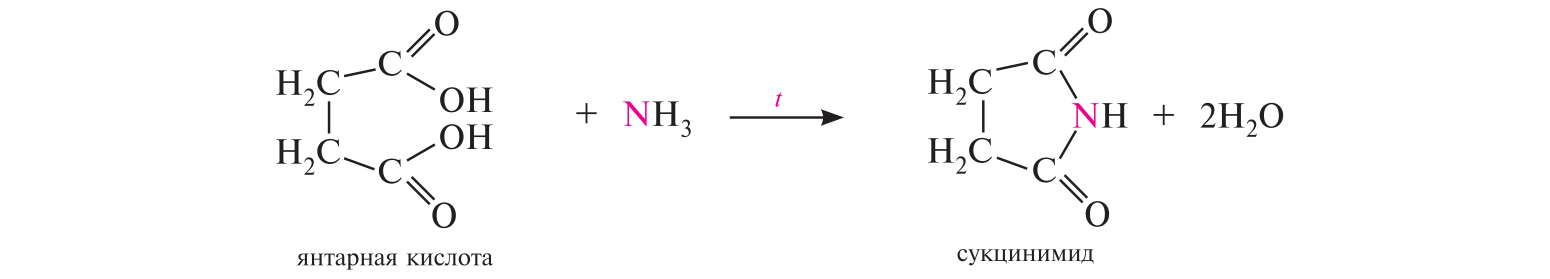 Вопрос 33.Химические свойства оксикислот, обусловленные спиртовой группой. Напишите соответствующие уравнения реакций с лимонной кислотой. Ответ. Реакционная способность оксикислот обусловлена наличием в их структуре двух функциональных групп – карбоксильной и гидроксильной. С участием гидроксильной группы алифатические гидроксикислоты вступают в реакции, характерные для спиртов. Так, они образуют простые и сложные эфиры. Для получения сложных эфиров в качестве ацилирующих реагентов используют галогенангидриды или ангидриды кислот. 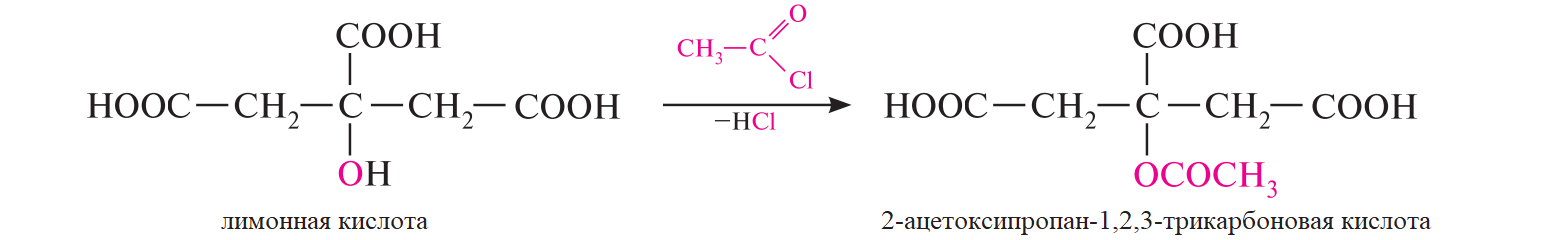 При взаимодействии с галогеноводородами (HCl, HBr) происходит нуклеофильное замещение OH-группы на атом галогена.  Вопрос 50.Отличие в строении, свойствах, происхождении гликогена от крахмала. Напишите уравнение реакции гликолиза гликогена и ее распространение в природе. Ответ. Если у большинства растений резервным полисахаридом является крахмал, то в животных организмах эту функцию выполняет гликоген. Этот полисахарид снабжает организм глюкозой при повышенных физических нагрузках и в промежутках между приемами пищи. Гликоген построен аналогично амилопектину крахмала, но представляет собой еще более разветвленную структуру. Связь глюкопиранозных остатков в основной и боковых цепях α-1,4, а в местах разветвления – α-1,6. Между точками разветвления содержится 10…12, реже – 2…4 моносахаридных остатков:  Молекулярная масса гликогена может достигать 100 млн и выше. В отличие от большинства других резервных полисахаридов гликоген хорошо растворим в воде. Сильная разветвленность цепей гликогена способствует атаке его ферментами с разных сторон одновременно. Это обстоятельство приводит к чрезвычайно высокой скорости расщепления полисахарида и, следовательно, возможности почти мгновенной мобилизации заключенных в нем энергетических запасов. При гидролизе гликоген расщепляется до декстринов (смесь полисахаридов с меньшей молекулярной массой), дальнейший гидролиз которых приводит к мальтозе, а затем к D-глюкозе: Вопрос 55.Химические свойства третичных аминов. Ответ подтвердите соответствующими уравнениями реакций для триметиламина. Какие химические реакции имеют распространение в природе? Ответ. Реакционная способность алкиламинов определяется главным образом наличием у атома азота неподеленной пары электронов. За счет пары электронов атома азота амины, с одной стороны, способны присоединять протон от кислоты, проявляя при этом основные свойства, а с другой – могут атаковать в молекуле реагента электрофильный центр (чаще атом углерода, несущий частичный или полный положительный заряд) и образовывать химическую связь с ним, проявляя нуклеофильные свойства. Являясь производными аммиака, алкиламины, подобно аммиаку, проявляют ярко выраженные основные свойства, которые обусловлены наличием на атоме азота неподеленной пары электронов. Причем алкиламины являются более сильными основаниями, чем аммиак. Водные растворы алкиламинов имеют щелочную среду: С кислотами алкиламины образуют соли алкиламмония: При действии на аммониевую соль сильного основания – натрия гидроксида – высвобождается исходный амин: Реакцию солеобразования с последующим выделением свободного амина часто используют для очистки аминов. В результате взаимодействия с галогеналканами в структуру амина вводят алкильный заместитель, и поэтому эта реакция получила название "реакции алкилирования". При взаимодействии с галогеналканами третичные амины образуют четвертичные аммониевые соли:  Третичные амины не содержат при атоме азота атома водорода и поэтому в реакцию ацилирования не вступают. Они также не реагируют с азотистой кислотой в обычных условиях. Третичные алкиламины при окислении водорода пероксидом или пероксикислотами R–CO–OOH образуют N-оксиды аминов: Амины широко распространены в природе, так как образуются при гниении живых организмов. Например, с триметиламином вы встречались неоднократно. Запах селедочного рассола обусловлен именно этим веществом. Вопрос 62.Номенклатура, распространение аминокислот в природе. Напишите уравнения реакций взаимодействия аланина с NaOH и HCl. Ответ. Названия аминокислот образуют из тривиальных или систематических названий соответствующих карбоновых кислот и префикса амино-. В случае тривиальных названий для обозначения положения аминогруппы относительно карбоксильной группы используют буквы греческого алфавита α, β, γ и др.; в систематических их названиях – цифровые локанты, причем начинают нумерацию с атома углерода карбоксильной группы. Для аминокислот, входящих в состав белков, чаще всего применяют тривиальные названия (глицин, валин и др.). Ароматические аминокислоты бензольного ряда рассматривают как производные бензойной кислоты.  Уравнения реакций взаимодействия аланина с NaOH и HCl запишутся следующим образом: 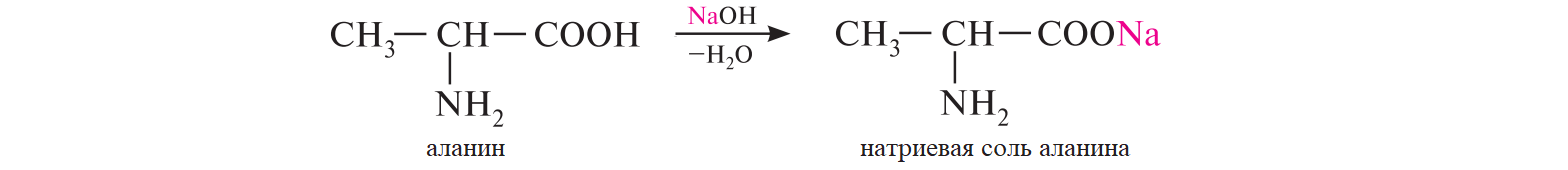 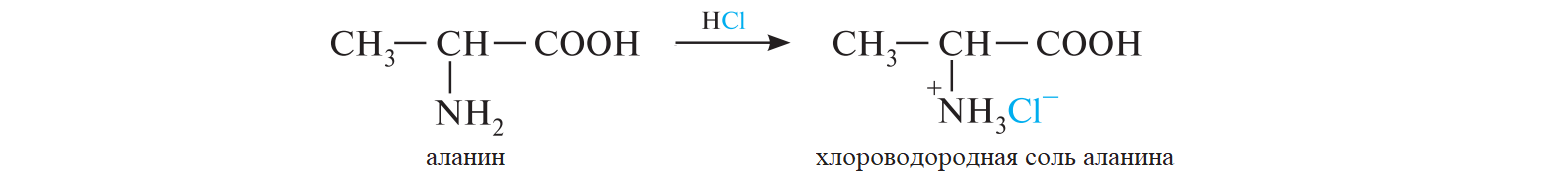 Аминокислоты широко распространены в природе. Так, в состав большинства белков входит около 25 различных α-аминокислот общей формулы RCH(NH2)COOH, из которых примерно 20 присутствуют в каждой белковой молекуле. Вопрос 72.Пиррол, его строение, свойства. Биологическая роль пиррола и его производных. Ответ. Пиррол – ароматический пятичленный азотистый гетероцикл, содержащийся в костном масле (которое получают при сухой перегонке костей), а также в каменноугольной смоле:  Как известно, признаком ароматичности соединения является наличие плоской циклической системы, имеющей замкнутую цепь сопряжения, содержащую (4n+2) π-электронов. Ароматичность пиррола обусловлена тем, что в сопряжение с π-электронами двойных связей вступает неподеленная пара электронов гетероатома N. В результате образуется замкнутая сопряженная система, в которой число обобщенных электронов соответствует правилу Хюккеля (4n+2). В присутствии сильных минеральных кислот пиррол осмоляется, образуя полимерные продукты темного цвета. Это свойство, получившее название "ацидофобность", обусловлено присоединением протона, преимущественно к α-углеродному атому цикла, что приводит к нарушению ароматичности кольца. Затем происходит полимеризация образовавшейся диеновой структуры, протекающая с сохранением цикла: 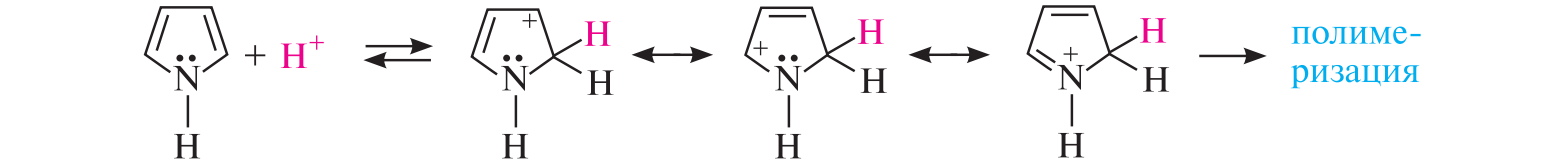 Являясь π-избыточной ароматической системой, пиррол легко вступает в характерные для ароматических соединений реакции электрофильного замещения. В первую очередь замещается атом водорода при α-углеродном атоме и только в случае, если это положение занято, замещение протекает в β-положении. Такая направленность замещения обусловлена тем, что при участии α-углеродных атомов образуется более устойчивый σ-комплекс, благодаря большей возможности для делокализации положительного заряда. Нитрование пиррола, учитывая его ацидофобность, проводят не самой азотной кислотой, а продуктом взаимодействия азотной кислоты с уксусным ангидридом – ацетилнитратом: 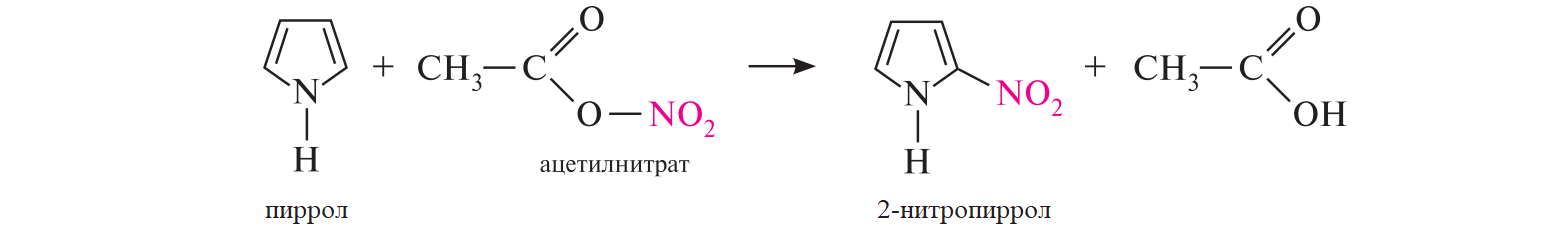 Для сульфирования пиррола в качестве электрофильного реагента вместо серной кислоты применяют комплекс пиридина с серы (VI) оксидом – пиридинсульфотриоксид:  Для ацилирования пиррола в качестве электрофильных реагентов используют ангидриды кислот в присутствии кислот Льюиса, чаще SnCl4 или ZnCl2:  Пиррол с галогенами реагирует очень легко, образуя тетрагалогенопирролы. Для получения моногалогенозамещенных производных пиррола требуются специальные условия. Так, при действии на пиррол сульфурилхлорида SO2Cl2 происходит постепенное замещение атомов водорода на атомы галогена: 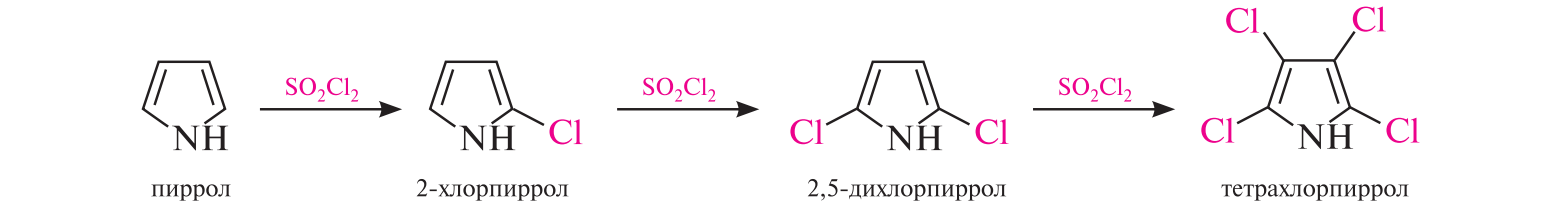 Пиррол гидрируется водородом в момент выделения (действием цинка в уксусной кислоте). При этом происходит частичное восстановление кольца с образованием ненасыщенного гетероцикла – 2,5-дигидропиррола (3-пирролина). Полное восстановление пиррольного цикла происходит при гидрировании над платиновым или палладиевым катализатором и приводит к образованию тетрагидропиррола (пирролидина): 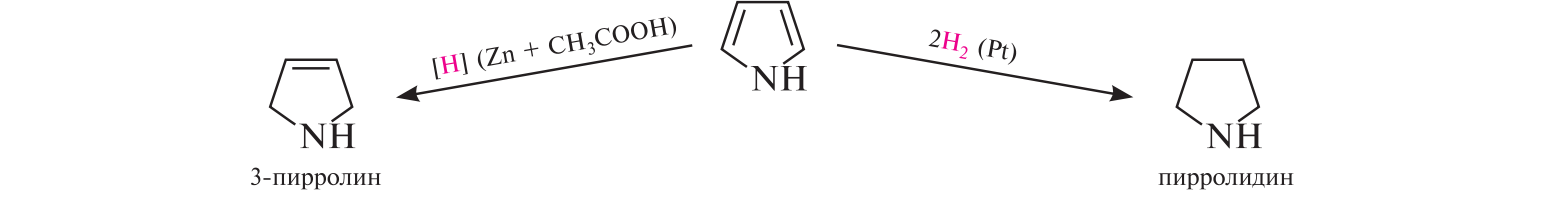 Пиррол очень чувствителен к действию окислителей и окисляется уже кислородом воздуха. При окислении происходит разрыв гетероциклического ядра, и образуются полимерные соединения. При окислении пиррола хромовой кислотой образуется имид малеиновой кислоты:  Как было сказано выше, в молекуле пиррола неподеленная пара электронов гетероатома азота принимает участие в образовании π-электронной ароматической системы. Поэтому пиррольный атом азота не способен присоединять протон, то есть не может быть центром основности. Однако участие пиррольного атома азота в сопряжении способствует поляризации связи N-H и тем самым увеличивает подвижность атома водорода, что приводит к появлению у пиррола свойств слабой NH-кислоты. Пиррол, являясь слабой NH-кислотой, взаимодействует с металлическим калием, безводным калия гидроксидом, металлическим натрием и литием в жидком аммиаке, с калия и натрия амидами, а также магнийорганическими соединениями, образуя соли:  Пиррол является родоначальником обширного класса соединений, относящихся к порфиринам (производным порфина), – это гемоглобин, хлорофилл, билирубин (красящее вещество желчи). В живой клетке эти пигменты синтезируются из порфобилиногена, участвующего в процессе основного метаболизма. 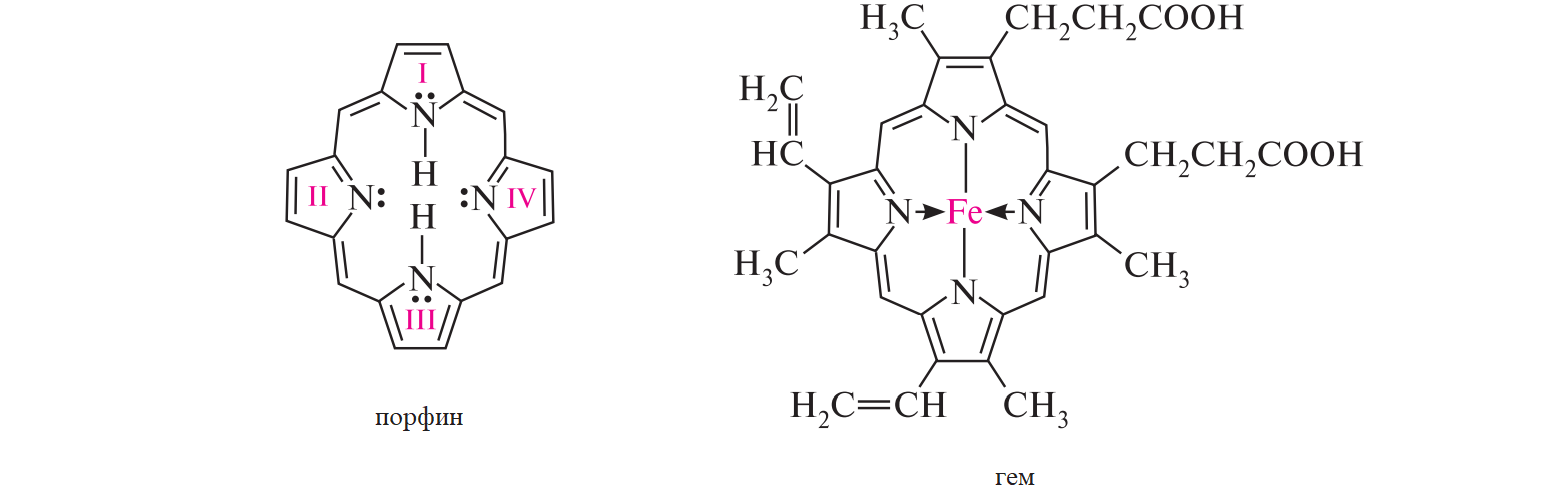 К биологически важным конденсированным производным пиррола относится бензо[b]пиррол – индол. Ниже приводятся некоторые биогенные его производные. 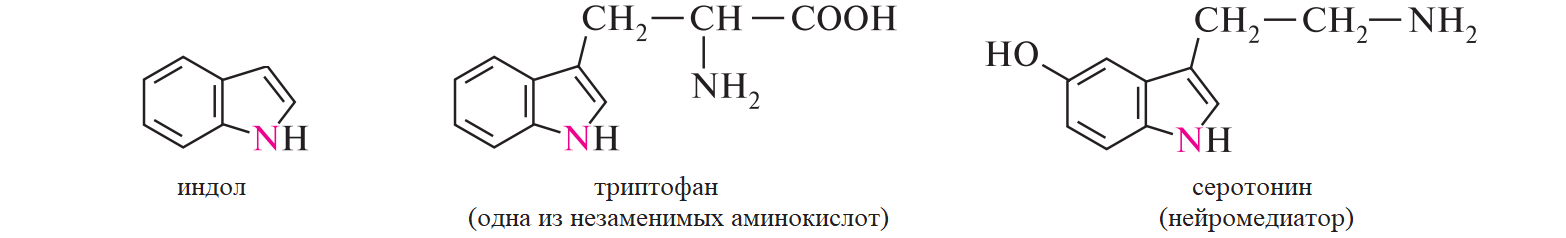 Список литературыОсновная 1. Степаненко Б.Н. Курс органической химии: В 2т. - М: Высшая школа. 1981. - 67с. 2. Грандберг И. И. Органическая химия. - М. : Высшая школа, 1980. - 265с. Дополнительная 1. Тюкавкина Н.А., Бауков Ю. И. Биоорганическая химия. - М.: Медицина, 1991. - 350с. 2. Петров И.П., Вальян А.И., Трощенко B. Г. Курс органической химии. - М.Высшая школа, 1974. - 189с. 3. Жиряков В.Г. Органическая химия. - М. Высшая школа, 1966. - 50с. 4. Пацак И. Органическая химия. - М.: Мир, 1966. 5. Овчинников Ю. А. Биоорганическая химия. - М.: Просвещение, 1987. - 284с. |
