Класс
|
Химические свойства
|
Способы получения
|
Алканы
СnH2n+2
|
1.Характерная реакция – свободнорадикальное замещение:
СН4 + Cl2 (свет) → CH3Cl + HCl
2. Дегидрирование:
СН3-СН3 (t, Pt)→СН2=СН2 + Н2
{алкан 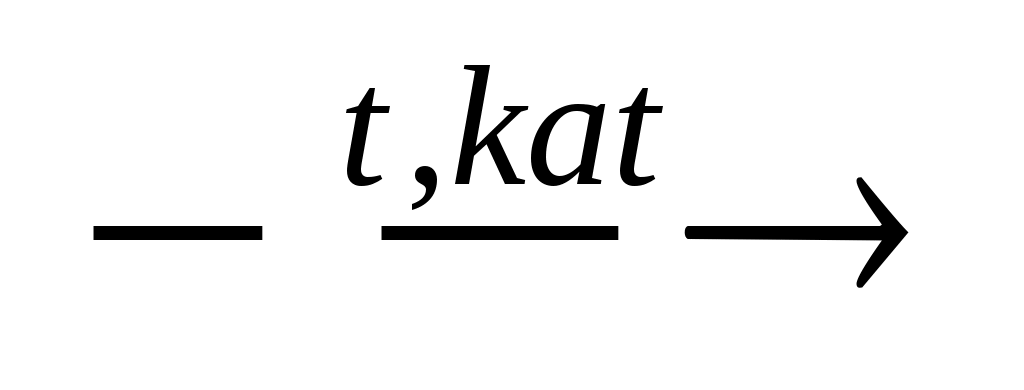 алкен + водород} алкен + водород}
3.Горение: CH4 +2O2 → CO2 +2H2O
4.Изомеризация: СН3-СН2-СН2-СН3(t, AlCl3)→ CH3-CH(3 CH)-CH3
бутан изобутан
5.Термическое разложение: СН4 (t=1000оС) → С+ 2Н2
2СН4 (15000C) → НС≡СН+ 2Н2
метан этин (ацетилен)
|
1.Выделение из нефти и природного газа
2.Изомеризация
3.Гидрирование алкенов:
С2Н4 + Н2 (Pt, t)→C2H6
4. Синтез Вюрца
2R-Br + 2Na →R-R + 2NaBr
5.Декарбоксилирование натриевых солей карбоновых кислот:
RCH2COONa + NaOH → RCH3 + Na2CO3
|
Алкены
CnH2n
|
1.Характериная реакция – присоединение по двойной связи:
а) гидрирование: СН2=СН2 + Н2 (t, Pt) →C2H6
б) галогенирование: СН2=СН2 + Br2 (t, Pt) →CH2Br- CH2Br –кач. реакция
в) гидрогалогенирование: СН3-СН=СН2 + HBr →CH3-CHBr-CH3 правило.Марковникова: водород присоединяется к наиболее гидрированному атому углерода.
г) гидратация: СН2=СН2 + Н2О (Н2SO4) →C2H5OH
д) полимеризация: n CH2=CH2 (t,p,kt) → (-CH2-CH2-)n
2. Окисление: а) горение С2Н4 + 3О2 → 2СО2 + 2Н2О
б) неполное окисление: СН2=СН2 (KMnO4) →CH2OH-CH2OH – кач. реакция (Вагнера)
|
1.Крекинг нефтепродуктов
2.Дегидрирование алканов:
С2Н6 (t,Pt) → С2Н4 + Н2
3.Дегидратация спиртов:
С2Н5ОН (H2SO4, t=1500C) → С2Н4 + Н2O
4.Дегидрогалогенирование:
С2Н5Cl (KOH,спирт) → С2Н4 + НCl правило Зайцева: водород отщепляется от наименее гидрированного атома углерода
5.Дегалогенирование:
CH2Br-CH2Br + Zn→ СН2=СН2 +ZnBr2
|
Алкины
CnH2n-2
|
1.Характериная реакция – присоединение по тройной связи:
а) галогенирование: С2Н2 +Br2→ C2H2Br2;
C2H2Br2 + Br2→ C2H2Br4 – кач. реакция
б) гидрогалогенирование: : С2Н2 +НBr→ C2H3Br;
C2H3Br+ НBr→ C2H4Br2
в) гидрирование: С2Н2 +Н2 (t,Pt) → C2H4;
С2Н4 +Н2 (t,Pt) → C2H6
г) гидратацич (реакция Кучерова):
С2Н2 +Н2О (HgSO4, H2SO4) → CH3CH=O
д) тримеризация (реакция Зелинского): 3C2H2 (Cакт., t) → С6Н6
2. Горение:2C2H2 + 5O2 → 4CO2 + 2H2O
|
1. Метановый способ:
2СН4 (15000C) → С2Н2+ 2Н2
2. Карбидный способ:
CaC2 + 2H2O→ С2Н2 + Ca(OH)2
3. Дегидрогалогенирование:
CH2Br-CH2Br (2KOH,спирт) → С2Н2+ 2НBr
|
Алкадиены
CnH2n-2
|
1.Характериная реакция – присоединение по двойным связям:
Алкадиены присоединяют Н2, Hal2, HHal двумя способами:
1,2-присоединение: СН2=СН-СН=СН2 + Н2 → СН3-СН2-СН=СН2
1,4-присоединение: СН2=СН-СН=СН2 + Н2 → СН3-СН=СН-СН3
2. Полимеризация (протекает как 1,4-присоединение):
nСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n
|
1.Реакция Лебедева:
2С2Н5ОН (Al2O3, ZnO, t) →
СН2=СН-СН=СН2 + Н2 + 2H2O
2.Дегидрирование:
СН3-СН2-СН2-СН3→ СН2=СН-СН=СН2 + 2Н2
3. Дегидрогалогенирование:
СН2Br-CH2-CH2-CH2Br (2KOH, спирт) → СН2=СН-СН=СН2 + 2НBr
|
Арены
CnH2n-6
|
1. Реакция замещения:
а) бромирование: С6Н6 + Вr2 (FeBr3) → С6Н5Br + HBr
б)нитрование: С6Н6 + HNO3 (H2SO4) → С6Н5NO2 + H2O
2. Реакции присоединения (в жестких условиях):
а)гидрирование: С6Н6 + 3Н2 (FeBr3) → С6Н12
б) хлорирование: С6Н6 + 3Clr2 (УФ) → С6Н6Cl6
|
1. Дегидрирование циклогексана:
С6Н12 (t,Pt) → С6Н6 + 3Н2
2. Ароматизация алканов:
С6Н14 → С6Н6 + 4Н2
3. Тримеризация ацетилена:
3C2H2 (Cакт., t) → С6Н6
|
Предельные
одноатомные
спирты
СnH2n+1ОН
|
1. С щелочными и щелочноземельными металлами:
2Na +2 C2H5OH → 2 C2H5ONa + H2
2. С галогеноводородами: C2H5OH + HBr → C2H5Br + H2O
3. Межмолекулярная дегидратация (образование простых эфиров):
С2Н5ОН + С2Н5ОН (H2SO4, t<140oC) →C2H5OC2H5 + H2O
4. Внутримолекулярная дегидратация:
С2Н5ОН (H2SO4, t>140oC) → СН2=СН2 + Н2О
5. С кислотами (этерификация):
С2Н5ОН + СН3СООН→СН3СООС2Н5 + Н2О
6. Окисление: С2Н5ОН + [O] →СН3С=О + [O] →СН3СООН
7. CH3CH2OH+NH3 =(Kt) CH3CH2NH2(аминоэтан)+H2O
|
1. Гидролиз галогеналканов:
С2Н5Cl + KOH (H2O) → C2H5OH + KCl
2. Гидратация алкенов:
СН2=СН2 + Н2О (H2SO4) → C2H5OH
3. Гидрирование альдегидов:
СН3СН=О + Н2→ C2H5OH
4.Спиртовое брожение глюкозы:
С6Н12О6 (дрожжи) → 2C2H5OH + 2СО2
|
Многоатомные спирты
|
Помимо свойств, подобных свойствам одноатомных спиртов, многоатомные спирты реагируют с гидроксидом меди (II) при комнатной температуре – качественная реакция на многоатомные спирты:
CH2OH-CHOH-CH2OH + Cu(OH)2 →C3H5O3Cu + 2 H2O
|
Помимо способов, подобных способам получения одноатомных спиртов можно получить окислением алкенов:
СН2=СН2 (KMnO4) →CH2OH-CH2OH
|
Альдегиды
СnH2n+1СН=О
или СmН2mO
|
1. Восстановление: СН3СН=О + Н2 (Ni) →СН3СН2ОН
2. Окисление – качественная реакция на альдегидную группу:
а) реакция «серебряного зеркала»:
СН3СН=О + 2[Ag(NH3)2]OH (t) →СН3СООNН4 + 2Ag+ 3NH3 + H2O
б) гидроскидом меди (II) при нагревание:
СН3СН=О +Cu(O Н)2 (t) → СН3СООН +Cu2O + 2 Н2О
3. СН3СН=О + C2H5OH→ СН3СНОC2H5
|
OH
4. СН3СН=О + NH3→ СН3СНОH
|
NH2
|
1.Дегидрирование спиртов:
С2Н5ОН (Cu, t)→ СН3СН=О + Н2
2. Окисление спиртов:
С2Н5ОН + CuО→ СН3СН=О + Н2О + Cu
3. Реакция Кучерова:
С2Н2 +Н2О (HgSO4, H2SO4) → CH3CH=O
4. CH3-CHCl2 + 2NaOH→ CH3-CH=O +2NaCl + H2O
|
Предельные одноосновные карбоновые кислоты СnH2n+1СООН
или СmН2mO2
|
1. Диссоциация: СН3СООН → СН3СОО- + Н+
2. С металлами: 2СН3СООН + 2Na → 2СН3СООNa + H2
3. С основными оксидами:
2СН3СООН + CaO → (СН3СОО)2Ca + H2O
4. С основаниями (нейтрализации):
СН3СООН + NaОН → СН3СООNa + H2О
5. С солями более слабых кислот:
СН3СООН + К2СО3 → СН3СООК + H2О+ СО2
6. Со спиртами (этерификация):
СН3СООН + С2Н5ОН →СН3СООС2Н5 + Н2О
|
1. Окисление спиртов:
С2Н5ОН + [O] → СН3СООН
2. Окисление альдегидов:
СН3С=О + [O] →СН3СООН
3. Гидролиз сложных эфиров:
СН3СООС2Н5 + Н2О→ СН3СООН + С2Н5ОН
4. CH3-CCl3 + 3NaOH→ CH3-COOH+3NaCl + H2O
|
Моносахариды
Сn(H2O)m,
где n и m >3
|
1. Окисление альдегидной группы:
а) реакция «серебряного зеркала»:
СН2ОН(СНОН)4СН=О + Ag2O (t) → СН2ОН(СНОН)4СОOH + 2Ag
б) с гидроксидом меди (II) при нагревании:
СН2ОН(СНОН)4СН=О + Сu(OH)2 (t) → СН2ОН(СНОН)4СОOH + Сu2O + H2O
2. Восстановление альдегидной группы:
СН2ОН(СНОН)4СН=О + H2 (Ni,t) → СН2ОН(СНОН)4СH2OH
3. Как многоатомный спирт глюкоза взаимодействует с гидроксидом меди (II) при комнатной температуре с образованием ярко-синего раствора глюконата меди (II).
4. Реакции брожения:
а) спиртовое: С6Н12О6 (дрожжи) → 2C2H5OH + 2СО2
б) молочное: С6Н12О6 (бактерии) → 2СН3-СН(ОН)-СООН
в) маслянокислое:
С6Н12О6 (бактерии) → СН3СН2СН2СООН + 2Н2 + 2СО2
|
1. Из формальдегида:
6 НСН=О (Ca(OH)2) → С6Н12О6
2. Гидролиз крахмала:
(С6Н10О5)n + H2O (H2SO4, t) → n С6Н12О6
3. Фотосинтез:
6СО2 + 6 Н2О→ С6Н12О6 + 6О2
|
Дисахариды
С12Н22О11
|
1. Гидролиз:
а) сахароза + Н2О→ фруктоза + глюкоза
б) мальтоза + Н2О→ 2 глюкозы
в) лактоза + Н2О→ галактоза + глюкоза
|
1. Из природных источников
|
Полисахариды
(С6Н10О5)n
|
Крахмал – из остатков α-глюкозы, целлюлоза – из β-глюкозы
1. Гидролиз: (С6Н10О5)n + H2O (H2SO4, t) → n С6Н12О6
2. Этерификация: (С6Н10О5)n + 3n HNO3 →[(C6H7O5(NO2)3] + 3n H2O
3. При взаимодействии крахмала с иодом появляется фиолетовое окрашивание – качественная реакция на крахмал
|
|
Амины
H2N-R
|
1. Взаимодействие с кислотами СН3NH2 + HCl → CH3NH3Cl
2. Горение: 4 СН3NH2 + 9О2→ 4СО2 + 10 Н2О + 2N2
3. C галогеналканами: СН3NH2 + CH3Cl → (СН3 )2NH2Cl
4. С азотистой кислотой: СН3NH2 + HO-NO → CH3OH + N2 + H2O
|
1. Из галогенпроизводных алканов:
CH3Br + 2 NH3 → СН3NH2 + NH4Br
2. Восстановление нитропроизводных:
СН3NО2 + 6[H] → СН3NH2 + 2H2O
3. Из спиртов
CH3CH2OH+NH3 =(Kt) CH3CH2NH2+H2O
|
Аминокислоты
H2N-R-COOH
|
1. Образование внутренних солей: NH2CH2COOH → +NH3CH2COO- биполярный ион
2. С основаниями (нейтрализация):
NH2CH2COOH + NaOH→ NH2CH2COONa + H2O
3. С кислотами: NH2CH2COOH + HCl→ClNH3CH2COOH
4. Образование полипептидов:
n NH2CH2COOH →(- NH-CH2-CO -)n + (n-1) H2O
|
1. Из карбоновых кислот:
СН3СООН + Cl2 (Ркр)→ ClСН2СООH + HCl
ClСН2СООH + 2NH3 → NH2CH2COOH + NH4Cl
2. Гидролиз белков.
|
Белки
|
1. Денатурация – разрушение вторичной, третичной и четвертичной структур белков под воздействием внешних факторов.
2. При гидролизе белков образуется смесь аминокислот.
3. Горят с образованием азота, углекислого газа и воды.
4. Цветные раекции:
а) ксантопротеиновая (на бензольное кольцо) – желтое окрашивание при взаимодействии с конц. Азотной кислотой при нагревании
б) биуретовая (на пептидные связи) – фиолетовое окрашивание при действии Cu(OH)2 в щелочной среде
|
1. Из природных источников
2. Синтез из аминокислот
|
 Скачать 76 Kb.
Скачать 76 Kb.