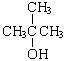Одноатомные, многоатомные спирты 9.04. Лекция предельные одноатомные спирты. Многоатомные спирты
 Скачать 207 Kb. Скачать 207 Kb.
|
|
ЛЕКЦИЯ Предельные одноатомные спирты. Многоатомные спирты. Классификация спиртов. Спирты - органические соединения, в состав молекул которых входит одна или несколько гидроксильных групп, соединенных с углеводородным радикалом. По числу гидроксильных групп в молекуле спирты делятся на одноатомные, двухатомные трехатомные и т. д.
Общая формула одноатомных спиртов - R—OH. По типу углеводородного радикала спирты делятся на предельные, непредельные и ароматические.
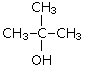
Предельные одноатомные спирты. Общая формула предельных одноатомных спиртов - CnН2n+1—OH. Органические вещества, содержащие в молекуле гидроксильные группы, непосредственно связанные с атомами углерода бензольного кольца называются фенолами. Например, C6H5—OH - гидроксобензол (фенол). По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R—CH2—OH), вторичные (R—CHOH—R') и третичные (RR'R''C—OH) спирты.
Номенклатура и изомерия. Название спирта образуется прибавлением суффикса -ол к названию соответствующего углеводорода или на основе углеводородного радикала. Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия (предельные одноатомные спирты изомерны простым эфирам - соединениям с общей формулой R—O—R') Изомеры и гомологи
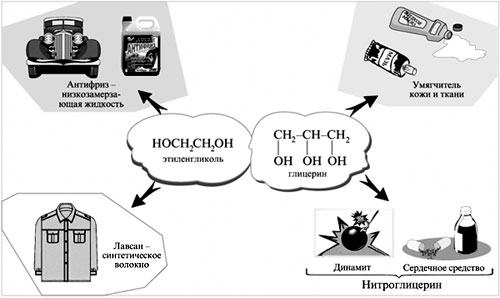
Алгоритм составления названий одноатомных спиртов Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа. Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа. Назовите соединение по алгоритму для углеводородов. В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа. Физические свойства спиртов во многом определяются наличием между молекулами этих веществ водородных связей: 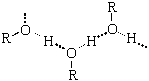 С этим же связана и хорошая растворимость в воде низших спиртов. Простейшие спирты - жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных - больше, чем у третичных. Метанол крайне ядовит. Химические свойства спиртов Горение: C2H5OH + 3O2 Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства): Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них). 2Na + 2H—O—H 2Na + 2R—O—H Атомы натрия легче восстанавливают те атомы водорода, у которых больше положительный частичный заряд ( Атом кислорода как бы "насыщается", и за счет этого связь O—H оказывается менее поляризованной, чем в молекуле воды ( В результате атомы натрия труднее восстанавливают атомы водорода в молекулах спиртов, чем в молекулах воды, и реакция идет намного медленнее. Иногда, основываясь на этом, говорят, что кислотные свойства спиртов выражены слабее, чем кислотные свойства воды. Из-за влияния радикала кислотные свойства спиртов убывают в ряду метанол С твердыми щелочами и с их растворами спирты не реагируют. Реакции с галогеноводородами: C2H5OH + HBr Внутримолекулярная дегидратация (t > 140oС, образуются алкены): C2H5OH Межмолекулярная дегидратация (t < 140oС, образуются простые эфиры): 2C2H5OH Окисление (мягкое, до альдегидов): CH3CH2OH + CuO Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный "фруктовый" запах альдегида). Получение спиртов Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH Гидратация алкенов: C2H4 + H2O Брожение глюкозы : C6H12O6 Синтез метанола: CO + 2H2 Многоатомные спирты Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных с углеводородным радикалом. Группы -ОН в многоатомных спиртах размещаются у разных атомов углерода: 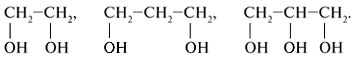 Соединения с двумя группами -ОН при соседних атомах углерода называют гликолями (или диолами). ПолучениеГликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха в присутствии серебряного катализатора алкены превращаются в двухатомные спирты: 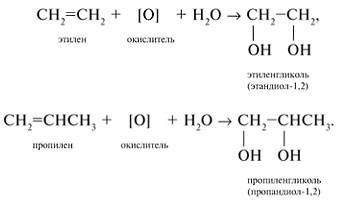 Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов: 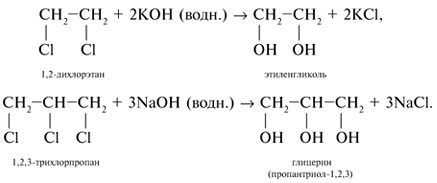 На производстве глицерин получают по схеме: 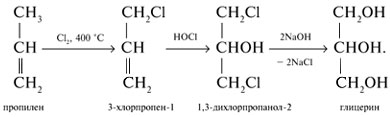 Физические свойстваЭтиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. Химические свойстваЭтиленгликоль и глицерин подобны одноатомным спиртам. 1. Так, они реагируют с активными металлами: 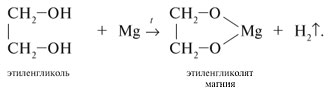 2. Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена: 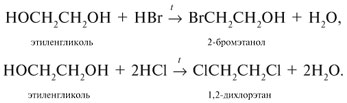 3.Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды: 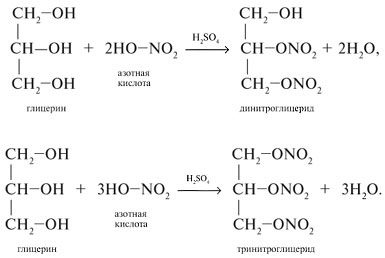 4.Качественная реакция многоатомных спиртов, позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH)2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II): 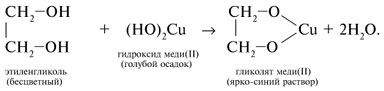
Задания для самоконтроля 1. Как получить этанол из этана двумя способами? 2. Как из бутанола-1 получить бутанол-2? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||