вершило. Соли сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков
 Скачать 56 Kb. Скачать 56 Kb.
|
|
Вариант 9 9. Соли - сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков. 1. Из металлов: Fe + S = FeS Zn +2 HCl = ZnCl2 + H2 Fe + CuCl2 = FeCl2 + Cu 2.Из оксидов: SO3 + 2 NaOH = Na2SO4 + H2O CuO + H2SO4 = CuSO4 + H2O Na2O + CO2 = Na2CO3 3. Реакция нейтрализации: HCl + NaOH = NaCl + H2O 4. Из солей: NaCl + AgNO3 = NaNO3 +AgCl ↓ CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4 2NaCl + H2SO4 = 2HCl + Na2SO4 29. ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь). Орбитали существуют независимо от того, находится на них электрон (занятые орбитали), или отсутствует (вакантные орбитали). Атом каждого элемента, начиная с водорода и заканчивая последним полученным на сегодня элементом, имеет полный набор всех орбиталей на всех электронных уровнях. Их заполнение электронами происходит по мере увеличения порядкового номера, то есть, заряда ядра. s-Орбитали- имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат р-орбитали- имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность d-Орбиталей-форму двух гантелей, перекрещивающихся в двух узловых взаимно перпендикулярных плоскостях, всего 5, на каждой может поместиться по два электрона, т.е. всего десять электронов. 79Au)2)8)18)32)18); 1s22s22p63s23p63d104s24p64f145s25p65d106s1. Валентными электронами атома золота считаются электроны, расположенные на 5d— и 6s— подуровнях. Энергетическая диаграмма основного состояния принимает следующий вид: 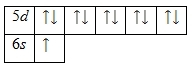 Наличие одного неспаренного электрона свидетельствует о том, что для золота характерна степень окисления +1. 49. Ионная связь – химическая связь между разноименными ионами, обусловленная их электростатическим притяжением. Ее можно считать предельным случаем ковалентной связи, когда разность электроотрицательностей связанных атомов так велика, что происходит полное разделение зарядов. Различие в значении электроотрицательности тем больше, чем дальше элементы расположены друг от друга в периодической системе по периоду. Эта связь характерна для металлов и неметаллов, особенно расположенных в наиболее удаленных группах, например, I и VII. Пример: поваренная соль, хлорид натрия NaCl: Механизм образования связи. Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается. Рассмотрим способ образования на примере «хлорида натрия» NaCl. Атомы натрия и хлора с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Так, электростатическое взаимодействие в вакууме катиона Na+ и аниона Cl- приводит к образованию существующей в парах двухатомной молекулы NaCl. Взаимодействие этих молекул приводит к их конденсации и образованию ионных кристаллов хлорида натрия NaCl. И в молекуле Na+Cl-, и в кристаллах NaCl почти не происходит обобществления электронов: атом натрия почти полностью отдаёт электрон атому хлора. Оба атома при этом приобретают устойчивые конфигурации благородных газов: В отличие от ковалентной связи, ионная связь не обладает направленностью. Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Ионная связь не обладает насыщаемостью. Это объясняется тем, что система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создаёт в окружающем пространстве электрическое поле. Это означает, что два разноимённых иона, притянувшиеся друг к другу, сохраняют электростатически взаимодействовать с другими ионами. Типичными ионными соединениями являются KCl и NaBr. Схемы превращения ионов в нейтральные атомы: Между ионами N a + {\displaystyle {\mathsf {Na^{+}}}} Ионная связь достаточно сильна – разрушить ее при помощи тепловой энергии крайне сложно, а потому вещества с ионной связью имеют высокую температуру плавления. В то же время радиус взаимодействия ионов достаточно низкий, что обуславливает ломкость подобных соединений. Важнейшими ее свойствами являются ненаправленность и ненасыщаемость. Ненаправленность происходит из формы электрического поля иона, которое представляет собой сферу и способно взаимодействовать с катионами или анионами во всех направлениях. При этом поля двух ионов не компенсируются полностью, вследствие чего они вынуждены притягивать к себе дополнительные ионы, образуя кристалл, – это и есть явление, называемое ненасыщаемостью. В ионных кристаллах нет молекул, а отдельные катионы и анионы окружены множеством ионов противоположного знака, количество которых зависит в основном от положения атомов в пространстве. 209. Очистка таких металлов, как медь и цинк, может осуществляться с помощью электролиза. Очистка металлов называется рафинированием Неочищенная медь играет в этом процессе роль анода, а очищенная медь-роль катода; в качестве электролита может использоваться раствор сульфата меди(II). На аноде протекает полуреакция Сu(тв.) =Cu2+(водн.) + 2е- Примеси, высвобождаемые при растворении неочищенной меди на аноде, опускаются на дно электролизера, образуя так называемый анодный ил. Этот ил может содержать драгоценные металлы, например золото и серебро. Переходящие в раствор ионы меди разряжаются и осаждаются на чистом медном катоде. Эта полуреакция описывается уравнением Cu2 +(водн.) = Сu(тв.) + 2е- Примеси (анодный ил) |
