Химия. химия 22 1. 2. Химическое строение определяет свойства вещества
 Скачать 85.17 Kb. Скачать 85.17 Kb.
|
|
Билет 1 Теория. 1. Атом – сложная частица, состоящая из ядра ( образованного из протонов и нейтронов) и электронов. Электрон в атоме находится в постоянном движение вокруг ядра по электронной орбитали. Электронные орбитали имеют разную форму. В основном s-орбиталь(шар) и p-орбитали(гантелеобразная) . 2. 1.Атомы в молекулах соединяются в определенном порядке, с учетом их валентности. Последовательность соединения атомов в молекуле называется химическим строением. 2.Химическое строение определяет свойства вещества. 3.Зная свойства вещества можно узнать его строение. Зная строение вещества можно предположить его свойства. 4. Атомы в молекулах влияют друг на друга, от этого влияния зависят свойства вещества. 2.Практическая часть В пробирку закрыли пробкой с газоотводной трубкой, конец которой опустили в другую пробирку, перевернутую вверх дном. Наблюдаем выделение пузырьков газа водорода. Спустя некоторое время вторую пробирку перевернули и поднесли осторожно горящую лучину. Водород сгорает, на стенках пробирки конденсируется вода.  2 билет. Теория 1. Электронные конфигурации атомов – формула показывающая расположение электронов по уровням и под уровням. Есть 4 энергетических уровня. Есть 3 типа орбиталей: s-орбиталь p-орбиталь d-орбиталь. С-орбиталь выглядит как шар, п орбиталь гантелеобразная, д орбиталь четырехлистный клевер. 2. Органические соединения подразделяют по составу: углеводороды, кислородосодержащие, азотосодержащие, углеводы. Углеводороды есть предельные и непредельные. Предельные – Алканы, непредельные –Алкены, Алкины. Кислородосодержащие- спирты, альдегиды, кислоты, эфиры. Азотосодержащие- амины, аминокислоты, белки. Углеводы- моносахара, дисахара, полисахара. Практика 1. Ну надо в разные пробирки налить соляную кислоту разной концентрации и добавить кусочки цинка. И доказать что от концентрации зависит скорость реакции с цинком. Билет 3. Теория 1. Валентные возможности атомов определяются : числом неспареных электронов в основном и возбужденном состояние, наличием свободных орбиталей, наличием неподдельных электронных пар на внешнем энергетическом уровне атома. 2. Изомерия- (от греческого ровный и часть, доля) явление существования химических соеденений изомеров, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и по свойствам. Виды изомерии : пространственная, структурная, углеродного скелета Практика 1. Гидролиз хлорида цинка. ZnCl2 + HOH ⇄ ZnOHCl + HCl Провести опыт, произвести гидролиз хлорида цинка. Соль+вода. Билет 4. Теория 1. Переодический закон Менделеева : Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера). Периодическая таблица Менделеева состоит из групп и периодов. В системе 18 групп и 8 периодов. 1.Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются. 2.Размеры атомов при перемещении слева направо вдоль периодов уменьшаются. 3. При движении сверху вниз по группе увеличиваются восстановительные металлические свойства. 4.Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются. В ячейке элемента есть информация о: символе элемента, названии элемента, порядковом номере, Атомная масса, латинское название. 2. Реакции в органической химии: Реакции замещения Реакции присоединения Реакция отщепления Реакция изомеризации и перегруппировка Реакции окисления Реакции конденсации и поликонденсации Реакции разложения Практика 1. кислоты и щелочи имеют особенности изменять окраску индикаторов. Прильем в каждую пробирку лакмус. В нейтральной среде лакмус имеет фиолетовую окраску. В пробирке со щелочью (гидроксид натрия) лакмус окрасится в синий цвет; в пробирке с соляной кислотой приобретает красную окраску. Хлорид натрия - соль, окраска лакмуса не изменится. В пробирку с хлоридом натрия прильем нитрат серебра. Выпадет белый осадок. NaCl + AgNO3 = NaNO3 + AgCl. Билет 5. Теория 1. Ионная химическая связь- связь образовавшаяся электростатического притяжения катионов с ионами. Чаще всего именно так связаны в соединениях щелочные и щелочноземельные металлы с галогенами. Поскольку у щелочных металлов электроотрицательность ниже, их атомы становятся катионами, а атомы галогенов — анионами. 2. Основными природными источниками углеводородов являются природный и попутный нефтяной газы, нефть и каменный уголь. Эти виды природных ресурсов еще называют горючими ископаемыми, так как их практическое применение основано на способности выделять энергию при сгорании. Практика 1. Согни проволоку расположи по возрастанию трудности сгибания . Там должно получиться : алюминий железо медь. Билет 6. Теория 1. Ковалентная связь бывает полярной и неполярной. Полярная ковалентная связь - связь между атомами с разной электроотрицательностью. Встречается в кислотных оксидах, кислотах, солях. Неполярная ковалентная связь - связь между атомами с одинаковой электроотрицательностью. Встречается в простых вещ-вах. 2. Алканы – углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле СnН2n+2. Строение молекулы метана – пирамида тетраэдра. Получение - Алканы в промышленности получают из нефти, а в лаборатории реакциями гидрирования ненасыщенных углеводородов, нагреванием солей карбоновых кислот со щелочами, реакцией Вюрца. Физ.свойства- метан – газ без цвета вкуса и запаха. Углеводороды состава С5Н12 до С12Н32- жидкости, более тяжелые – твердые вещества. Температура кипения и плавления алканов постепенно увеличивается с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде. Химические свойства . Дегидрирование ( отщепление водорода) При пропускании алканов над катализатором при высокой температуре 400 градусов по Цельсия происходит отщепление молекулы водорода и образование алкена. Применение: Очень широко применяется в промышленности. Соединения, полученные из метана, применяют для получения веществ и материалов. Метан используют как источник водорода в синтезе аммиака, а так же синтезированного газа который используют для горючего. Практическая 1. В пробирку насыпали немного перманганата калия, внутрь положили комочек ваты и закрыли ее пробкой с газоотводной трубкой. Затем укрепили пробирку на штативе так, чтобы конец трубки доходил до дна стакана, в котором будет собираться кислород. Нагрели пробирку, собрали полный стакан кислорода (полноту стакана проверяем по тлеющей лучине, она вспыхивает) и закрыли стакан картоном.  Билет 7. Теория 1. Металлическая химическая связь – это связь, которую осуществляют относительно свободные электроны между ионами металлов, образующих кристаллическую решётку. Состояние катионов и атомов постоянно изменяется: атомы металлов отдают электроны и превращаются в катионы. Катионы, напротив, принимают электроны и становятся атомами. Электроны могут свободно передвигаться по всему кристаллу. Металлы обладают электрической проводимостью. 2. Алкены – ациклические углеводороды содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n. Получение – Дегидрация спиртов ( отщепление воды) Физические свойства : Первые 3 представителя гомологического рода – газы, вещества состава С5Н10 до С16Н32 – жидкости, высшие алкены- твердые вещества. Температура кипения и плавления закономерно возрастает при увеличение молекулярной массы соединений. Химические свойства: Гидрирование алкенов ( реакция соединения)-Алкены способны присоединять водород в присутствии катализаторов. Применение : Используется в химической промышленности как сырье для получения разнообразных органических веществ и материалов. Этен – является исходным веществом для производства этанола этиленгликоля эпоксидов и дихлорэтана. Большее кол-ва этена перерабатывается в полиэтилен. Практическая 1. Получить гидроксид меди (II) можно с помощью растворов сульфата меди (II) и гидроксида натрия. CuSO₄ + 2NaOH → Cu(OH)₂↓ + Na₂SO₄ Растворить можно аммиаком Билет 8. Теория 1. Водородная связь - химическая связь между положительно поляризованными атомами водорода одной молекулы и атомами сильно электроотрицательных элементов другой или той же молекулы. Если водородная связь образуется между разными молекулами, она называется межмолекулярной (например, между молекулами воды, низжих спиртов). 2. Алкины – ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующее формуле С2Н2n-2. Получение: Метановый способ. Нагревание метана до температуры 1500 градусов по Цельсию приводит к образованию ацетелена. Эта реакция эндотермична (то есть проходит с поглощением тепла). При высокой температуре происходит смещение равновесия в сторону образования ацетелена. Продукты необходимо быстро охладит, что бы предотвратить разложение образовавшегося ацетелена. Физические свойства Температуры кипения и плавления алкинов, так же как и алкенов закономерно повышаются при увеличение молекулярной массы соединений. Имеют специфический запах. Они лучше растворяются в воде, чем алкены и алканы. Химические свойства Гидрогалогенирование ( присоединение галогеноводорода) Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, так же идет в две стадии. Применение: сырье для производства органических соединений и материалов- альдегидов, кетонов, растворителей, веществ для получения синтетического каучука, поливинилхлорида и других полимеров. Практическая 1. В 3 пробирки налить соляную кислоту и поместить туда цинк алюминий и железо В зависимости от природы металла реакции будут по разному проходить. Ну, тип скажешь вот да на скорость реакции повлияла природа металлов. Более активные металлы, например цинк реагируют быстрее. Билет 9. Теория 1. Есть 3 типа гибридизации электронных орбиталей sp3 sp2 sp Сп3 это одна с орбиталь и 3 п орбитали в гибридизации это будет выглядеть как. Это четыре сп3 гибридные орбитали 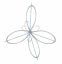 сп2 это 3 сп2 гибридные орбитали сп2 это 3 сп2 гибридные орбитали СП это 2 сп гибридные орбитали СП это 2 сп гибридные орбитали ИХ ЗАРИСОВАТЬ НАДО БУДЕТ ИХ ЗАРИСОВАТЬ НАДО БУДЕТ2. Алкадиены- ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные между атомами углерода в соответствующей формуле СnН2n-2. Есть 3 вида алкадиенов: алкадиены с кумулированным расположением двойных связей, алкадиены с сопряженными двойными связями, алкадиены с изолированными двойными связями. Все они существенно отличаются друг от друга по строению и свойствам. Получение: Метод Лебедева. Дегидратация и дегидрирование этилового спирта одновременно. Физические свойства. В обычных условиях пропадиен-1,2, бутадиен-1,3-газыЯ,2-метилбутадиен-1,3-летучая жидкость. Алкадиены с изолированными двойными связями-жидкости. Высшие диены-твердые вещества. Химические свойства. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды. Особенностью присоединения к алкадиенам с сопряженными двойными связями является способность присоединять молекулы как в положение 1 и 2, так в положение 1 и 4. Используют для синтеза синтетического каучука. Практическая 1. Получить гидроксид меди (II) можно с помощью растворов сульфата меди (II) и гидроксида натрия. CuSO₄ + 2NaOH → Cu(OH)₂↓ + Na₂SO₄ При нагревании нерастворимых основании происходит разложение оных на оксид металла и воду. В данном случае, образуется черный порошок оксида меди. Cu(OH)2= CuO+H2O Билет 10. Теория 1. Дисперсная система-система, состоящая из двух или более веществ, причём одно из них в виде очень маленьких частиц равномерно распределено (диспергировано) в объёме другого. Есть три дисперсных сред газ жидкость и твердое вещество. Есть дисперсные фазы г1/г2, ж/г,т/г, жж,гж,тж и тому подобные 2. Циклоалканы-относится к карбоноцикличиским углеводородам. Циклоалканы- циклические углеводороды, не содержащие в молекуле кратных связей и соответсвующие общей формуле СnНn2. Все атомы находятся в сп3 гибридизации. Получение 1.Гидрирование бензола. При католическом гидрирование бензола и его гомологов образуются соответственно циклоалкан или его производные. Хим свойства: реакция присоединения – гидрирование(при повышение температуры) Применение Используются в медицине в качестве анастезирующего ингаляционного средства. Для синтеза других органических веществ. Для получения нейлона и капрона. Используется в нефтехимической промышленности. Практика 1. Налей крч в пробирку примерно 2 мл сульфата меди 2 и в него опусти скрепку или че там у тебя будет. Короче в итоге скрепка должна через какое то время покрыться тонким слоем меди, а раствор позеленеть. CuSO4 + Fe ⟶ FeSO4 + Cu Билет 11. Теория 1. Истинный раствор- гомогенная система переменного состава, образованную не менее чем 2мя независимыми компонентаи. Свойства истинного раствора одинаковы во всем объеме. Компоненты такого раствора – которые можно выделить из системы и которые могут существовать в изолированном виде. 2.Важнейшое ароматическое соед. – бензол С6Н6 Записывается формулой Кекуле 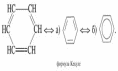 Физ свойства – в обычных условиях токсичные вещества. Плохо растворяются в воде, но хорошо в органических растворителях. Химические свойства Бромирование. Один из атомов водорода в бензольном кольце замещается на атом брома. Получение. Дегидрирование ( воздействие температуры) Применение бензола и его гомологов. Применяется как растворитель и сырье для ароматических соединений, полимеров, лекарственных препаратов. Тринитротолуол - мощное взрывчатое вещество. Практика 1.Короче ты налей просто все спирты прост в воду в разных пробирках. Какие то смешаются какие то нет вот и все. Если спросят почему то потому что у них разная молекулярная масса, а по мере роста молекулярной массы растворимость спиртов в воде ухудшается. Билет 12. Полимеры – вещества, в молекулах которых многократно повторяются одинаковые структурные звенья. Бывают как органические так и синтетические. Органические – крахмал, нуклеиновые кислоты, целлюлоза, белки. Синтетические- пластмасса, волокна, каучуки. Вещество из которого получается полимер называют мономером. 2. Спирты- органические вещества молекулы которых содержат одну или несколько гидроксильных групп соединенных с углеводородным радикалом. Разделяют по числу гидроклисльных групп: одноатомные, двухатомные( гликоли ), трехатомные. По характеру углеводородного радикала: предельные, непредельные, ароматические. По характеру атома углерода с которым связана гидроксильная группа: первичные, вторичные, третичные. Физические свойства: низшие и средние спирты – предельные, содержащие от 1 до 11 атомов углерода – жидкости. Высшие сприты комнатной температуры – твердые вещества. Низшие имеют алкогольный запах и жгучий вкус хорошо растворимы в воде. По мере увеличение углеводородного радикала растворимость в воде снижается. Этанол уже не смешивается с водой. Химические свойства. Окисление проводят сильными окислителями в кислой среде. Самые известные представители –Этанол ( этиловый спирт), метанол, этиленгликоль, пропантриол(глицерин). Глицерин используют для лекарств, пищевой промышленности, в косметических продуктах. Им опрыскивают табак и используют как пластификатор для целлофану. Этиленгликоль используют как антифриз. Этанол для употребления и как растворитель. Практика. Парафиновую свечу подожги в широком стаканчике химическом, при горение будут образовываться на стенках капельки влаги, это доказывает что в парафине есть водород. Убери от туда свечу и налей туда не много известковой воды прозрачной, она должна помутнеть, это будет значить что там есть углерод, образуется карбонат кальция. Билет 13. Теория 1. химические реакции классифицируются на : по отсутствию поверхности раздела между реагентами, по тепловому эффекту, по изменению степеней окисления реагентов, по направлению протекания, по наличию катализатора, по числу и составу исходных веществ и продуктов реакций. По отсутствию поверхности раздела между реагентами-гомогенные и гетерогенные. По тепловому эффекту-экзотермические и эндотермические. По изменению степеней окисления-окислительно-востановительные реакции и без изменения степеней окисления. По направлению реакции-обратимые и необратимые. По наличию катализатора-каталитические и не каталитические. По числу и составу исходных веществ и продуктов реакций- соединение,разложение, замещение и обмен. 2. Практическая часть. Взять железный порошок и скрепку или проволоку. Две пробирки с соляной кислотой , в одну добавить порошок во вторую скрепку или проволоку Билет 14. Теория 1. Скорость химических реакций-изменение концентрации реагирующих веществ в единицу времени. Факторы влияющие на скорость хим. Реакции: природа реагентов, концентрация, площадь соприкосновения, температура, катализаторы и ингибиторы. 2. Практика. Карбонат натрия смешать с водой, если растворяется, то поддается гидролизу. Если нет то не поддается гидролизу. Билет 15.Теория 1. Все реакции делятся на обратимые и необратимые. Обратимые реакции- протекают в прямом и обратном направление. Необратимые — протекают в одном направление. Химическое равновесие — состояние химической системы при котором скорость прямой реакции равна скорости обратной. На химическое равновесие влияет концентрация, изменение давления, температуры. При увеличении концентрации какого-либо реагента, система будет смещаться в сторону расходования добавленного компонента. При увеличение давления равновесие смещается в сторону больших газов. При увеличении температуры равновесие смещается в сторону эндотермической реакции. 2 Практическая 1. в разных пробирках сделай раствор соляной кислоты разных концентраций. Потом засунь туда индикатор. Где концентрация меньше индикатор должен быть менее кислотным. Билет 16. Теория 1. Электролитическая диссоциация — процесс в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с водой. Это обратимый процесс. У диссоциации есть 3 ступени. Наибольшая концентрация продукта, средняя, наименьшая. У серной кислоты только наибольшая и наименьшая. Соль при диссоциации образуют катионы металла и анионы. Диссоциации не подвергаются нерастворимые соли, кислоты и основания. 2. Практика 1. В пробирку 3-5 капель пероксида водорода 10%. Заметить что в обычных условиях заметного разложения не видно. К пероксиду водорода добавить несколько крупинок диоксида марганца. Заметить выделение пузырьков газа. Поднести тлеющую лучинку. Отметить что выделяющийся газ -кислород. Билет 17 Теория 1. Гидролиз- обменная реакция вещества с водой, приводящая к его разложению. Гидролиз не возможен с солью образованной сильным основанием и сильной кислотой. Гидролиз процесс обратимый, но необратим, если в результате реакции образуется нерастворимое основание и(или) летучая кислота. 2. Практика. Для получения этилена Билет 18 теория 1. 2. Практика. Билет 19 теория 1. 2. практика. Билет 20 теория 1. 2. практика. Билет 21 теория 1. 2. практика. Билет 22 теория 1. 2. практика. Билет 23 теория 1. 2. практика. Билет 24 теория 1. 2. практика. Билет 25 теория 1. 2. практика. |
