Лабораторная работа 8 Поташев Н.В. Опз-22-1. Отчет по лабораторной работе Окислительновосстановительные реакции
 Скачать 39.47 Kb. Скачать 39.47 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования Иркутский НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ технический университет Институт Заочно-вечернего обучения Отчет по лабораторной работе «Окислительно-восстановительные реакции» по дисциплине «Химия»
Иркутск 2023 г. Лабораторная работаОкислительно-восстановительные реакции Выполнение работыОпыт 1. Влияние рН среды на окислительно-восстановительные реакцииВ три пробирки налить по 2-3 мл раствора перманганата калия. В первую пробирку прилить 1-2 мл разбавленной серной кислоты, во вторую 1-2 мл дистиллированной воды, в третью – 1-2 мл концентрированного раствора щелочи. В каждую пробирку добавить по одному шпателю кристаллического сульфита натрия. Отметить наблюдения, учитывая, что фиолетовая окраска характерна для ионов MnO4‾, бесцветная или слабо-розовая − для ионов Mn2+, зеленая – для ионов MnO42−, бурый цвет имеет осадок MnO2. Требования к результатам опыта: 1. Написать уравнения реакций. В каждой реакции указать окислитель, восстановитель, среду, процессы окисления и восстановления. Составить электронный баланс к каждой реакции, на основании которого расставить коэффициенты в уравнении. 2. Сделать вывод о влиянии среды на процесс восстановления марганца. 1.Уравнения реакций взаимодействия KMnO4 с Na2SO3 a)в кислой среде: окислитель восстановитель среда Mn+7 + 5e → Mn+2 2 - окислитель b)в щелочной среде: окислитель восстановитель среда Mn+7 + 1e → Mn+6 2 - окислитель c)в нейтральной среде: окислитель восстановитель среда Mn+7 + 3e → Mn+4 2 - окислитель 2.Вывод о характерной степени окисления марганца · в кислой среде: Mn+7 → Mn+2 · в щелочной среде: Mn+7 → Mn+6 · в нейтральной среде: Mn+7 → Mn+4 Опыт 2. Окислительно-восстановительная двойственность нитрита натрия В пробирку налить 1-2 мл раствора перманганата калия, добавить 1-2 мл разбавленной серной кислоты. Затем прилить раствор нитрита натрия. Отметить изменение окраски раствора. В другую пробирку налить раствор йодида калия, добавить 1-2 мл разбавленной серной кислоты. Затем прилить раствор нитрита натрия. Отметить цвет раствора. Затем добавить раствор крахмала и отметить появление синей окраски. Объяснить, чем обусловлено изменение цвета раствора. Требования к результатам опыта 1. Составить уравнения реакций. Указать в каждой реакции окислитель, восстановитель, среду, процессы окисления и восстановления. Составить электронный баланс к каждой реакции, на основании которого расставить коэффициенты в уравнении. 2. Сделать вывод об окислительно-восстановительных функциях нитрита натрия в проведенных реакциях. 1. · Уравнения реакций (I) окислитель среда восстановитель N+3 – 2e → N+5 3 - восстановитель · Уравнения реакций (II) восстановитель среда окислитель 2.Вывод об окислительно-восстановительных функциях KNO2 Нитрит калия KNO2 содержит азот в степени окисления +3 · Реакция (I): N+3 → N+5 ⇒ KNO2 – восстановитель · Реакция (II): Общий вывод: Вещества, которые содержат элемент в промежуточной степени окисления, в зависимости от условий проведения реакции может быть и окислителем, и восстановителем (в присутствии сильных окислителей проявляют восстановительные свойства, а при взаимодействии с активными восстановителями являются окислителями). Эти вещества могут проявлять окислительно-восстановительную двойственность. Опыт 3. Окислительно-восстановительная двойственность пероксида водорода В пробирку налить 1-2 мл раствора пероксида водорода, добавить 1-2 мл разбавленной серной кислоты. Затем прилить раствор йодида калия. Отметить изменение окраски раствора. В другую пробирку налить раствор перманганата калия, добавить 1-2 мл разбавленной серной кислоты. Затем прилить раствор пероксида водорода. Отметить изменения цвета раствора. Требования к результатам опыта 1. Составить уравнения реакций. Указать в каждой реакции окислитель, восстановитель, среду, процессы окисления и восстановления. Составить электронный баланс к каждой реакции, на основании которого расставить коэффициенты в уравнении. 2. Сделать вывод об окислительно-восстановительных функциях пероксида водорода в проведенных реакциях. Уравнение реакции, учитывая, что продуктом окисления йода в щелочной среде является йода натрия NaIO3.  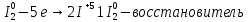 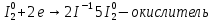 Общий вывод: Вещество содержит элемент в промежуточной степени окисления и молекулы этого элемента реагируют друг с другом как окислитель и как восстановитель. Это вещество может участвовать в реакциях диспропорционирования. Опыт 4. Реакция диспропорционированияПоместить в пробирку 1–2 кристалла йода, добавить 3-5 капель концентрированного раствора щелочи, слегка нагреть. Затем добавить раствор серной кислоты и наблюдать появление желтой окраски раствора, характерной для свободного йода. Требования к результатам опыта 1. Составить уравнение реакции, указать окислитель, восстановитель, среду, процессы окисления и восстановления. Составить электронный баланс к реакции, на основании которого расставить коэффициенты в уравнении. 2. Сделать вывод, какие вещества могут участвовать в реакциях диспропорционирования. В сухую пробирку помещу небольшое количество Уравнение реакции: 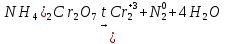 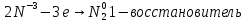 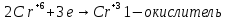 Вывод: эта реакция – реакция внутримолекулярная. |
