физ.химия. Химический потенциал
 Скачать 18.29 Kb. Скачать 18.29 Kb.
|
|
14.Химический потенциал, его физический смысл. Химический потенциал идеального газа. Хими́ческий потенциа́л {\displaystyle \mu } — термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. Определяет изменение термодинамических потенциалов (энергии Гиббса, внутренней энергии, энтальпии и т. д.) при изменении числа частиц в системе. Представляет собой энергию добавления одной частицы в систему без совершения работы. Применяется для описания материального взаимодействия. Определение химического потенциала можно записать в виде: dE=TdS−PdV+μdN Физический смысл Химический потенциал характеризует изменение внутренней энергии системы при добавлении в систему одной частицы, когда система при этом не получала тепла и не совершала работу Химический потенциал Для идеального газа G= 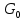 + nRT ln(p/ + nRT ln(p/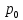 ) )Уравнение выражает изменение энергии Гиббса при переходе системы к давлению р атм от давления 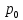 в качестве которого используют давление в 1 атм. в качестве которого используют давление в 1 атм.Величина nRTln(p/ 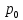 ) отражает работу перехода системы к давлению р атм от давления ) отражает работу перехода системы к давлению р атм от давления 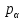 Если продифференцировать уравнение по количеству вещества, то получим уравнение для изобарного потенциала 1 моля идеального газа, который называется химическим потенциалом идеального газа: µ= 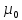 + RT ln(p/ + RT ln(p/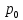 )= )=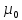 + RT ln p, + RT ln p,где 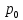 -1 атм, -1 атм, 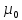 – стандартный химический потенциал, зависящий от температуры. – стандартный химический потенциал, зависящий от температуры.17.Влияние давления на химическое равновесие. Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием. Давление в замкнутой реакционной системе обусловлено наличием в ней газообразных веществ: чем их больше, тем больше давление. Поэтому изменение внешнего давления повлияет на равновесие только в тех случаях, когда в нем участвуют газообразные вещества, причем количество их в прямой и обратной реакциях разное. Если в системе, находящейся в состоянии химического равновесия, увеличить давление, то преимущественно будет протекать реакция, в результате которой уменьшается количество газообразных веществ; при уменьшении давления преимущественно протекает реакция, в результате которой увеличивается количество газообразных продуктов. |
